单增李斯特菌国标检验培养基质量的比较
2022-02-15余文安琳崔生辉
余文,安琳,崔生辉
(中国食品药品检定研究院,北京 100050)
单核细胞增生李斯特氏菌(Listeria monocytogenes,LM,以下简称单增李斯特菌)为细胞内寄生的革兰氏阳性无芽孢杆菌,是引起人畜共患病的重要食源性致病菌[1-3],它可以污染生肉、熟肉制品、蛋类等多种食品[4]。单增李斯特菌可以在冷藏条件下生长,其污染水平是确定冷藏食品安全性的关键因素[5]。低浓度(102CFU/g)的污染即可感染高危人群,包括新生儿、孕妇和免疫缺陷者等[6-7],引起败血症、脑膜炎及单核细胞增生等多种疾病,死亡率高达20%~30%[8-10]。鉴于单增李斯特菌致病力较强[11-12],GB 29921-2021《食品安全国家标准预包装食品中致病菌限量》[13]中对熟肉制品和即食生肉制品中单增李斯特菌进行了明确的限量规定,并指定依据 GB 4789.30-2016《食品安全国家标准食品中微生物学检验单核细胞增生李斯特氏菌检验》[14](以下简称 GB 4789.30-2016)开展检验。
GB 4789.30-2016中使用李氏增菌肉汤(LB1、LB2)对食品中可能污染的单增李斯特菌进行两步选择性增菌,再划线到 PALCAM 琼脂培养基和李斯特氏菌显色培养基上对可疑菌落进行分离,并进行生化鉴定。其中 LB1、LB2增菌肉汤和选择分离培养基是影响单增李斯特菌分离效果的重要因素。GB 4789.28-2013《食品微生物学检验培养基和试剂的质量要求》[15](以下简称 GB 4789.28-2013)选用了一株单增李斯特菌(ATCC19115)和2株非目标菌(大肠埃希菌ATCC25922和粪肠球菌ATCC29212)采用了半定量的方法对 LB1、LB2增菌肉汤进行质控。但单增李斯特菌作为一个种,其遗传基础复杂,仅符合GB 4789.28-2013的培养基是否能满足常见单增李斯特菌的分离尚有待分析。
本研究使用30株单增李斯特菌和9株非单增李斯特菌对市售4个品牌的李氏增菌肉汤、6个品牌的PALCAM 琼脂培养基和李斯特氏菌显色培养基质量进行了对比分析,所获数据以期为培养基的质控、GB 4789.28-2013和GB 4789.30-2016修订提供数据参考。
1 材料与方法
1.1 培养基与菌株
李氏增菌肉汤(LB1、LB2)购自 A、B、C、D四个公司;李斯特菌显色培养基购自A、B、C、D、G、F六个公司;PALCAM琼脂培养基购自A、B、C、D、E、F六个公司;胰酪大豆胨琼脂培养基(TSA)购自美国BD公司。
本研究采用菌株包括实验室保存的30株单增李斯特菌和9株非单增李斯特菌(见表1)。30株单增李斯特菌包括标准菌株ATCC19115(源自美国菌种保藏中心)和29株本实验室从食品中分离的单增李斯特菌。
表1 9株非单增李斯特菌信息Table 1 Information of 9 non-Listeria monocytogenes
1.2 主要仪器
PL2002电子天平,梅特勒-托利多公司;MLS-3780高压灭菌器,日本三洋公司;Thermo 1389生物安全柜,美国THERMO公司;PR 205050 GCN生化培养箱,美国THERMO公司;全自动微生物螺旋加样系统,西班牙IUL公司;Viteck compact 2全自动微生物分析系统,法国梅里埃公司;BrukerAutoflexⅡ型基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption ionization time of flight mass spectrometry,MALDI-TOF MS),德国Bruker公司。
1.3 实验方法
1.3.1 菌株确认
使用全自动微生物分析系统和MALDI-TOF MS对30株单增李斯特菌进行确认。
1.3.2 李氏增菌肉汤比对
取30株单增李斯特菌和9株非单增李斯特菌的TSA平板二代新鲜培养物,加入无菌生理盐水中,制备 2.6~2.8麦氏浊度的菌悬液,用无菌生理盐水梯度稀释到合适倍数,采用E50模式螺旋涂布至TSA平板上,平行涂布两个平板,36 ℃培养24 h,进行计数。将LB1增菌肉汤1 mL分装于24孔板中,取合适浓度的菌液10 μL分别加入不同厂家的LB1增菌肉汤中(接种水平为300~500 CFU/孔),30 ℃培养24 h。取培养后的LB1增菌肉汤梯度稀释到合适倍数,采用E50模式螺旋涂布至TSA平板上,平行涂布两个平板,36 ℃培养24 h,进行计数。取10 μL LB1增菌肉汤接入1 mL LB2增菌肉汤中,30 ℃培养24 h。取LB2增菌肉汤梯度稀释到合适倍数,采用 E50模式螺旋涂布至 TSA平板上,平行涂布两个平板,36 ℃培养24 h,进行计数。
1.3.3 PALCAM 琼脂培养基和单增李斯特菌显色培养基比对
取30株单增李斯特菌和9株非单增李斯特菌的TSA平板二代新鲜培养物,加入无菌生理盐水中,制备 2.6~2.8麦氏浊度的菌悬液,用无菌生理盐水稀释到合适稀释度,采用E50模式螺旋涂布至PALCAM、单增李斯特菌显色培养基和参比TSA平板,平行涂布两个平板,36 ℃培养48 h后进行计数,接种水平为20~200 CFU/板。
1.3.4 选择性分离固体培养基的生长率计算
取出待测培养基及TSA参比培养基,选择菌落数在20~200 CFU的平板按照以下公式计算生长率(PR值):
式中:
PR——生长率;
NS——待测培养基平板上得到的菌落总数;
N0——参比培养基平板上得到的菌落总数。
1.3.5 李氏增菌肉汤及选择性分离固体培养基的统计学分析
按照GB 4789.28-2013要求推算,LB1、LB2肉汤增菌后的浓度须大于104CFU/mL,使用增菌后浓度相较标准浓度(104CFU/mL)倍数的对数(以下简称浓度倍数对数)进行分析,即增菌后的计数结果除以104再取对数。对30株单核细胞增生李斯特菌在4个品牌的培养基得到的浓度倍数对数,使用双因素方差分析(two-way ANOVA)分析培养基间差异,并使用配对t检验比较LB1与LB2两种增菌肉汤中平均生长浓度的差异。
对30株单增李斯特菌在6个品牌的PALCAM琼脂培养基和单增李斯特菌显色培养基上的生长率,使用双因素方差分析(two-way ANOVA)分析培养基间差异,并使用配对t检验比较PALCAM琼脂培养基和显色培养基上生长率的差异。
2 结果与讨论
2.1 李氏增菌肉汤的增菌效果比较
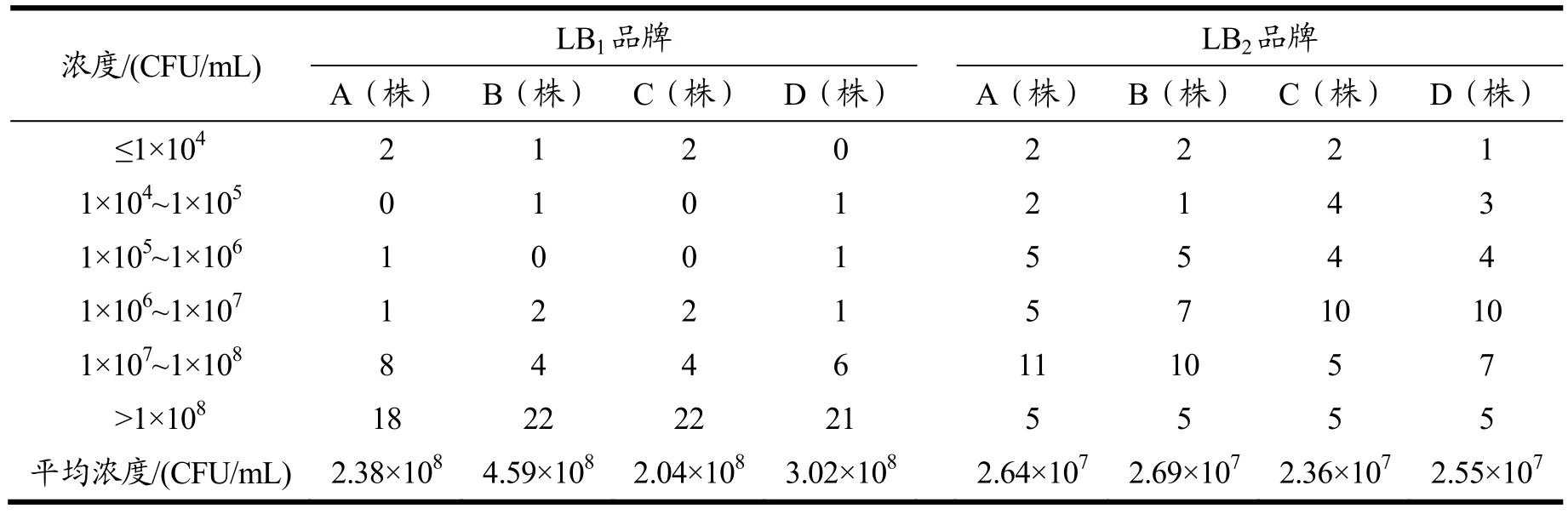
表2 30株单增李斯特菌在4个品牌李氏增菌肉汤LB1和LB2中增菌后浓度分布情况Table 2 Concentration distribution of 30 strains of Listeria monocytogenes in four brands of Listeria enriched broth LB1 and LB2

表3 单增李斯特菌在4个品牌李氏增菌肉汤LB1和LB2增菌后浓度比较(CFU/mL)Table 3 Comparison of concentration of Listeria monocytogenes after enrichment of LB1 and LB2in four brands of Listeria enriched brot(CFU/mL)
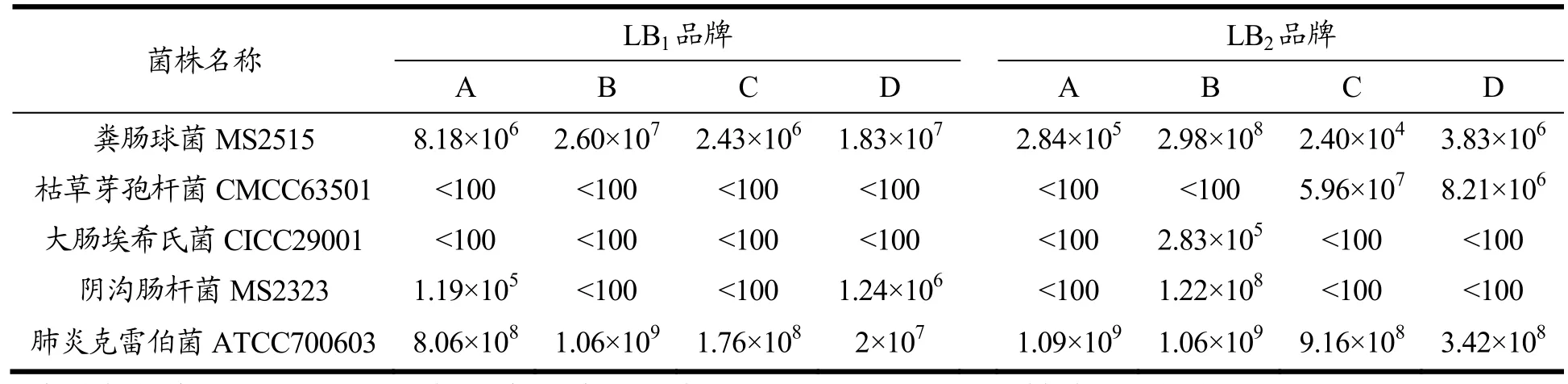
表4 非单增李斯特菌在李氏增菌肉汤LB1和LB2中24h增菌效果比较(CFU/mL)Table 4 Comparison of 24 h increasing effect of non-monocytosteria in Listeria increasing broth LB1 and LB2 (CFU/mL)
单增李斯特菌ATCC19115在4个品牌LB1肉汤中的生长浓度均可达到1×107CFU/mL以上,而在LB2肉汤中的生长浓度均低于2×105CFU/mL。30株单增李斯特菌在4个品牌的LB1中的平均生长浓度极显著性高于LB2中的平均生长浓度(tdf=119=10.03,p<0.01)。LB1增菌肉汤和LB2增菌肉汤中加入了不同浓度的萘啶酮酸和吖啶黄作为抑菌剂,LB1增菌肉汤中萘啶酮酸的浓度为 22.20 μg/mL,吖啶黄的浓度为 13.30 μg/mL;LB2增菌肉汤中萘啶酮酸的浓度为20 μg/mL,吖啶黄的浓度为25 μg/mL[14]。可见LB2增菌肉汤中萘啶酮酸的浓度几乎为 LB1增菌肉汤中的二倍,因此LB2抑菌性较LB1强,LB1增菌效果优于LB2。
30株单增李斯特菌在4个品牌LB1(F3,87=2.92,p<0.05)和LB2(F29,87=18.12,p<0.01)肉汤中的平均生长浓度可见显著性差异,其中B品牌的LB1增菌后浓度显著高于其余3个品牌(p<0.05)。LB1和LB2液体培养基的基础成分一致,为胰胨、多价胨、酵母膏、磷酸盐、氯化钠、和七叶苷。其中磷酸二氢钾、磷酸氢二钠等化学物质较为稳定,一般差异性不大,造成不同品牌LB1和LB2培养基质量差异的原因,多为胰胨、多价胨、酵母膏等营养成分的质量和配比差异。
6株单增李斯特菌在部分品牌的LB1和LB2肉汤的生长浓度低于 1×105CFU/mL,其中单增李斯特菌FC4278和FC11106在不同品牌肉汤中的生长状况最差(表3),其余24株单增李斯特菌在4个品牌的LB1和LB2肉汤的生长浓度超过1×105CFU/mL。FC4278和FC11106单增李斯特菌在4个品牌的李氏增菌肉汤中增菌效果不佳,上述结果提示,李氏增菌肉汤中的营养成分不能满足这2株单增李斯特菌的需求,且李氏增菌肉汤中的抑菌成分对这2株单增李斯特菌有一定的抑制作用。朱海华等[16]的研究中发现对单增李斯特菌的增菌效果更佳的增菌肉汤LB3。
大肠埃希氏ATCC25922、粪肠球菌ATCC29212、金黄色葡萄菌 ATCC25923和表皮葡萄球菌CMCC26609在4个品牌的LB1和LB2肉汤中均未见显著生长;粪肠球菌 MS2515、大肠埃希氏CICC29001、枯草芽孢杆菌CMCC63501和阴沟肠杆菌MS2323在部分品牌LB1或LB2肉汤中呈显著生长;肺炎克雷伯菌ATCC700603在所有品牌LB1和LB2肉汤中均呈显著生长(表4)。
2.2 不同品牌PALCAM琼脂培养基和李斯特氏菌显色培养基比对结果
30株单增李斯特菌在6个品牌的PALCAM琼脂培养基上的生长率存在极显著性差异(F5,145=13.16,p<0.01)。包括ATCC19115在内的13株单增李斯特菌在D品牌的PALCAM琼脂培养基上生长率低于0.5,其中1株菌在E品牌、4株菌在F品牌培养基上生长率低于0.5(表5),其余17株单增李斯特菌在所有品牌的PALCAM琼脂培养基上的生长率均超过0.5。30株单增李斯特菌在A、B和C品牌的PALCAM琼脂培养基上的生长率均高于0.5。
30株单增李斯特菌在6个品牌显色培养基上的生长率有著性差异(F5,145=2.32,p<0.05)。30株单增李斯特菌在A、B、C、D、G品牌显色培养基上的生长率均高于0.5,3株单增李斯特菌在F品牌培养基上的生长率低于0.5(表5)。
30株单增李斯特菌在显色培养基上的生长率极显著性高于 PALCAM 琼脂培养基上的生长率(使用A、B、C、D、F五品牌数据,tdf=149=3.74,p<0.01)。本研究结果提示,显色培养基对单增李斯特菌的检测效果优于 PALCAM 琼脂培养基。刘成文等、炊慧霞等[17,18]等也在研究中提到单增李斯特菌在显色培养基上的检出效率优于 PALCAM 琼脂培养基。李斯特菌在PALCAM琼脂培养基上被区分出来是基于β-D-葡萄糖苷酶的活性。这种酶裂解培养基中的七叶甙产生灰绿色菌落,然后通过降解产物七叶苷与柠檬酸铁铵中的铁离子反应,菌落周围产生棕黑色晕圈(6,7-二羟基香豆素)。培养基中的氯化锂和其它的抗生素能抑制革兰氏阴性菌和大多数革兰氏阳性菌生长。PALCAM 琼脂培养基不能将单增李斯特氏菌与其他李斯特氏菌区分开,因此需要进一步的鉴定分析来确定。李斯特氏菌显色培养基中的色素与李斯特氏菌具有的酶发生特异性反应,水解底物,释放出显色基团。在平板上,单增李斯特氏菌呈现出蓝色菌落,菌落周围有一圈白色晕环,抑制剂可抑制杂菌的生长。李斯特氏菌显色培养基能区分单增李斯特氏菌与绝大部分其他李斯特氏菌,但不能区分绵羊李斯特氏菌。然而绵羊李斯特氏菌在食品检测中非常少见。
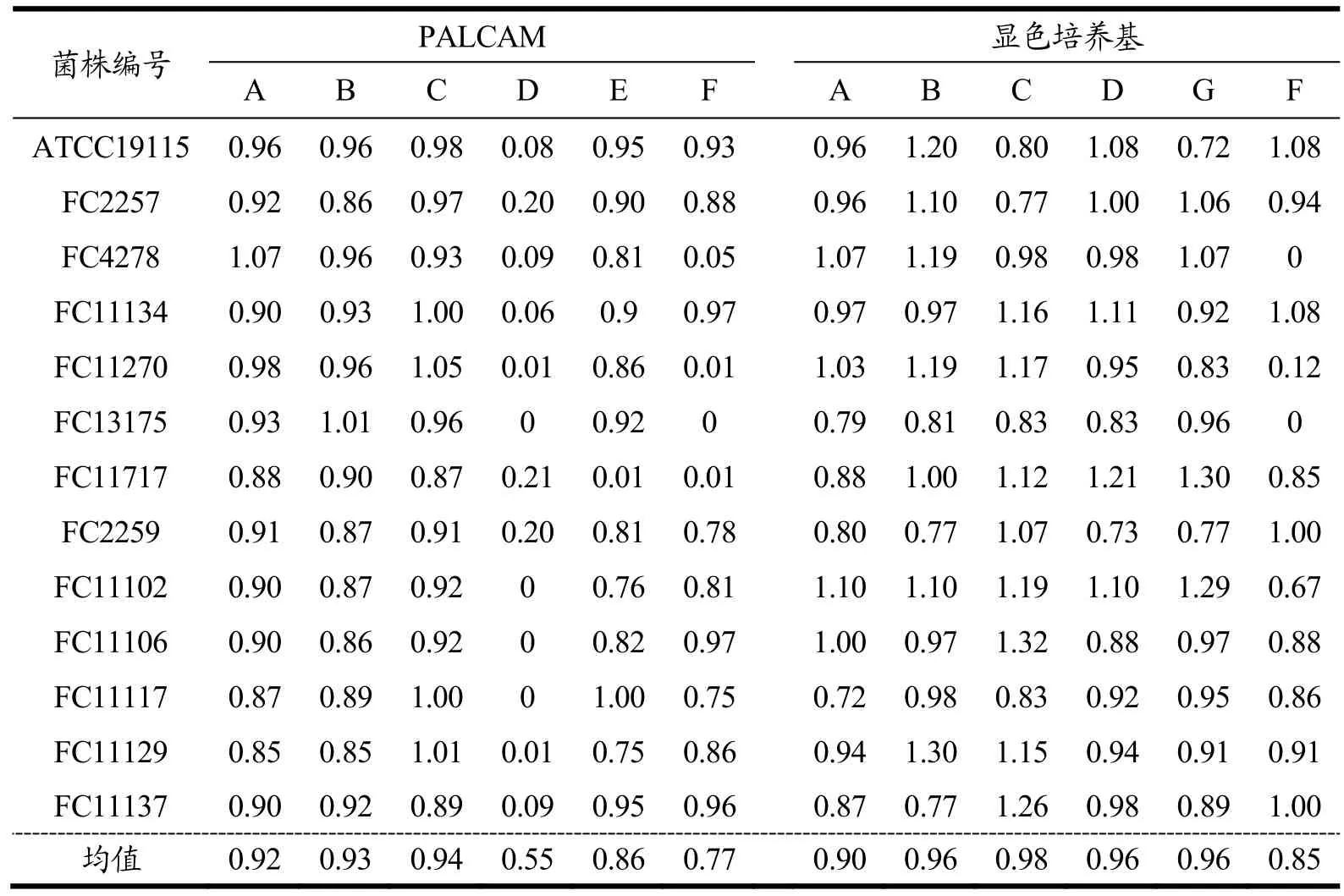
表5 单增李斯特菌在6个品牌PALCAM和显色培养基上生长率比较结果Table 5 Comparison of growth rate of Listeria monocytogenes on 6 brands of PALCAM and chromogenic medium

表6 非单增李斯特菌在PALCAM和显色培养基上的生长率Table 6 Growth rate of non-monoproliferative Listeria on PALCAM and chromogenic medium
9株非李斯特菌在品牌F的PALCAM琼脂培养基和品牌 G的显色培养基上均未见生长。大肠埃希菌ATCC25922和粪肠球菌MS2515在五个品牌的显色培养基和 PALCAM 琼脂培养基上均未见生长。金黄色葡萄菌 ATCC25923在 A、B、C、D四个品牌的PALCAM培养基上呈现不同程度的生长,但该菌在五个品牌显色培养基上均未见生长。表皮葡萄球菌CMCC26609在三个品牌PALCAM培养基和四个品牌显色培养基上均呈现良好生长。枯草芽孢杆菌CMCC63501和肺炎克雷伯菌ATCC700603仅在两个品牌的显色培养基上呈现良好生长,而阴沟肠杆菌MS2323仅在品牌 C的显色培养基上呈现良好生长(表6)。
3 结论
3.1 GB 4789.28-2013中选择了1株单增李斯特菌和2株非单增李斯特菌作为LB1、LB2增菌肉汤、PALCAM培养基和单增李斯特菌显色培养基的质控菌株。本研究选择了 30株不同来源的单增李斯特菌作为目标菌和9株非目标菌。目标菌的来源更广,更全面,非目标菌涵盖了食品中常见的致病菌,更具代表性。此外,GB 4789.28-2013中对LB1、LB2增菌肉汤采用的是半定量计数法,PALCAM培养基和单增李斯特菌显色培养基采用的是定量计数法进行质控。本研究采用了螺旋涂布计数法对市售的 4个品牌的李氏增菌肉汤、6个品牌的显色培养基和 PALCAM 琼脂培养基进行对比,此方法为定量计数法,较GB 4789.28-2013中半定量计数法更为准确。
3.2 本研究发现2株单增李斯特菌在4个品牌的李氏增菌肉汤中增菌效果均不佳,且LB1增菌肉汤中的平均生长浓度极显著性高于LB2增菌肉汤。上述结果表明GB 4789.30-2016方法中使用LB1配合LB2肉汤进行增菌存在漏检风险,且LB1增菌效果优于LB2。建议修订GB 4789.30-2016时,考虑使用LB1配合另一种对单增李斯特菌增菌效果更佳的肉汤,以提高单增李斯特氏菌的检出率。
3.3 市售的4个品牌的李氏增菌肉汤的增菌效果、6个品牌的 PALCAM 琼脂培养基和李斯特菌显色培养基的检测效果存在显著差异,不同品牌培养基质量差异大。鉴于以上研究分析,建议有关机构研制参比培养基,为培养基的生产和使用提供更规范的质量控制。本研究所获实验数据对培养基生产厂家的质量控制和产品质量提升具有一定参考价值,并为 GB 4789.28-2013标准的制修订提供了参考数据。
