食源性诺如病毒单克隆抗体可变区基因克隆及结构特征分析
2022-02-15高珺珊吴清平梁燕惠雍天乔李贻静张菊梅薛亮
高珺珊,吴清平,梁燕惠,雍天乔,李贻静,张菊梅,薛亮
(广东省科学院微生物研究所,华南应用微生物国家重点实验室,广东省微生物安全与健康重点实验室,农业农村部农业微生物组学与精准应用重点实验室,广东广州 510070)
食源性诺如病毒(Norovirus,NoV)是全球引起贝类、浆果、沙拉等多类食品安全事件的重要微生物污染物。据世卫组织统计(2007~2015),诺如病毒在全球引发食源性疾病的各类病原中列首位(占总病例数20.7%)[1],尤易引起群体性食品安全事件的暴发,社会与经济损失巨大[2,3]。我国是诺如病毒流行和导致食品安全事件的重要地区之一,在大多数省市被证实是引发食源性疫情的主要病原,对广大民众的健康造成了极大危害[4-7],已成为当今食品安全研究中的最薄弱环节之一。
抗体是食源性诺如病毒检测和控制技术的重要基础。在食品安全检测领域,诺如病毒抗体被广泛用于开发新型的免疫检测技术。例如,Alhadrami等[8]利用金纳米标记诺如病毒特异性抗体开发了一种棉签可视化纳米检测方法,可用于多种食品样品(黄瓜、生菜和鸡肉)中诺如病毒的检测。Baek等[9]使用特异性多肽作为识别元件,开发了一种高灵敏度的电化学生物传感器,可用于牡蛎中诺如病毒的检测,最低检测限为1.7 copies/mL。其中单克隆抗体(mAb)在生物医学领域对感染性疾病的诊断和治疗都发挥了重要作用[10]。由于诺如病毒变异快且缺乏稳定的体外细胞培养体系及小动物感染模型,使其特异性抗病毒治疗的发展远远落后于其他食源性病毒病原体[11]。但研究者建立了一种受体阻断试验,通过检测抗体是否具有阻断诺如病毒样颗粒VLP与组织血型抗原HBGAs结合的能力,从而确定是否为中和抗体,该方法已被证明是体外中和试验的一种有效的替代方法[12-14]。因此诺如病毒抗体的研究对抗体改造具有重要作用。
每个抗体分子由两条相同的重链和轻链组成,包括三个功能结构域。两个抗原结合域(Fabs)决定高亲和力地结合特定的分子靶标,而可结晶区域(Fc)则与细胞受体结合来激发生物功能。Fab上的重链可变区(VH)和轻链可变区(VL)包含三个互补决定区(CDR),为抗原结合域的高变序列,决定抗体可以特异性针对靶抗原。单链抗体(ScFv)就是由VH、VL和链间二硫键组成。在结构上,其具有一定的弹性及蛋白酶抗性,存在抗原结合位点,利用重组蛋白表达系统可以实现抗体低成本快速生产[15,16]。
本团队前期在对我国食源性诺如病毒遗传多样性研究的基础上,成功制备了针对GII.4、GII.17等主要流行基因型的高效单克隆抗体[17,18]。然而单克隆抗体基因的克隆是人工设计和制备改造抗体的关键环节。因此在本研究中,以食源性诺如病毒GII.17型1E3高效单克隆抗体为对象,克隆并系统分析了其重链和轻链可变区基因序列和结构特征,以期为制备可应用于食品安全检测和控制领域基因工程抗体奠定基础。
1 材料与方法
1.1 原料
1.1.1 细胞株、载体及细胞
分泌食源性诺如病毒GII.17型单克隆抗体的杂交瘤细胞株1E3为本实验室制备并保存,PMD19-T克隆载体及DH5α感受态细胞购自大连宝生物工程有限公司。
1.1.2 主要试剂
细胞总RNA提取试剂盒及单组份TMB显色液,北京天根生化科技有限公司;凝胶DNA小量回收试剂盒,美基生物有限公司;高糖 DMEM 及南美胎牛血清,美国Gibco公司;PBS缓冲液、PBST缓冲液、ELISA包被液及ELISA终止液,北京索莱宝科技有限公司;辣根过氧化物酶偶联山羊抗小鼠IgG抗体,北京博奥森生物有限公司;PrimeSTAR Max DNA Polymerase、ExtaqPolymerase、PrimeScript™ II 1st Strand cDNA Synthesis Kit,大连宝生物工程有限公司;其他试剂均为国产分析纯。
1.2 试验方法
1.2.1 细胞培养
取出一支液氮冻存的分泌GII.17型诺如病毒单克隆抗体的杂交瘤细胞株 1E3,37 ℃水浴使其融化,150 r/min离心10 min,弃上清,细胞沉淀用含有10%胎牛血清、100 U/mL青霉素和 100 μg/mL链霉素的高糖DMEM完全培养基重悬,细胞悬液铺于96孔细胞板传代培养,再将传代的细胞转移至24孔板,每孔补充上述培养基至1 mL,置于37 ℃、5% CO2的培养箱中培养。
1.2.2 杂交瘤细胞分泌抗体评价
利用间接ELISA方法测定上述24孔板内复苏培养的1E3细胞上清是否正常分泌GII.17型诺如病毒单克隆抗体,首先取96孔ELISA板用1 μg/mL的GII.17 P颗粒100 μL于4 ℃包被12 h,然后用PBST洗板3次,每次5 min。再用现配的5%脱脂牛奶200 μL/孔于37 ℃静置封闭2 h,PBST洗板3次,每次5 min。取孔板内杂交瘤细胞长至 70%左右的细胞上清稀释100倍,稀释液以100 μL/孔加入96孔板中,同时以加入100 μL PBS缓冲液作为阴性对照孔,在37 ℃下静置孵育1 h。用PBST洗板4次,每次5 min。加入3000倍稀释的辣根过氧化物酶偶联山羊抗小鼠IgG抗体,在37 ℃静置孵育30 min,然后洗板4次,每次5 min。每孔加入单组份TMB显色液100 μL,避光条件下孵育10 min,每孔加入50 μL ELISA终止液。酶标仪读取光密度(OD)在450 nm处的值,以P(样品OD450值)/N(阴性对照OD450值)≥2.1判定为阳性。
1.2.3 总RNA提取及反转录
取一瓶细胞总数大于5×106cells 300 r/min离心10 min,弃除全部培养基上清,并用PBS缓冲液清洗两次,再次300 r/min离心10 min收集细胞沉淀,然后按照细胞总RNA提取试剂盒说明书操作步骤提取杂交瘤细胞总 RNA,取 5 μL总 RNA 为模板,使用PrimeScript™ II 1st Strand cDNA Synthesis Kit进行反转录,反应条件为:30 ℃ 10 min,42 ℃ 60 min,70 ℃15 min,最终得到cDNA。
1.2.4 VH和VL基因的扩增及克隆
取两支PCR管,各加入1.2.1中1 μL的cDNA作为模板,取 25 μL高保真酶 PrimeSTAR Max DNA Polymerase,VH和VL的上下游组合引物由上海捷瑞公司合成(体系中包含每个引物200 nmol/L)[19],最终体系用ddH2O补到50 μL。反应条件为:95 ℃ 3 min;98 ℃ 10 s,55 ℃ 5 s,72 ℃ 1 min;72 ℃ 5 min,共30个循环,扩增产物进行琼脂糖凝胶电泳鉴定及胶回收。用 Extaq将回收产物末端加腺嘌呤后连接至PMD19-T载体,连接产物转化至大肠杆菌DH5α感受态细胞,涂布于加入氨苄、IPTG、X-gal的琼脂平板,培养皿倒置于 37 ℃培养箱过夜培养,挑取白色单菌落进行菌落PCR验证,选取阳性菌落摇菌后送至北京六合华大基因科技有限公司测序验证。
1.2.5 序列比对分析
首先利用NCBI数据库Ig Blast对测序结果进行比对分析确定 VH和 VL基因核苷酸序列,再利用IMGT及Vbase2数据库对VH和VL的氨基酸序列进行分析,确定VH和VL基因所属家族,标识VH和VL的氨基酸序列高变区域互补决定区CDR、骨架区域FR及关键氨基酸组成。
1.2.6 VH及VL同源建模及分子对接
以诺如病毒衣壳P蛋白与本研究获得的单克隆抗体VL及VH序列为基础,选择PDB数据库中同源性最高的晶体结构为模板,使用Modeller 10.2软件[20]进行三维结构模拟,以及ZDOCK 2.3.2软件[21]进行分子对接。
2 结果与讨论
2.1 杂交瘤细胞1E3分泌诺如病毒抗体检测
杂交瘤细胞具有不稳定性,长期冻存后复苏、从小孔扩大到大孔的传代过程以及更换新的条件培养,均有可能会导致杂交瘤细胞发生染色体丢失,从抗体分泌阳性变为阴性。因此要避免对杂交瘤细胞频繁操作,长期冻存的杂交瘤细胞需要定期复苏筛选阳性克隆后继续冻存,为满足本实验单克隆抗体可变区扩增需求,首先必须确定杂交瘤细胞的分泌情况。
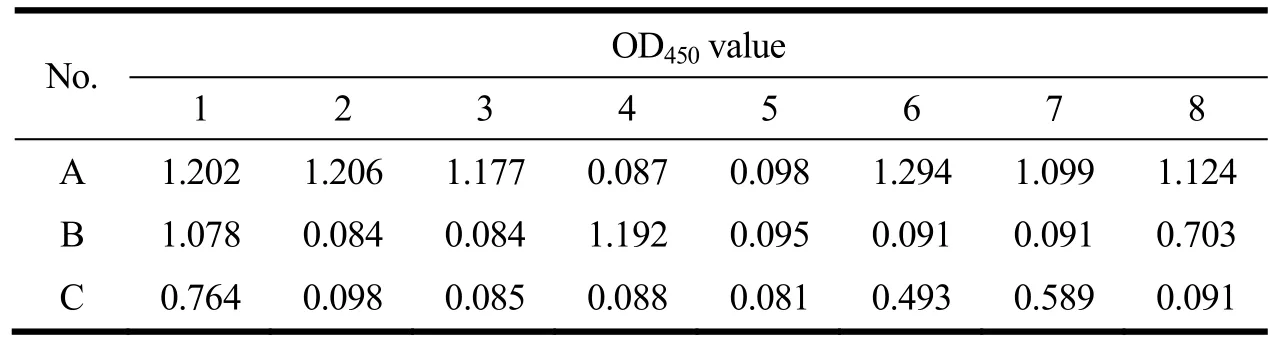
表1 间接ELISA方法测定杂交瘤细胞1E3细胞上清分泌抗体情况Table 1 Determination of antibody secreted in the supernatant of hybridoma cell 1E3 of by indirect ELISA method
取实验室冻存的杂交瘤细胞1E3进行分泌抗体情况测定,利用间接 ELISA方法,包被抗原为 GII.17型诺如病毒单克隆抗体免疫原P蛋白,经测定阴性对照孔OD450值为0.085,24孔板稀释100倍的杂交瘤细胞上清与GII.17型P蛋白反应情况如表1所示,其中41.67%(10/24)的孔检测结果为阴性,包括A4、B2、B3、B5、B6、B7、C2、C4、C5、C8,取 OD450的值大于1的阳性孔细胞混合后扩大培养,OD450的值大于1表明分泌抗体活性较好,将部分细胞冻存后,剩余细胞扩大至单瓶 T25,培养至细胞数大于 5×106cells,可用于细胞总RNA提取。
2.2 诺如病毒单克隆抗体1E3 VH和VL基因的扩增
以反转录的杂交瘤细胞cDNA为模板,通过PCR对单克隆抗体1E3的VH和VL片段进行扩增,分别得到360 bp和339 bp的扩增产物,经琼脂糖凝胶电泳鉴定,结果如图1所示,两个扩增产物均在300 bp左右可见一条清晰条带。单克隆抗体Ig分子重链和轻链可变区为近N端氨基酸变化较大的区域,每个可变结构域长度从100个氨基酸残基到120个氨基酸残基不等,故表明扩增产物大小均与预期相符,VH和 VL片段均扩增成功。
2.3 诺如病毒单克隆抗体1E3 VH和VL基因的克隆及鉴定
将目的基因回收后,连接至 PMD-19T载体,连接产物转化至大肠杆菌DH5α后过夜培养,从LB抗性平板中挑选阳性克隆进行重组质粒菌落PCR鉴定。结果如图2,菌落PCR产物经电泳鉴定后,可见在目的片段大小有特异性条带,各取3个阳性菌落摇菌培养过夜后,送至北京六合华大基因科技有限公司进行测序验证。
2.4 诺如病毒单克隆抗体1E3 VH和VL的结构特征
根据测序结果的IgBlast比对,确定了VH和VL结构域的核苷酸序列。VH基因全长均为360 bp,编码120个氨基酸,属于IGHV3-2*02家族;VL基因全长为339 bp,编码113个氨基酸,属于IGKV1-135*01家族。Ig轻链有两型:k型与λ型,不同种属两型轻链比例不同,小鼠的两型比例为20:1,1E3轻链属于k型。Ig Blast数据库基因进行同源性比对,结果发现VH基因与小鼠重链可变区基因同源性最高为97%,VL基因与小鼠轻链可变区基因同源性最高为97%,从而确定克隆得到的目标序列为小鼠重链及轻链可变区基因序列。
单克隆抗体中负责高亲和力和特异性的结合抗原的序列在VH和VL链上,这些序列在抗体与抗体之间差异很大。在可变区内有6个环(VH和VL各3个),称为CDR,它们主要负责结合抗原靶标。这些CDR平均总计大约60个氨基酸残基,长度一般从7个氨基酸残基到25个残基不等。利用Ig BlastIMGT及Vbase2数据库分析1E3的VH和VL的氨基酸序列,确定了单克隆抗体1E3的CDR区域和FR框架区域,两者均含有4个FR区和3个CDR区,表明序列结构完整。V基因、D基因和J基因与IMGT数据库中最相似的胚系基因如表2所示。

表2 食源性诺如病毒单克隆抗体1E3的重链可变区和轻链可变区基因序列在IMGT数据库中的比对结果Table 2 Results for alignment of VH and VL domains of anti-foodborne mAb 1E3 in IMGT database
2.5 影响单克隆抗体功能的关键氨基酸组成分析
单抗分子的氨基酸序列鉴定,二硫键及糖基化位点的确认对于抗体分子的质量十分重要[22,23]。1E3的VH和VL的氨基酸组成如图5所示,丝氨酸、苏氨酸和酪氨酸是 VH中含量最丰富的氨基酸,分别占14.2%、12.5%和10.0%;丝氨酸、亮氨酸和甘氨酸是VL中含量最丰富的氨基酸,分别占12.4%、11.5%和9.7%。单抗肽链分子中的天冬酰胺残基可以与糖链的还原端连接形成不同糖链结构的糖基化蛋白,也就是N-糖基化修饰[24,25]。1E3的VH和VL中分别包含5个和1个天冬氨酸,这些位置可以用于设计嵌合式结构。此外,还需要进一步的研究来确定其他重要的翻译后修饰位点,例如谷氨酸也是一种重要的翻译后修饰的氨基酸,聚谷氨酰化是抗体的可逆修饰,对抗体亲和力和其他生物学特性有一定的影响[26,27]。
二硫键是一种共价键,抗体分子内均存在链内和链间二硫键,轻链与重链就是由二硫键连接形成得四肽链分子,链内二硫键折叠成得球形区域就是抗体的功能区,该区域的氨基酸具有高度的同源性。二硫键是稳定蛋白空间结构的重要因素,同时可以利用二硫键稳定重组抗体来实现其高效表达[28-30]。VH 和 VL分子结构中潜在的二硫键位点如表3所示,这些残基可以参与天然分子内和分子外二硫键的形成,并可用于构建含有重、轻链可变区的重组载体。

表3 食源性诺如病毒单克隆抗体1E3的重链可变区分子中的二硫键Table 3 Disulfide bonds inanti-foodborne NoV mAb 1E3 VH
2.6 诺如病毒衣壳P蛋白与VH和VL分子对接
根据数据库比对结果,GII.17型P蛋白、1E3的VL链和VH链分别采用6EWB[31]的D、L和H链为模板,P蛋白与抗体VH和VL分子对接结果如图6所示,可见GII.17 P蛋白抗原结合在VH和VL形成的腔体内。分子对接分析表明抗原-抗体作用能为-885.0 kcal/mol,其中范德华相互作用能为-20.6 kcal/mol,静电相互作用能为-864.5 kcal/mol。抗体重链位点D108通过氢键与病毒衣壳P蛋白上N195结合固定了抗原与抗体的结合构像,为抗体识别P蛋白抗原的关键氨基酸残基。
3 结论
3.1 食源性诺如病毒是全世界非细菌性胃肠炎和食源性疾病的重要病因,贝类、浆果、生菜、水产品都是其传播媒介。但目前无论是减缓病毒在人群中的传播,还是预防或治疗免疫缺陷者的感染,都没有有效的抗病毒疗法。此外,目前还没有进行正式的抗诺如病毒药物临床试验。人工改造抗体药物是目前的研究热点,其中以柔性接头连接单克隆抗体重链和轻链可变区的 ScFv可以实现在体外稳定高效的表达,因此抗体的测序分析至关重要。本研究以分泌食源性诺如病毒单克隆抗体的杂交瘤细胞1E3为基础,成功扩增并克隆了1E3的重链可变区和轻链可变区序列。通过Ig blast中IMGT数据库比对测序结果,证明扩增的VH和VL序列为小鼠抗体可变区序列,其中VH基因全长均为360 bp,编码120个氨基酸;VL基因全长为339 bp,编码113个氨基酸。进一步确定了VH和VL基因具有完整的CDR和FR区域,两者均有含有4个FR区和3个CDR区,其中VH属于IGHV3-2*02家族,VL属于IGKV1-135*01家族。
3.2 通过关键氨基酸组成分析,确定苏氨酸和酪氨酸是VH中含量最丰富的氨基酸,分别占14.2%、12.5%和10.0%;丝氨酸、亮氨酸和甘氨酸是VL中含量最丰富的氨基酸,分别占12.4%、11.5%和9.7%。适合设计嵌合式结构的关键位点天冬氨酸,1E3的VH和VL中分别包含5个和1个。VH和VL分子结构中各还有一个潜在的二硫键位点,并可用于构建含有重、轻链可变区的重组载体。GII.17型P蛋白与1E3抗体可变区分子对接结果表明抗体重链上位点D108通过氢键与病毒衣壳P蛋白上N195结合,为抗体识别P蛋白抗原的关键氨基酸残基。综上所述,食源性诺如病毒单克隆抗体VH和VL片段基因序列的分析对食源性诺如病毒单链抗体的克隆表达及抗体的精准改造具有重要意义。
