缺氧缺血性脑损伤大鼠miR-200b对Rac-1的调控作用研究
2022-02-15朱琳涵
朱琳涵,崔 红
随着辅助生殖技术及早产儿管理水平的提高,使得早产儿存活率大幅提升,但随之早产儿脑损伤(BIPI)发病率也逐年升高[1-3]。BIPI是指因产前、产时和(或)出生后各种病理因素导致早产儿不同程度的脑缺血和(或)出血性损伤[4-6]。BIPI能引起脑灰质和白质异常,严重影响神经发育,导致认知和行为功能障碍,给患儿家庭和社会带来沉重负担[7-9]。造成BIPI的原因很多,根本原因为脑组织尚未发育成熟,发育中的脑组织对缺氧缺血尤为敏感,各种围生期因素导致的缺氧缺血为其最主要发生原因。
微小RNA(miRNA)是一类能对基因表达进行微调控的非编码单链RNA[10]。研究证实,miRNA通过与mRNA上编码蛋白质的基因3'-非编码区(3'-UTR)相结合,降低目的mRNA的稳定性,诱导其降解或抑制翻译,从而在转录后调节蛋白质的表达[11]。miRNA可以广泛影响细胞内蛋白质表达,进而对细胞的生长和分化造成影响。目前,miRNA已被证实在干细胞增生与分化、肿瘤发生和发展、细胞凋亡等过程中起重要作用[12]。
我们的前期研究结果表明,缺氧缺血后脑组织中miR-200b和miR-182表达显著下调,靶基因预测表明Wnt信号通路中Rac-1可能在miR-200b和miR-182的下游[13]。Wnt基因是Nusse等从小鼠乳腺癌中克隆的癌基因,其通过自分泌或旁分泌途径与膜受体结合,激活细胞内信号通路,调节靶基因表达,在细胞增殖、分化、迁移等过程中发挥重要作用[14-15]。Rac-1属Rho家族的小GTP结合蛋白,其主要功能是调节肌动蛋白形成,激活后可参与肌动蛋白应力纤维和黏附斑的形成,促进细胞骨架结构重建,调节板足和丝足延伸,影响细胞极化,促进细胞迁移[16-17]。近年发现Rac-1在神经细胞发育过程中起重要作用[18-19]。
考虑到miR-200b和Rac-1在神经系统发育和迁移过程中的潜在作用,研究它们在脑缺血缺氧条件下的表达具有重要意义。本文建立新生大鼠缺氧缺血模型并制备全脑片进行培养,用新型纳米载体(EntransterTM-R)转染miR-200b,并使用qRT-PCR检测miR-200b和Rac-1的表达,旨在了解缺氧缺血性脑损伤动物模型miR-200b及Rac-1 mRNA表达,以及转染miR-200b后Rac-1 mRNA表达变化,并探讨miR-200b对Rac-1 mRNA可能存在的调控关系。
1 材料与方法
1.1动物来源 SPF级新生3日龄SD大鼠(雌雄不计,体质量8~10 g)由北京维通利华实验动物技术有限公司提供,实验动物许可证号[SCXK(京)2012-0001]。本方案经首都医科大学附属北京友谊医院动物委员会批准。
1.2脑片的制备与培养 生后3 d SD大鼠用75%乙醇消毒,断头后取脑组织。迅速将脑组织置于预冷的解剖缓冲液(64% DMEM、32% Hank's平衡盐溶液、6.5 g/L D-葡萄糖、2.98 mg/L HEPES、100 U/ml青霉素、100 μg/ml链霉素、2.5 μg/ml两性霉素)中,冷却后剥除软脑膜。在铺有滤纸的活组织切片机上切取全脑片,厚度为350 μm。6孔培养板各孔内加1.2 ml完全培养液(50% DMEM、25% Hank's平衡盐溶液、25% 马血清、6.5 g/L D-葡萄糖、2.98 mg/L HEPES、100 U/ml青霉素、100 μg/ml链霉素、2.5 μg/ml两性霉素),然后放入插入式微孔滤膜,将完好的脑片分放在各孔内滤膜上,置于培养箱内(37 ℃、95% O2+5% CO2及饱和湿度)培养36 h。
1.3新生大鼠全脑片缺氧缺血模型的建立 将脑片均分为4组:空白对照组、缺氧缺糖组、miR-200b转染组、阴性对照转染组。空白对照组在正常培养基(50% DMEM、25% HBSS、25%马血清、6.5 g/L D-葡萄糖)中培养(37 ℃、95% O2+5% CO2及饱和湿度),余3组为无糖培养基(50% DMEM、25% HBSS、25%马血清),放入含8% O2+92%氮气的密闭缺氧罐中,将缺氧罐置于37 ℃电热恒温水浴箱内,进行缺氧缺糖处理60 min后恢复氧糖供应。空白对照组继续置于CO2培养箱中培养,缺氧缺糖组于恢复氧糖供应后置于CO2培养箱中培养,其他组开始转染。选择5个时间点(12 h、24 h、3 d、5 d和7 d)用qRT-PCR检测RNA表达。
1.4转染 首先制备miRNA稀释液:将10 μl FAM标记的20 μmol/L miR-200b阴性对照储存液(广州瑞博生物科技有限公司)或20 μmol/L miR-200b储存液(广州瑞博生物科技有限公司)与40 μl OPTI-MEM(美国GIBCO公司)充分混合。其次制备EntransterTM-R稀释液:将10 μl EntransterTM-R(北京英格恩生物科技有限公司)与40 μl OPTI-MEM充分混合,室温静置5 min。将EntransterTM-R稀释液和miRNA稀释液充分混合,室温静置30 min。最后,100 μl转染复合物滴加到有900 μl全培养基的6孔板中(miRNA终浓度为200 nmol/L),前后移动培养皿,混合均匀后,将6孔板放入CO2培养箱中培养。
1.5成像 转染后24 h留取脑片标本,取冰冻切片(厚度约10 μm)于荧光显微镜下观察转染情况。
1.6总RNA提取与鉴定 Trizol法提取总RNA。在液氮中充分研磨收集脑片组织,加入1 ml Trizol试剂(美国Invitrogen公司),室温下静置5 min。加入200 μl三氯甲烷,剧烈混匀15 s,室温下静置2~3 min。然后在4 ℃下,12 000×g离心15 min取上清,置入新的1.5 ml EP管中加入500 μl异丙醇,颠倒混匀。室温静置3~5 min。4 ℃下12 000×g离心10 min,弃上清加DEPC水配制的75%乙醇1 ml洗涤沉淀。4 ℃下7500×g离心5 min,弃上清,超净工作台干燥15~20 min,最后用30 μl RNase-free H2O溶解沉淀。
为确认总RNA的完整性,取上述提取的总RNA 1 μl稀释至500 μl,用紫外分光光度计分别测量260及280 nm波长处的吸光度(OD)值;RNA纯度以OD260/OD280表示,1.8~2.0视为纯度高。取上述抽提的细胞总RNA 3 μl进行快速1%琼脂糖凝胶电泳,紫外灯下观察并拍照。可见28S、18S、5S 3条亮度依次递减的清晰条带,若28S与18S条带亮度比值约为2︰1说明所提取的总RNA完整无降解。
1.7逆转录合成cDNA 首先,将1 μl oligo或miR-200b和U6特异性逆转录引物、3~5 μg总RNA、1 μl dNTP(10 mmol/L)和10 μl RNase-free ddH2O加入无核酸酶的微量离心管中,并70 ℃加热5 min。然后,将混合物快速冷却2 min。短暂离心后,加入5×第一链合成缓冲液4 μl、DTT(0.1 mol/L)2 μl、RNase核酸酶抑制剂(40 U/μl)1 μl,混匀后37 ℃孵育2 min。加入1 μl(200 U)M-MLV逆转录酶,轻轻吹打混匀。如使用随机引物,则将离心管在25 ℃孵育20 min、37 ℃孵育50 min后,70 ℃加热15 min以终止反应,获得cDNA。
1.8PCR检测mRNA表达 以cDNA为模板进行PCR,以U6和β-actin基因表达作为内参照。β-actin序列:正向引物:GCCAACACACAGTGCTGTCT;反向引物:AGGAGCAATGATCTTGATCTT,扩增片段93 bp。Rac-1序列:正向引物:AGGAAGAGAAAATGCCTG;反向引物:AGCAAAGCGTACAAAGGT,扩增片段80 bp。每个样品的PCR反应总体积为50 μl,包括cDNA(2 μl)、正向引物(1 μl)、反向引物(1 μl)、SYBR Green I混合物(25 μl)和ddH2O(21 μl)。miR-200b和U6 PCR的参数设置为95 ℃ 15 min,然后95 ℃ 20 s和61 ℃ 40 s,共40个循环。Rac-1和β-actin PCR的参数设置为95 ℃ 15 min,然后95 ℃ 20 s和56 ℃ 40 s,共40个循环。使用ABI 7500 SDS软件计算mRNA相对表达量。
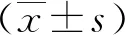
2 结果
2.1纳米载体转染miRNA 转染后,观察到FAM标记的miRNA荧光,表明成功转染了miR-200b并在细胞中积累(图1)。所建立的miRNA纳米载体可用于进一步实验。

图1 缺氧缺血性脑损伤大鼠脑组织细胞成功转染FAM标记的miRNA阴性对照荧光显像图
2.2RNA完整性鉴定 通过从脑组织提取的RNA进行琼脂糖凝胶电泳(图2A),分离出5S、18S和28S条带。定量分析显示28S与18S的比值约为2(图2B),表明RNA相对完整,可用于以下实验。
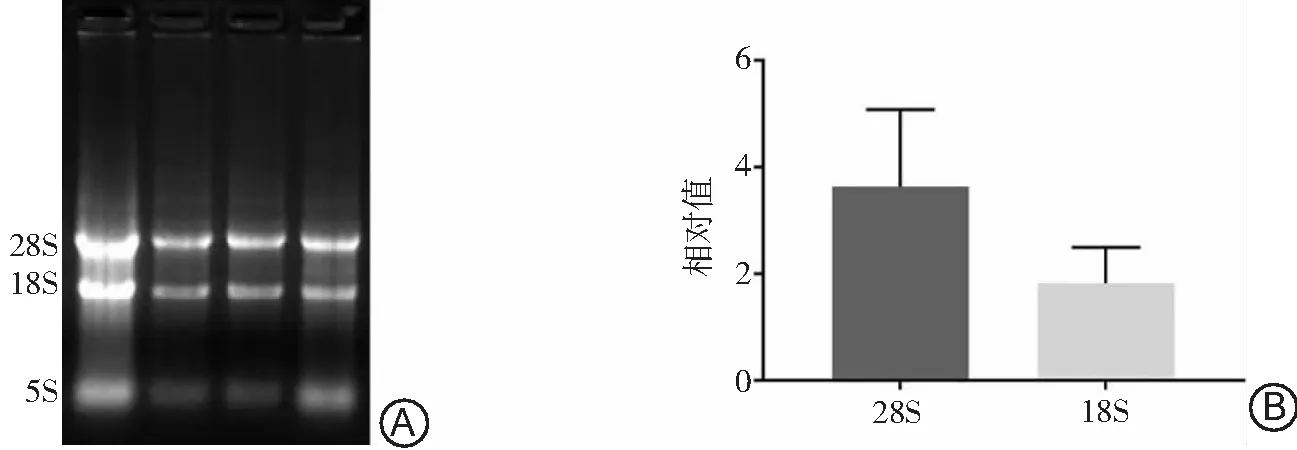
图2 缺氧缺血性脑损伤大鼠脑组织切片RNA琼脂糖凝胶电泳分析
2.3缺氧缺糖条件下miR-200b表达 空白对照组12 h~3 d miR-200b mRNA表达呈上升趋势,3~7 d呈下降趋势。相反,缺氧缺糖组12 h~3 d miR-200b mRNA表达呈下降趋势,3~7 d呈上升趋势。在较早期(12 h),缺氧缺糖组miR-200b mRNA表达高于空白对照组,之后则低于空白对照组;阴性对照转染组与缺氧缺糖组miR-200b mRNA表达无差异(P>0.05)。然而,miR-200b转染组miR-200b mRNA表达明显高于缺氧缺糖组及空白对照组(P<0.05)。尽管miR-200b转染组miR-200b表达变化趋势与空白对照组相似,但是最高表达出现在5 d,晚于空白对照组。见图3。
2.4缺氧缺糖条件下Rac-1 mRNA表达 在缺氧缺糖条件下,空白对照组12 h~3 d Rac-1 mRNA表达呈下降趋势,3~7 d呈上升趋势;缺氧缺糖组12 h~5 d Rac-1 mRNA表达呈上升趋势,5~7 d呈下降趋势。在较早期(12 h)空白对照组和缺氧缺糖组Rac-1 mRNA表达无显著差异(P>0.05)。此后,经缺氧缺糖处理各组Rac-1 mRNA表达一直高于空白对照组。见图4。
2.5miR-200b对Rac-1 mRNA表达的影响 缺氧缺糖组与阴性对照转染组虽然在各时间点上miR-200b mRNA的表达量均明显低于miR-200b转染组(图3),但是在各时间点上Rac-1 mRNA的表达量及变化趋势与miR-200b转染组均无显著差异(图4),提示miR-200b在mRNA水平上不影响Rac-1 mRNA表达。
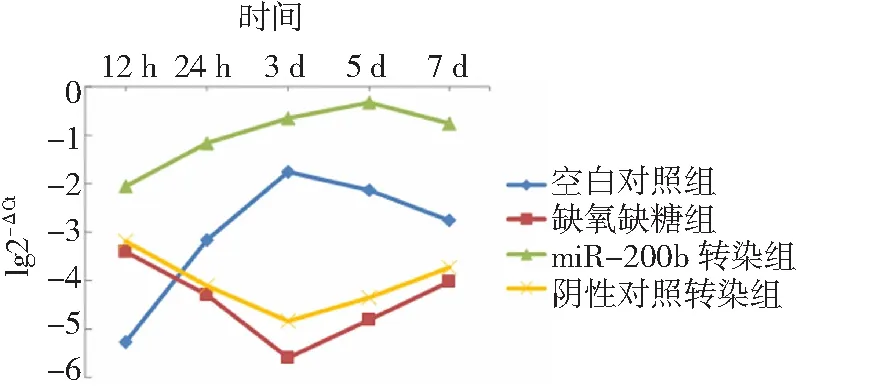
图3 缺氧缺血性脑损伤大鼠脑组织切片各时间点miR-200b mRNA表达折线图
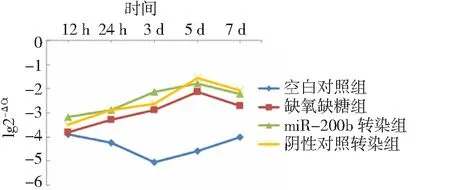
图4 缺氧缺血性脑损伤大鼠脑组织切片各时间点Rac-1 mRNA表达折线图
3 讨论
本研究采用脑片培养法探讨缺氧缺糖环境对新生大鼠脑组织miR-200b和Rac-1 mRNA表达的影响。WANG等[19]研究了EntransterTM转染基因的膜亲和力,且多项研究证实EntransterTM转染载体是角膜基因治疗的有效载体[20-22],以纳米聚合物为载体的miRNA转染技术是一种新颖的方法。DNA、RNA、PNA、dsRNA等基因治疗分子可被包裹在纳米载体的内部空间或吸附在纳米载体表面。纳米颗粒通过细胞的吞噬作用进入细胞,释放出基因治疗分子,发挥基因治疗潜能,具有携带能力高、无病毒性和免疫原性的良好生物相容性,并能很好保护内分子不被DNase或RNase降解[23]。
本研究缺氧缺糖处理12 h时,缺氧缺糖组miR-200b mRNA表达高于空白对照组,提示缺氧缺糖条件下miR-200b可能在短时间内上调,这可能与缺氧后发生的一些应激反应有关。在缺氧缺血过程中,钙超载、氧化应激、炎症反应等多种分子机制参与了脑损伤的发生和修复过程。miR-200b作为一种在神经系统中含量非常丰富的miRNA,可能通过多种途径影响脑损伤的修复。LEE等[23]研究显示,缺血预处理后3 h,包括miR-200b在内的8种miRNA表达显著上调,推测miR-200b可能通过抑制脯氨酰羟化酶-2表达,从而减少缺氧诱导因子-1(HIF-1)降解,保护脑组织。在本研究中,缺氧缺糖处理24 h后,缺氧缺糖组miR-200b mRNA表达显著降低,在第3天降至最低。miR-200b mRNA表达逐渐抑制可能与随后的脑损伤修复有关,但具体原因有待进一步研究。
据报道,miR-200b在小鼠排卵过程中发挥重要作用,且对女性生育能力至关重要[24-25]。TANG等[25]研究提示miR-200b表达可能会影响胃癌患者预后。此外,miR-200b被认为是可预测神经系统疾病预后的有效因子[26-28]。目前有证据显示miR-200b是诱导成人血管生成的“开关”[29]。miR-200b沉默血管内皮生长因子(VEGF)和血小板衍生生长因子等多种血管生成生长因子[30-31]。缺氧引起内皮细胞miR-200b表达下调有助于损伤后血管生成[32-33]。
本研究在恢复缺氧缺糖环境后,Rac-1 mRNA表达增加,第5天达高峰,然后下降。在缺氧缺血过程中,Rac-1可通过多种途径参与脑损伤的修复。一方面,Rac-1能激活缺氧缺糖后的HIF-1,从而正向调节VEGF,促进组织血管的生成。同时,Rac-1还可通过Wnt信号通路调节肌动蛋白聚合,参与神经细胞损伤后的髓鞘修复[34]。Rac-1通过Wnt/PCP途径调控c-Jun活性,从而在细胞骨架重建中发挥作用。
本研究还发现Rac-1 mRNA表达并未随miR-200b的过表达而发生明显改变,在各时间点,缺氧缺糖组与miR-200b转染组Rac-1 mRNA表达量的差异无统计学意义,可能原因为标本量偏小;缺氧缺血时,脑组织内多种基因调控机制发生改变;miR-200b能靶向多种mRNA(包括Rac-1)发挥生物学效应;Rac-1 mRNA表达受多种因素、多种信号通路途径调节;Rac-1主要在蛋白水平对细胞骨架重建、细胞迁移等产生调节作用;qRT-PCR本身有一定局限性,只能翻译前mRNA水平变化,对于翻译后蛋白水平的表达仍需借助其他手段。
本实验对大鼠全脑片氧糖剥夺后miR-200b和Rac-1 mRNA表达做了初步探索,明确了氧糖剥夺对miR-200b及Rac-1 mRNA表达的影响。实验中仅采用了过表达方法进行分析,后续可增加miR-200b抑制组,拮抗miR-200b作用后观察Rac-1表达,即可在两个层面更加有力证实miR-200b对Rac-1表达的影响;对于氧糖剥夺12 h内miR-200b表达量的变化仍有待进一步研究。本研究脑片培养虽然保持了一定的组织完整性,但是与在体实验是否存在差异,仍需进一步验证。
