海藻糖替代部分甘油对延边黄牛冻融精子质量的影响
2022-02-15吕艳秋徐一超
陈 璇,吕艳秋,韩 越,徐一超,金 一
(延边大学,东北寒区肉牛科技创新教育部工程研究中心,延吉 133000)
精子冷冻是保存雄性配子最常用的技术,可以保存新鲜精液以备人工授精。冷冻保存过程中通常需要稀释剂和添加剂,以保护精子免受冷休克的损伤,从而最大程度地维持精子的顶体完整性、质膜的流动和渗透性以及DNA完整性[1]。目前,虽然已经建立了公牛精液不同的稀释剂和冷冻方案,但其受精效果仍无法与新鲜精液相比。因此,研究更有效的冷冻保护剂对于提高冷冻保存精子的存活率和生殖能力至关重要。研究表明,多种化合物对冷冻猪精子具有保护作用[2],通常,人们更倾向于向冷冻保护剂中添加甘油以保护精子,使精子受到的损伤最小化。在冻融过程中,像海藻糖这样的非渗透性低温保护剂会导致细胞膜对体积变化的敏感性降低[3]。海藻糖在冷冻前通过细胞脱水引发高渗,从而减少细胞内水分,防止精子内冰晶的形成,防止精子损伤和受精能力的下降。同时海藻糖也能与低脱水的磷脂膜发生反应,增加膜的稳定性,从而增加对低温损伤的抵抗力。许多研究表明,海藻糖可作为公羊[4]、公猪[5]、鱼类[6]等精液的冷冻保护剂。宋国欣等[7]证实海藻糖和甘油具有协同作用,可以提高冻融后绒山羊精液的品质。目前为止,甘油仍然是精液冷冻过程中常见的渗透性保护剂,然而当甘油浓度过高时会对精子产生毒性,降低公鸡精子的受精能力[8]。海藻糖作为一种非渗透性双糖被认为是最重要、最有效的冷冻保护剂之一[9]。海藻糖通过与膜磷脂的极性头形成氢键,在脱水过程中替换水分子阻止细胞内冰晶的形成,从而达到对质膜的低温保护作用[10]。由于精液在冷冻过程中形成冰晶,使精子受到不可逆的损伤,导致解冻后精液的质量不佳[11-12]。只有获能的精子才可以完成受精,蛋白质酪氨酸磷酸化是获能的标志[13],因而检测冻融精子的酪氨酸磷酸化水平是十分必要的。冻融引起的氧化应激导致精子鱼精蛋白中二硫键的断裂,使得精子细胞核脱氨基,精子染色质相对较少,最终精子发生DNA断裂和凋亡样改变。鱼精蛋白的丢失可增加DNA断裂的可能性[14]。因此,本研究探讨在牛的精液冷冻保护剂中减少甘油浓度,补充海藻糖是否可以提高冻融后精子的质量,以期为进一步完善公牛精子冷冻保护剂的成分,提高公牛精子冻融后的质量提供理论依据。
1 材料与方法
1.1 试验动物
选取3头3~5岁健康的延边黄牛,采用手握法采集新鲜精液,每周收集2次,每头牛收集3份,选取其中活力≥90%的精液混合后进行后续试验。
1.2 主要试剂及仪器
硫酸链霉素、考马斯亮蓝、线粒体膜电位检测试剂盒JC-1、SDS电泳液和凝胶试剂盒、BCA试剂盒均购自上海碧云天生物技术有限公司;Yo-Pro-1购自Life公司;PBS购自Biond公司;甘油、海藻糖、Hoechst 33342、碘化丙啶(PI)、部花青540(M540)、色霉素A3(CMA3)、果糖、柠檬酸钠、葡萄糖、青霉素均购自Sigma公司;冷冻保护剂:蛋黄200 mL/L+柠檬酸钠13.536 g/L+Tris 24.224 g/L+葡萄糖11 g/L+硫酸链霉素1 g/L+青霉素0.8 g/L。
精子-微生物动(静)态图像检测分析系统(CASA,CN15-T31)购自北京华方神火科技有限公司;数字凝胶成像系统(ESSENTIAL V6)购自UVITEC公司;倒置荧光显微镜(C-S-HP35)购自Nikon公司;流式细胞仪(BDaccuri C6)购自BD公司。
1.3 冷冻精液处理及分组
将用冷冻保护剂稀释后的精液依次装入0.25 mL冷冻麦管中,蘸取聚乙烯醇粉末封口,于4 ℃中平衡3.5 h。后将麦管放置在液氮上方距离液面3~5 cm处熏蒸8~10 min,随后投入液氮冻存。储存6~8周后,取出装有精液的冷冻麦管,于37 ℃水浴中30 s,用于评估解冻后精子的参数。
将冷冻保护剂与精液样本混匀,调整精子密度至1×108/mL。设置6%甘油、3%甘油+0、50、100和150 mmol/L海藻糖组,总共5组,分别记为Ⅰ、Ⅱ、Ⅲ、Ⅳ和Ⅴ组。 通过精子质量及动力学参数评估后,筛选出最佳海藻糖处理浓度,用于后续检测。
1.4 方法
1.4.1 精子活力、质膜完整性和顶体完整性评估 取100 μL稀释后的精液与900 μL低渗肿胀液(果糖13.512 g/L,柠檬酸钠7.352 g/L) 1∶9混合,于38.5 ℃下孵育30 min。孵育后各组分别取3 μL放在精子-微生物动(静)态图像检测分析系统(CASA)的腔室中,始终保持37 ℃。随机选择5个视野进行精子活力检测;孵育后通过显微镜观察精子质膜完整性。精子顶体完整性通过考马斯亮蓝染色法检测,取孵育后的精液100 μL均匀涂抹于载玻片,用1 mL考马斯亮蓝染色液将精子均匀覆盖,避光室温孵育30 min,然后通过显微镜观察考马斯亮蓝染色情况。所有检测每次至少计数200个精子,每组至少观察5个视野,重复3次。
1.4.2 动力学参数评估 曲线速度(VCL)、直线速度(VSL)、平均路径速度(VAP)、直线性运动(LIN)、前向性运动(STR)等精子的动力学参数均用精子-微生物动(静)态图像检测分析系统(CASA)进行评估。精子处理同1.4.1,孵育后各组分别取3 μL放在分析仪的腔室中,始终保持37 ℃。随机选择5个视野进行检测,重复3次。
1.4.3 获能状态检测 用蛋白酪氨酸磷酸化水平评估新鲜精子和冻融精子获能情况,以β-tubulin为内参。新鲜精子分为获能和非获能2组,冻融精子(Ⅰ、Ⅱ组和最佳浓度海藻糖组)均进行获能处理,需获能精子用PBS洗2次后,用BO获能液处理,置于CO2培养箱中孵育3 h。孵育后提取各组蛋白,一部分用于测定蛋白浓度(BCA试剂盒),一部分用于Western blotting检测。按照凝胶试剂盒步骤配制浓缩胶和分离胶,向电泳槽中注入1×电泳液,将5组精子的蛋白样品与上样缓冲液混合变性后,上样、电泳,电泳结束后将凝胶取出转移至PVDF膜。用TBST洗膜3次,每次10 min。 随后用封闭液孵育1~2 h。 TBST洗膜3次后,一抗(P1869 1∶2 000,Sigma) 4 ℃孵育过夜。18~24 h后,用TBST洗膜3次,加入二抗(A0168 1∶2 000,Sigma)孵育1~2 h,用TBST洗膜3次后均匀滴加ECL显影液,在数字凝胶成像系统中成像并拍照。用Image J软件统计蛋白条带灰度值。
1.4.4 活率与线粒体膜电位评估 将新鲜精子、Ⅰ、Ⅱ组和最佳浓度海藻糖组精子进行Hoechst 33342/PI/JC-1联合染色分析,用以评估冻融精子的活率(头部)和线粒体膜电位水平(中段)。 取500 μL解冻后的精液样品,加入2.5 μL Hoechst 33342(20 μmol/L)和5 μL JC-1(153 μmol/L),37 ℃避光孵育20 min后加入2.5 μL PI(2.4 mmol /L),37 ℃孵育10 min。将孵育后的精子置于荧光显微镜下观察染色情况(其中头部呈红色荧光的为死精子;头部呈蓝色荧光、中段呈橙红色荧光的为高水平线粒体膜电位活精子,头部呈蓝色荧光、中段呈较少绿色或无绿色荧光为低水平膜电位活精子),评估200~300个精子,每组至少观察5个视野,重复3次。
1.4.5 膜脂质紊乱水平检测 使用部花青540(M540)和Yo-Pro-1染色法,通过流式细胞仪检测精子的膜脂质紊乱水平。取新鲜精子及Ⅰ、Ⅱ组和最佳浓度海藻糖组精子各1 mL,加入2.7 μL M540和1 μL Yo-Pro-1,37 ℃避光孵育30 min。Yo-Pro-1的荧光由FL1通道接收,M540的荧光由FL3通道接收。
1.4.6 DNA完整性评估 精子DNA的完整性通常使用CMA3染料评估鱼精蛋白水平进行检测。染色质结构异常时CMA3呈阳性,精子头部发出亮绿色荧光;染色质结构正常时CMA3为阴性,精子头部发出暗绿色荧光。具体操作步骤为:每个精液样品在不含Ca2+和Mg2+的PBS中洗涤2次,在固定液甲醇和冰醋酸(3∶1)中于4 ℃条件下固定5 min后涂片;取100 μL CMA3染色工作液,pH 7.0,其中包含10 mmol/L氯化镁,均匀滴加到载玻片上,避光室温孵育20 min。然后将载玻片在McIlvain的缓冲液中冲洗并风干;置于荧光显微镜下观察,每次至少评估200个精子,每组至少观察5个视野,重复3次。
1.5 数据统计分析
用SPSS 25.0进行单因素方差分析,组间比较采用LSD检验,用GraphPad Prism 8绘图。结果用平均值±标准差表示。P<0.05表示差异显著,P<0.01表示差异极显著。
2 结 果
2.1 海藻糖替代部分甘油对冻融延边黄牛精子质量参数的影响
由表1可知,与Ⅰ组相比,Ⅱ组精子活力、质膜完整性和顶体完整性均显著下降(P<0.05),与Ⅰ和Ⅱ组相比,Ⅲ、Ⅳ和Ⅴ组精子的活力均显著升高(P<0.05),其中Ⅳ和Ⅴ组精子的质膜完整性和顶体完整性均显著提高(P<0.05)。

表1 冻融精子的质量参数
2.2 海藻糖替代部分甘油对冻融延边黄牛精子动力学参数的影响
由表2可知,与Ⅰ组相比,Ⅱ组精子的VCL和STR都显著下降(P<0.05),补充海藻糖(Ⅲ、Ⅳ和Ⅴ组)后精子的VCL、VSL、VAP、LIN和STR均显著升高(P<0.05),其中Ⅳ组精子解冻后的质量最佳。因此,后续试验选用100 mmol/L海藻糖处理精子。

表2 冻融精子的动力学参数
2.3 海藻糖替代部分甘油对冻融延边黄牛精子获能状态的影响
蛋白酪氨酸磷酸化检测结果显示,各组精子在获能过程中,出现了典型的酪氨酸磷酸化蛋白条带(17、27、38、72、180 ku处)增加(图1A)。相对表达量结果显示,与新鲜精子相比,冻融精子获能后其蛋白酪氨酸磷酸化的条带显著减少(P<0.05);与Ⅰ组相比,100 mmol/L海藻糖组酪氨酸磷酸化蛋白条带稍有增加,但差异不显著(P>0.05)(图1B)。

①A,精子蛋白酪氨酸磷酸化水平检测;B,精子蛋白酪氨酸磷酸化相对表达量。②1,未获能的新鲜精子组,2,获能新鲜精子组;3~5,Ⅰ、Ⅱ组和100 mmol/L海藻糖组。③肩标不同字母表示差异显著(P<0.05);肩标相同字母表示差异不显著(P>0.05)。下同①A,Detection of tyrosine phosphorylation level of sperm protein;B,Relative expression of sperm protein tyrosine phosphorylation.②1,Fresh sperm (non-capacitated) group;2,Fresh sperm (capacitated) group;3~5,Ⅰ,Ⅱ and 100 mmol/L trehalose groups.③Values with different letter superscripts mean significant difference (P<0.05);While with the same letter superscripts mean no significant difference (P>0.05).The same as below图1 各组精子蛋白酪氨酸磷酸化水平Fig.1 Tyrosine phosphorylation level of sperm in each group
2.4 海藻糖替代部分甘油对冻融延边黄牛精子活率与线粒体膜电位的影响
冻融精子的活率和线粒体膜电位的染色结果如图2A,具有完整质膜和高水平线粒体膜电位的活精子细胞其头部呈蓝色,中段呈橙红色。统计结果如图2B,线粒体膜电位统计结果如图2C。结果显示,与新鲜精子相比,冻融组精子的活率和线粒体膜电位均显著降低(P<0.05)。冻融组中,与Ⅰ组相比,Ⅱ组精子的活率与线粒体膜电位水平显著下降(P<0.05),100 mmol/L海藻糖组精子的活率和线粒体膜电位均显著升高(P<0.05)。
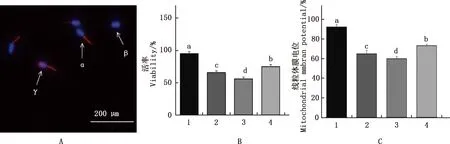
①A,活率及线粒体膜电位染色(200×);B,活率统计;C,线粒体膜电位水平统计。②α,具有完整质膜和高水平线粒体膜电位的活精子细胞;β,具有完整质膜和低水平线粒体膜电位的活精子细胞;γ,质膜不完整和线粒体膜电位高的死精子细胞。③1、2、3和4分别为新鲜精子及Ⅰ、Ⅱ组和100 mmol/L海藻糖组。下同①A,Viability and mitochondrial membrane potential staining (200×);B,Statistics of motility rate;C,Statistics of mitochondrial membrane potential level.②α,Live sperm cells,with an intact plasma and high level of mitochondrial membrane potential;β,Live sperm cells,with an intact plasma membrane integrity and low level of mitochondrial membrane potential;γ,Dead sperm cells,with a damaged plasma membraneand and high level of mitochondrial membrane potential.③1,2,3 and 4 were fresh sperm,Ⅰ,Ⅱ and 100 mmol/L trehalose groups,respectively.The same as below图2 各组精子活率与线粒体膜电位Fig.2 Viability and mitochondrial membrane potential of sperm in each group
2.5 海藻糖替代部分甘油对冻融延边黄牛精子膜脂质组织紊乱的影响
流式细胞术检测结果表明,与新鲜精子相比,冻融后活精子和死精子的高度膜脂质紊乱比例均显著升高(P<0.05);与Ⅰ组相比,Ⅱ组的活精子高度膜脂质紊乱比例显著升高,死精子的高度膜脂质紊乱比例显著下降(P<0.05);100 mmol/L海藻糖组活精子的高度膜脂质紊乱比例显著低于Ⅱ组,死精子总比例显著低于Ⅰ和Ⅱ组(P<0.05)(图3、表3)。

Q1,低度膜脂质紊乱的死精子;Q2,高度膜脂质组织紊乱的死精子;Q3,低度膜脂质紊乱的活精子;Q4,高度膜脂质紊乱的活精子Q1,Dead sperm with low level of membrane lipid disorder;Q2,Dead sperm with high level of membrane lipid disorder;Q3,Live sperm with low level of membrane lipid disorder;Q4,Live sperm with high level of membrane lipid disorder图3 各组精子膜脂质紊乱水平Fig.3 Lipid disturbance of frozen-thawed sperm membrane in each group

表3 各组精子膜脂质紊乱水平统计结果
2.6 海藻糖替代部分甘油对冻融延边黄牛精子DNA完整性的影响
精子鱼精蛋白染色结果显示,与新鲜精子相比,Ⅰ、Ⅱ组和100 mmol/L海藻糖组冻融精子的鱼精蛋白缺失率显著升高(P<0.05);冻融组中,与Ⅰ组相比,Ⅱ组和100 mmol/L海藻糖组精子的鱼精蛋白缺失率显著降低(P<0.05)(图4)。

①A,鱼精蛋白染色;B,鱼精蛋白缺失率统计。②α,DNA不完整的精子;β,正常精子①A,Protamine staining;B,Statistics of protamine deletion rate.②α,Sperm with incomplete DNA;β,Normal sperm图4 冻融精子的鱼精蛋白缺失检测(200×)Fig.4 Protamine deficiency detection of frozen-thawed sperm (200×)
3 讨 论
精子超低温保存对于高遗传价值动物的生产和保存以及遗传物质向后代的传递具有重要意义。目前,甘油是最常用的低温保护剂,然而高浓度甘油在超低温保存过程中具有毒性作用[15]。Pena等[4]研究了在猪精液冷冻保护液中添加不同浓度甘油(3%、5%和8%)对冻融后精子的DNA损伤和运动性能的影响,发现8%甘油增加了精子DNA损伤。因此,如何降低冷冻保护剂中甘油浓度,减少冷冻保存对精子的损伤尤为重要。
糖可用于精子的低温保存,并作为渗透压调节器及能源、细胞冰晶形成的减速剂和低温保护剂。海藻糖是一种双糖,其首先与膜磷脂相互作用,为膜抗冷冻损伤提供了更多的稳定性;其次,与细胞外冰晶结合,阻止冰晶在细胞内的形成。Bucak等[16]报道,海藻糖在公羊精液液体外储存过程中达到了最高的保护效果。众所周知,由于低温保存过程中众多因素的影响,解冻后精子的运动性和活力不及新鲜精液[17]。低温保存过程中的冷休克和氧化应激会对精子的结构造成低温损伤,尤其是精子的质膜和顶体。已有报道显示,通过补充海藻糖来降低冷冻保护剂中甘油的浓度具有有益作用[18-19]。本试验通过降低甘油的浓度,补充不同浓度的海藻糖冷冻延边黄牛精子得到了相似的结果,冷冻解冻后精子活力、质膜完整性和顶体完整性均有所改善,尤其是添加100和150 mmol/L海藻糖组。说明本试验通过补充海藻糖达到降低甘油浓度的目的,提高了精子冷冻保存的效率。
精子获能对成功受精和受精卵的发育起着至关重要的作用[20]。蛋白质磷酸化是一种翻译后修饰,已有证据充分证明获能似乎与精子蛋白的酪氨酸磷酸化有关,并且通过钙内流介导[21]。 在本试验中,将6%甘油对照组和冻融组(3%甘油+0、100 mmol/L海藻糖)冷冻精液解冻,结果表明与6%甘油对照组相比,添加100 mmol/L海藻糖组精子蛋白的酪氨酸磷酸化蛋白条带数量较多。证明海藻糖可提高精子酪氨酸磷酸化水平,从而影响精子的获能状态。
冷冻造成的精子细胞损伤包括:过度脱水、精子结构的有害变化、形态学改变、质膜和顶体帽损伤、线粒体损伤、细胞凋亡及精子DNA断裂[22-23]。研究表明,线粒体呼吸过程中产生的能量主要用于精子的运动和受精[24]。精子活力和生殖能力下降与线粒体功能受损(线粒体膜电位减少)之间存在着相关性。冷冻环境会冻结细胞内的水分子,损害线粒体膜,引起氧化应激,导致膜结构被破坏,以及DNA双链的断裂和DNA损伤[25-26]。研究证实,海藻糖能够保护细胞的完整性,使其免受各种环境压力的影响,如脱水、热应激、冷应激和氧化应激[27]。据报道,海藻糖添加到公羊精液冷冻保存液中,对解冻后精子活力、线粒体活性和顶体完整性均具有改善作用[28]。另有研究称,海藻糖通过增加谷胱甘肽水平和降低脂质过氧化物水平而具有间接的抗氧化作用[29]。已有研究表明,含有海藻糖的冷冻保存液改善了抗氧化作用,并减少了氧化对牛[30]、羊[31]精子低温保存引起的应激反应。本研究结果显示,甘油浓度从6%降低到3%后,精子活率和线粒体膜电位水平均显著下降,膜脂质紊乱程度显著升高,补充海藻糖后均得到了显著改善。有报道表明,冷冻可导致牛[32]和猪[33]精子鱼精蛋白缺乏,从而降低受精能力。 目前CMA3染色法是常见的评估精子中鱼精蛋白缺乏症的检测方法。 本试验结果显示,3%甘油+100 mmol/L海藻糖组精子的鱼精蛋白缺乏水平显著低于6%甘油对照组,表明海藻糖具有保护鱼精蛋白DNA结构的作用。
为了减少冷休克和氧化应激对精子的损伤,需在精液冷冻前向稀释液中添加各种冷冻保护剂。因此,本研究通过降低甘油浓度并补充海藻糖,以减少甘油的毒性,从而可以提高公牛精子的冷冻保存效率。 结果显示,与6%甘油对照组相比,3%甘油+100 mmol/L海藻糖组精子的获能状态、活率和线粒体膜电位、精子的膜脂质紊乱水平以及DNA完整性均得到显著改善,表明海藻糖替代冷冻液中的一部分甘油,可以改善延边黄牛冻融精子的质量。
4 结 论
本研究结果表明,在冷冻保护剂中将甘油浓度从6%降低到3%并补充100 mmol/L海藻糖可以显著改善精子的活力、质膜完整性和顶体完整性、获能状态、活率和线粒体膜电位水平、膜脂质紊乱水平以及DNA完整性。海藻糖的替代减少了甘油的毒性,为冷冻精子提供了更好的保护作用。
