一株高抗氧化活性戊糖片球菌的筛选
2022-02-15汪祥燕辛国芹徐海燕兰江华郝木强
汪祥燕,辛国芹,徐海燕,谷 巍,兰江华,郝木强,冯 刚
(1.山东宝来利来生物工程股份有限公司,泰安 271000;2.唐山动物园动物医院,唐山 063000)
动物在正常生理代谢过程中会产生许多自由基,当动物机体细胞内产生自由基的水平高于细胞的抗氧化防御能力时,氧化还原状态会失衡,过量的自由基积存在组织或细胞内,进而诱发氧化应激,导致氧化损伤。动物肠道作为机体吸收营养、屏障病原体最为重要的器官,也是最易受到氧化应激危害的器官,肠道的氧化损伤将直接影响到动物机体的生长发育及健康状况,导致动物采食量下降、生长发育和抗病力降低,种畜繁殖障碍、幼畜成活率低,疾病多发,死亡率增高,且畜产品品质显著降低[1-2]。在动物养殖过程中,由氧化应激导致的动物疾病有心脏病、肾脏病、腹水症、围产期疾病、乳房炎、消化道炎症等,已严重影响了畜牧业的生产[3]。
研究证明,乳酸菌在体外具有类似抗氧化剂的活性,在体内摄入乳酸菌对机体或细胞的氧化应激具有显著的调节作用[4-5]。目前报道的抗氧化乳酸菌的筛选方法较多,包含评定菌株清除DPPH自由基(DPPH·)、羟自由基(HO·)和超氧自由基的能力、抗亚油酸能力、还原能力、抑制脂质过氧化能力等[6-8]。以这些评价指标为基础建立的乳酸菌筛选方法,测定过程复杂、工作量大,且菌株间性能难以比较,且由于各种评价指标测定方法的机理不同,采用某种指标来筛选高抗氧化活性的乳酸菌菌株有一定的局限性。鉴于此,本试验以体外耐受过氧化氢氧化胁迫方法进行初筛,以体外对过氧化氢的耐受能力进行复筛,筛选具有潜在抗氧化能力的乳酸菌,并采用多种方法对筛选菌株体外抗氧化能力进行评价,综合确定优选菌株,为新型抗氧化微生态制剂、缓解畜禽养殖过程中的氧化应激提供菌种支持。
1 材料与方法
1.1 材料
1.1.1 试验菌株 试验所用27株菌全部由山东宝来利来生物工程股份有限公司菌种保藏中心提供,分别由动物肠道、青贮料、泡菜等分离源分离纯化得到,详细信息见表1。
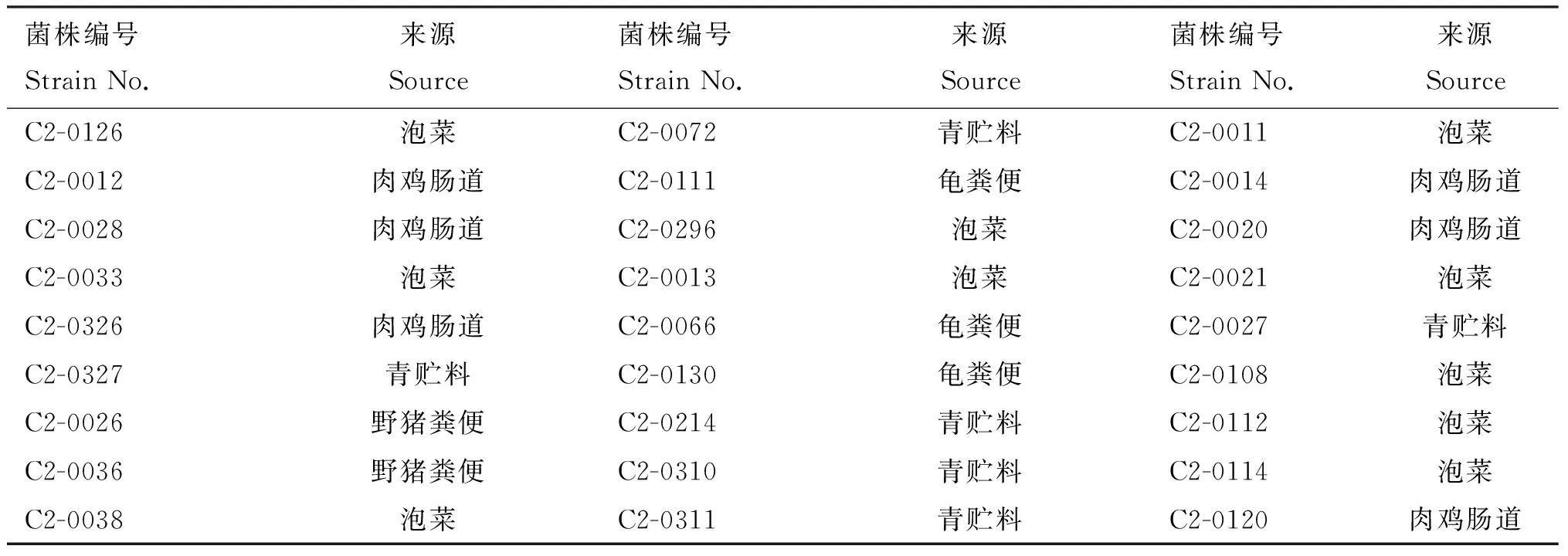
表1 试验所用菌株
1.1.2 主要试剂与仪器 总超氧化物歧化酶(total superoxide dismutase,T-SOD)、总抗氧化能力(total antioxidant capacity,T-AOC)测定试剂盒(购自南京建成生物工程研究所);MRS培养基:葡萄糖20 g/L、蛋白胨10 g/L、牛肉膏10 g/L、酵母膏5 g/L、柠檬酸铵2 g/L、乙酸钠5 g/L、磷酸氢二钾5 g/L、硫酸锰0.2 g/L、硫酸镁0.5 g/L、吐温-80 1 g/L,pH 6.0,121 ℃灭菌30 min(所用试剂均为国产分析纯)。
SHP-150生化培养箱(上海精宏实验设备有限公司)、洁净工作台(SW-CJ-2F,苏州安泰空气技术有限公司)、紫外分光光度计(UV-8000,上海元析仪器有限公司)、pH计(PB-10,德国赛多利斯集团)、立式压力蒸汽灭菌器(YM 50,上海三申医疗器械有限公司)及高速冷冻离心机(Biofuge Stratos,赛默飞世尔科技公司)等。
1.2 方法
1.2.1 抗氧化活性乳酸菌的筛选
1.2.1.1 初筛 以体外耐受过氧化氢氧化胁迫方法进行初筛,具体方法为:在灭菌的MRS液体培养基中添加过氧化氢溶液,使培养基中起始过氧化氢浓度分别为0、0.5、1.0、2.0 mmol/L。将菌体浓度为1×109CFU/mL的乳酸菌菌液按5%的接种量接种到含不同浓度过氧化氢的液体培养基中,于37 ℃培养15~18 h,用分光光度计测定菌液D600 nm值[9]。 通过计算0与2.0 mmol/L过氧化氢的D600 nm值差,进行抗氧化乳酸菌的初步筛选。
1.2.1.2 复筛 以体外对过氧化氢的耐受存活率为指标进行复筛,具体方法为:将乳酸菌接种于MRS液体培养基,37 ℃静置培养24 h。离心收集菌体,用PBS洗涤并制备5×108CFU/mL的菌液;取1.0 mL菌液, 加入4.0 mL含有2.5 mmol/L过氧化氢的PBS中。37 ℃处理20 min,再加入0.2 mg/mL过氧化氢酶终止过氧化氢对菌体的作用,然后采用标准平板计数法对样品中残存的细胞计数,并根据初始活菌数计算存活率。
1.2.2 乳酸菌的体外抗氧化功能评价
1.2.2.1 乳酸菌的培养及样品的制备 菌体培养采用MRS培养基,37 ℃静置培养24 h,所有的菌株经过3次传代。测定培养上清液(cell-free supernatants,CFS)、菌体细胞(intact cells,IC)及无细胞提取物(cell-free extracts,CFE)抗氧化性能指标,综合评价菌株的抗氧化能力,同时设置0.01%维生素C(VC)作对照。培养液5 000 r/min离心10 min,分别收集CFS和菌体沉淀;菌体沉淀用PBS洗涤3次,重悬浮于PBS,调整活菌数到109CFU/mL;所有菌悬液分为两组,一组为IC组,另一组用于CFE的制备:冰浴超声破碎细胞后12 000 r/min、4 ℃离心10 min,收集上清即为CFE。
1.2.2.2 清除DPPH·能力的测定 参照王曦等[10]方法测定乳酸菌DPPH·清除能力,按公式(1)计算:
(1)
式中:A1,1 mL DPPH与1 mL样品反应的D517 nm值;A2,1 mL无水乙醇与1 mL样品反应的D517 nm值;A3,1 mL DPPH与1 mL PBS反应的D517 nm值。
1.2.2.3 清除HO·能力的测定 参照张江巍等[11]方法测定乳酸菌HO·清除能力,按公式(2)计算:
(2)
式中:A0,反应中不含样品和过氧化氢时的D536 nm值;A1,反应中不含样品但含过氧化氢时的D536 nm值;A2,反应中含样品和过氧化氢时的D536 nm值。
1.2.2.4 还原活性的测定 参照顾品品等[12]方法测定乳酸菌的还原活性,乳酸菌样品的还原活性以对应的L-半胱氨酸盐酸盐的量来表示(μmol/L)。
1.2.2.5 抗脂质过氧化能力的测定 参照张江巍等[11]方法测定乳酸菌的抗脂质过氧化能力,按公式(3)计算:
(3)
式中:A样品、A空白分别为样品及PBS反应时D532 nm值。
1.2.2.6 T-SOD活性及T-AOC测定 按照试剂盒说明书步骤测定乳酸菌样品的T-SOD活性及T-AOC。
1.2.3 菌株鉴定
1.2.3.1 16S rDNA扩增与序列分析 参照汪祥燕等[13]方法对乳酸菌进行16S rDNA扩增与序列分析,PCR产物送至北京铂尚生物技术有限公司进行序列测定。
1.2.3.2 系统发育分析 登录NCBI(http:∥www.ncbi.nlm.nih.gov)对菌株16S rDNA测序结果利用BLAST进行检索,并下载相关属种的16S rDNA序列,采用DNAMAN、DNAclub、Mega 5.2等软件进行相似性分析后构建系统进化树。
1.3 数据统计分析
采用SPSS 13.0统计分析软件中One-Way ANOVA程序对乳酸菌体外抗氧化性能指标进行方差分析,用t检验进行组间比较,结果以平均值±标准差表示。 以P<0.05作为差异显著性判断标准。
2 结 果
2.1 抗氧化乳酸菌的初筛
27株乳酸菌在不同浓度过氧化氢体系的D600 nm值见表2。由表2可知,随着过氧化氢浓度的增大,菌株的吸光值有不同程度降低。与0 mmol/L组相比,2.0 mmol/L组有19株乳酸菌D600 nm值显著降低(P<0.05),8株乳酸菌无显著差异(P>0.05)。因此,选取这8株菌进行下一步的复筛,它们分别为C2-0126、C2-0028、C2-0327、C2-0310、C2-0011、C2-0020、C2-0021及C2-0108。
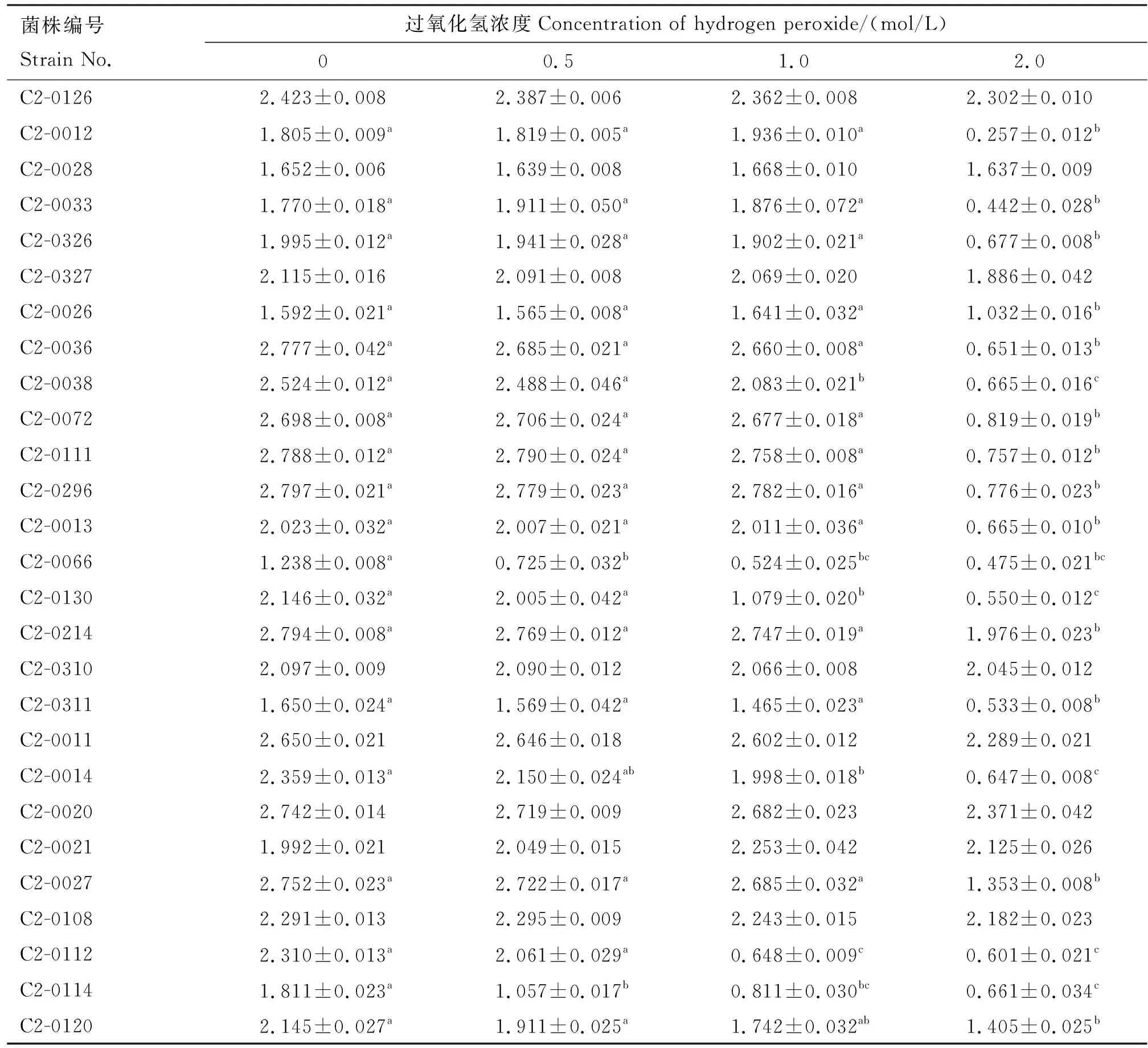
表2 菌株在不同浓度过氧化氢体系的D600 nm值
2.2 抗氧化乳酸菌的复筛
由表3可知,8株乳酸菌在37 ℃、2.0 mmol/L过氧化氢中孵育20 min后耐受存活率差异较大。其中,乳酸菌C2-0020、C2-0126及C2-0327存活率在80%以上,且C2-0327耐受过氧化氢存活率最高,为95.3%。选取这3株菌进行下一步体外抗氧化性能评价。
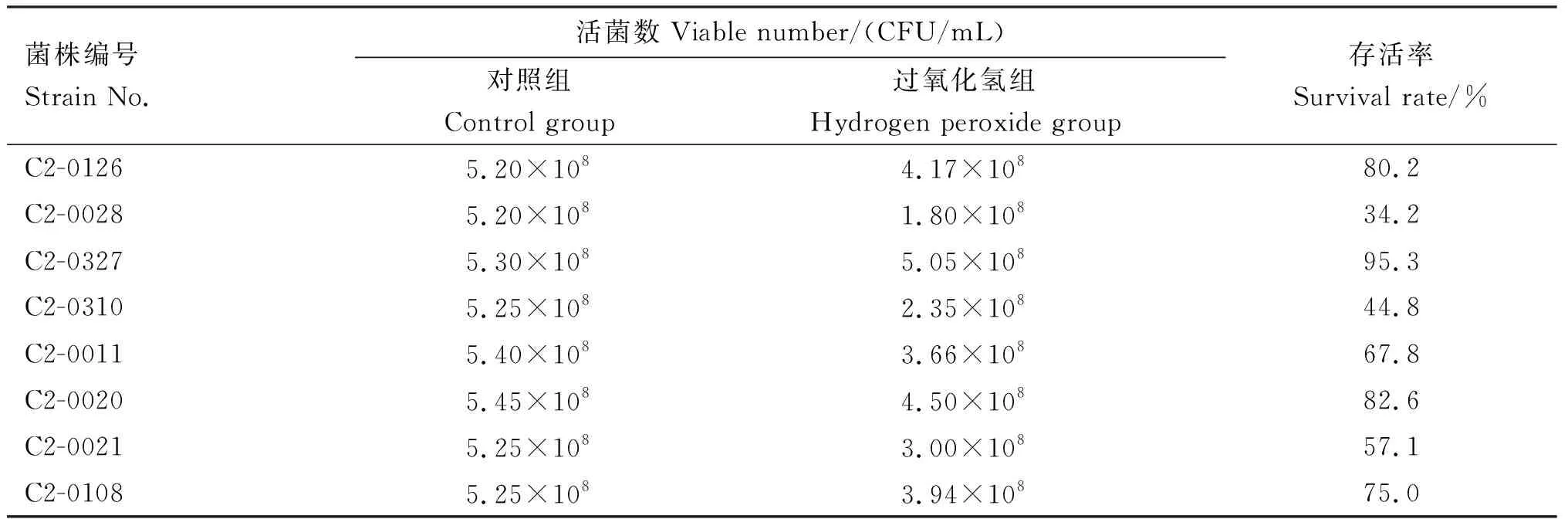
表3 菌株在2.0 mmol/L过氧化氢体系下的活菌数及存活率
2.3 乳酸菌抗氧化性能评价
分别测定3株强耐受过氧化氢乳酸菌CFS、IC及CFE抗氧化性能指标,结果见图1。由图1A可知,3株乳酸菌CFS DPPH·清除率均较高,与0.01% VC清除效果(95.3%)相当;由图1B可知,C2-0327及C2-0126 IC对HO·清除率较高(140%左右),均显著高于C2-0020(P<0.05),且均显著高于0.01% VC(6.4%)(P<0.05);由图1C可知,3株乳酸菌CFS的L-半胱氨酸当量由高到低为:C2-0020>C2-0327>C2-0126,分别为3 159、 3 147及2 977.5 μmol/L,均显著高于0.01% VC(902 μmol/L)(P<0.05);由图1D可知,3株乳酸菌CFS的抗脂质过氧化率由高到低为:C2-0327>C2-0020>C2-0126,其中C2-0327的抗脂质过氧化率显著高于0.01%VC(32.6%)(P<0.05),且C2-0327的IC和CFE也有较高的抗脂质过氧化能力。
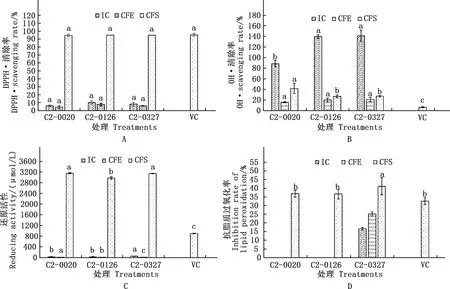
相同培养液组分,肩标不同字母表示差异显著(P<0.05);肩标相同字母或无字母标注表示差异不显著(P>0.05)。下同In the same culture components,values with different letter superscripts mean significant (P<0.05);While with the same or no letter superscripts mean no significant difference (P>0.05).The same as below图1 乳酸菌体外抗氧化性能指标测定结果Fig.1 Determination results of antioxidant capacity indexes of lactic acid bacteria in vitro
由图2A可知,C2-0327菌株CFS的T-SOD活性达81.32 U/mL,显著高于菌株C2-0126、C2-0020(P<0.05);由图2B可知,3株乳酸菌CFS T-AOC均较高,由高到低分别为C2-0327、C2-0126、C2-0020,T-AOC分别为20.10、18.99、18.94 U/mL。
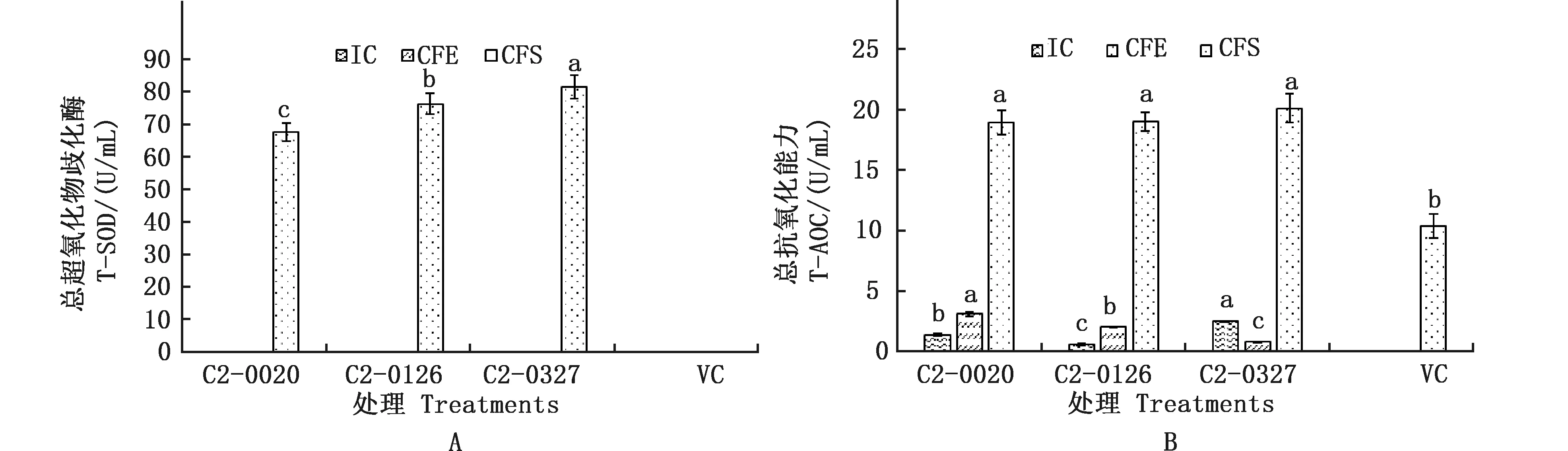
图2 乳酸菌总超氧化物歧化酶活性(A)及总抗氧化能力(B)Fig.2 Total superoxide dismutase activity (A) and total antioxidant capacity (B) of lactic acid bacteria
综合以上6项体外抗氧化性能指标的测定结果,菌株C2-0327抗氧化性能最优,对其进行菌种鉴定。
2.4 菌种鉴定
挑取菌株C2-0327纯培养物种接于MRS培养基平皿,37 ℃培养48 h后形成乳白色圆形菌落,光滑,凸起,边缘整齐,不透明。革兰氏染色为阳性。显微镜下观察发现,菌体细胞呈球状,不形成芽孢。
由16S rDNA测序结果可知,乳酸菌C2-0327的序列长度为1 441 bp。将该序列在NCBI中进行BLAST比对,并从中调取、下载与菌株C2-0327相似性较高的和该属内其他相关菌株的16S rDNA,利用Mega 5.2软件的Neighboring-Joining方法,构建系统进化树(图3)。由图3可知,菌株C2-0327与已知戊糖片球菌(Pediococcuspentosaceus)的16S rDNA序列相似度为100%。综合菌落及菌体形态,菌株C2-0327鉴定为戊糖片球菌。
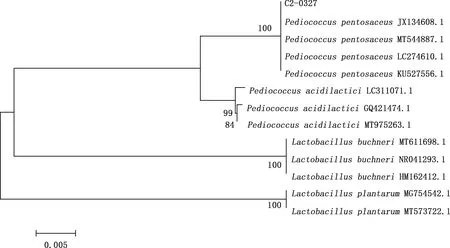
图3 菌株C2-0327与相关菌株的系统进化树Fig.3 Phylogenetic tree between C2-0327 and related strains
3 讨 论
3.1 抗氧化乳酸菌的筛选
过氧化氢作为HO·的前体参与氧化过程,以体外对过氧化氢的耐受能力作为抗氧化乳酸菌的筛选指标,简便高效,且菌株间易比较。 张江巍等[11]试验结果显示,当用2 000 mg/L过氧化氢在37 ℃处理1 min后,乳酸菌L3、L4的存活率仅有40%和70%,保加利亚乳杆菌的存活率仅有20%。田丰伟[14]试验结果显示,169株乳酸菌在0.5 mmol/L过氧化氢溶液中孵育1 min后菌株存活率在10%以上的菌株仅32株;这些菌株在0.5 mmol/L过氧化氢中处理10 min后存活率在50%以上的仅6株,最高存活率为80%,在2.0 mmol/L过氧化氢中处理10 min后仅有4株菌存活,存活率为1.5%~55%。王悦齐等[15]研究结果显示,菌体起始浓度为1.0×109CFU/mL、过氧化氢体积分数为0.25%、37 ℃仅处理1 min后,抗氧化性能较好的戊糖片球菌L4存活率在85%左右。本试验通过测定菌株对过氧化氢的耐受能力,对抗氧化菌株进行快速筛选,从27株乳酸菌中筛选出3株强抗氧化乳酸菌,在2.0 mmol/L过氧化氢、37 ℃条件下孵育20 min后菌株存活率较高,分别为95.3%、82.6%及80.2%,与已报道文献相比,耐受过氧化氢能力处于较高水平。
3.2 乳酸菌的体外抗氧化能力
乳酸菌具有抗氧化作用,但菌株之间的抗氧化活性具有较大的差异,同一菌株不同组分的抗氧化能力也不同。本试验筛选菌株的DPPH·清除功能主要存在于胞外代谢产物中,而其IC和CFE也可起到一定的DPPH·清除作用;筛选菌株的HO·清除功能主要存在于其完整菌体中,而其胞内和胞外代谢产物也可起到一定的HO·清除作用,这与刘亚东等[16]的结论相同,即不同菌株间清除自由基能力的差异可能是因为其胞外多糖和胞内抗氧化应激酶系统、硫氧还蛋白系统、谷胱甘肽系统、巯基氧化还原系统等差异造成的。王惠等[17]试验中12株乳酸菌无菌体发酵液均具有较好的清除DPPH·能力,其清除能力在59.98%~71.23%之间,而细胞菌悬液的HO·清除能力强于无菌体发酵液。王惋等[18]结果显示,菌株A15完整细胞悬液的HO·清除率为39%。本试验筛选菌株的还原活性及抗脂质过氧化活性物质很可能主要存在于胞外代谢产物中,而其IC和CFE也可起到一定的还原活性,这与王英等[19]结论一致,在王英等[19]研究中,不同菌株之间的还原活性差异显著,还原活性在34.84~284.02 μmol/L(以L-半胱氨酸当量计),菌株脂质过氧化抑制率最高为68.88%。张江巍等[11]在抗亚油酸过氧化试验中发现,有27株乳酸菌对亚油酸过氧化有抑制作用,抑制率的范围为4.9%~75.2%。此外,有些乳酸菌在发酵过程中还能分泌具有抗氧化性能的酶类,如SOD、谷胱甘肽过氧化物酶(GSH-Px)等[20],且可用T-AOC评价其抗氧化功能。本试验筛选菌株的T-SOD活性及T-AOC很可能主要存在于胞外代谢产物中。目前对乳酸菌抗氧化能力的研究和利用多是针对菌体细胞及无细胞提取物,然而本研究表明,乳酸菌抗氧化活性物质较多分布在胞外分泌物中。
乳酸菌作为一种天然的抗氧化剂,具有安全、无毒副作用、稳定、增强机体免疫力等重要优势。常见的抗氧化活性乳酸菌主要有发酵乳杆菌、干酪乳杆菌、长双歧杆菌、嗜热链球菌、嗜酸乳杆菌和植物乳杆菌等[21-23],不同乳酸菌菌株的抗氧化能力存在很大差异,可能是不同乳酸菌分泌的抗氧化物质的种类、数量及浓度的差异所致。本试验通过耐受过氧化氢胁迫筛选及多种方法综合评价得到的高抗氧化活性乳酸菌为戊糖片球菌,抗氧化活性物质较多分布在胞外分泌物中。后期将在本研究的基础上针对戊糖片球菌C2-0327体内抗氧化性能、抗氧化物质及抗氧化的分子调控机制展开进一步研究。
4 结 论
本研究通过耐受过氧化氢胁迫筛选及多种体外抗氧化能力综合评价,筛选到1株高抗氧化活性戊糖片球菌C2-0327,其对2.0 mmol/L过氧化氢的耐受存活率为95.3%,其抗氧化活性物质较多分布在胞外分泌物中。
