中华蜜蜂GABARAP基因克隆、生物信息学分析及原核表达载体的构建
2022-02-15于慧敏吴鹏杰李南南徐书法武江利
于慧敏,吴鹏杰,李南南,谭 静,徐书法,武江利
(中国农业科学院蜜蜂研究所,农业农村部授粉昆虫生物学重点实验室,北京 100093)
细胞自噬(autophagy)是维持细胞内环境稳态及抗病调节的重要调控途径[1-3]。自噬的形成和发生由一系列的自噬相关蛋白(autophagy related genes,ATG)进行调控。在自噬过程中Atg8蛋白是唯一能留在膜上的ATG蛋白,可作为自噬发生的标记蛋白。Atg8蛋白家族可与磷脂酸肌醇结合,参与自噬体膜的形成影响自噬途径[4-6]。已知的γ-氨基丁酸A受体相关蛋白(gamma-aminobutyric acid receptor-associated protein,GABARAP)是自噬相关蛋白Atg8家族的成员,在自噬过程中发挥着不可替代的作用[7]。人源GABARAP蛋白由117个氨基酸组成,分子质量约为14 ku,在进化上高度保守,其N-端亚结构区域能与微管蛋白结合,而C-端亚结构区域可与GABAA受体结合[8-9]。相关研究证明了在GABAA受体的胞内转运过程中,GABARAP蛋白能起到组装微管的作用,且GABRAP蛋白可通过调节GABAA受体的转运来调控GABAA受体的突触定位[10-11]。Wang等[12]通过免疫学方法证明了GABARAP蛋白在神经元的胞体和突触中表达。研究发现,GABARAP蛋白是自噬发生的良好标记,对于自噬体的形成、延伸和成熟非常重要[13-15]。因此,GABARAP蛋白不仅在神经传递中发挥重要作用,还参与细胞自噬过程。GABARAP蛋白可激活丝氨酸/苏氨酸激酶家族中的UNC-51激酶复合体(UNC-51 like kinase,ULK)来调节其特定自噬体的扩张[16-17]。相关研究表明,与LC3家族相比,GABARAP家族在氨基酸匮乏和线粒体自噬方面发挥着更重要的作用[18-19]。GABARAP蛋白能与一种RNA解旋酶DDX47发生相互作用,将二者共转染到肿瘤细胞系中可诱导细胞凋亡[20-21]。白荣耀[22]研究发现,在感染溶藻弧菌3 h后,鲍鱼血细胞SaGABARAP基因转录水平上调且达到最大值。由此可知,GABARAP蛋白在生物体细胞凋亡、免疫应答中也发挥着关键作用。
关于GABARAP基因的研究已从单细胞酵母逐步扩展到了高等动物和植物。但就蜜蜂而言,仅有GABARAP和LC3作为自噬相关蛋白Atg8家族成员在西方蜜蜂上进行报道,然而对GABARAP基因在自噬过程中的作用机制研究仍较少[23]。鉴于此,本研究克隆了中华蜜蜂的自噬相关基因GABARAP,利用生物信息学方法对该基因进行了序列分析及结构预测,构建了原核表达载体,诱导并纯化了带有His标签的GABARAP蛋白,以期为中华蜜蜂GABARAP基因功能的深入研究提供理论依据。
1 材料与方法
1.1 样品来源
3日龄中华蜜蜂幼虫均由中国农业科学院蜜蜂研究所提供,样品收集后于液氮迅速冷冻,于-80 ℃保存备用。
1.2 主要试剂
总RNA提取试剂购自Invitrogen公司;RNA反转录试剂盒购自Promega公司;TransTaq酶、T4 DNA快速连接酶均购自北京全式金生物技术有限公司;SuperReal PreMix Plus(SYBR Green)实时荧光定量试剂盒购自天根生化科技(北京)有限公司;DNA限制性内切酶BamHⅠ和NotⅠ均购自NEB公司;质粒DNA提取试剂盒、琼脂糖凝胶DNA回收试剂盒均购自Bio-Tek公司;抗His标签鼠单克隆抗体、HRP标记的山羊抗小鼠IgG、Ni-Agarose His标签蛋白纯化试剂盒、One Step Western Kit HRP(MOUSE)、DAB蛋白显色试剂盒均购自北京康为世纪生物科技有限公司。
1.3 引物设计与合成
参照GenBank中的西方蜜蜂GABARAP基因序列(登录号:XM_001120069.5),使用Primer Premier 5.0软件在非编码区设计引物,引物序列为:GABARAP-F1:5′-ACTGACGCACGGTGAT-TG-3′;GABARAP-R1:5′-AGCTTCTAAAAGGA-CTAC-3′。同时设计带有酶切位点的特异性引物用于扩增开放阅读框,引物序列为:GABARAP-F2:5′-CGCGGATCCATGAAGTTTCATTACAAAG-3′;GABARAP-R2:5′-ATTTGCGGCCGCTTAGTGT-CCATACACATTC-3′;下划线处分别为BamHⅠ和NotⅠ酶切位点。 引物均由北京博迈德公司合成。
1.4 GABARAP基因克隆
1.4.1 中华蜜蜂总RNA提取与单链cDNA合成 取2只中华蜜蜂幼虫于1.5 mL的EP管中,加入液氮迅速研成粉末,采用Trizol法提取总RNA,通过NanoDrop2000c及琼脂糖凝胶电泳对RNA进行质控检测。按照反转录试剂盒说明书将RNA反转录为cDNA。
1.4.2GABARAP基因巢式PCR扩增 以cDNA为模板,用引物GABARAP-F1/R1进行第1轮PCR扩增。 PCR反应体系50 μL:10×TransTaqHiFi BufferⅡ 5 μL,dNTPs 4 μL,上、下游引物各1 μL,cDNA 4 μL,TransTaqHiFi DNA Polymerase 1 μL,ddH2O 34 μL。PCR反应程序:94 ℃预变性3 min;94 ℃变性30 s,52 ℃退火30 s,72 ℃延伸1 min,共30个循环;72 ℃延伸10 min。以第1轮PCR产物为模板,用GABARAP-F2/R2引物进行第2轮PCR扩增,PCR反应体系与第1轮扩增相同。PCR反应程序:94 ℃预变性3 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸1 min,共30个循环;72 ℃延伸10 min。PCR产物进行1.5%琼脂糖凝胶电泳检测,胶回收纯化获取目的片段。
1.4.3 pEasy-T5-GABARAP重组质粒的克隆与鉴定 将回收的目的片段与pEasy-T5克隆载体在25 ℃金属浴下连接15 min。连接体系5 μL:PCR产物4 μL,pEasy-T5克隆载体1 μL。 将连接产物转化大肠杆菌Trans-T1感受态细胞,涂布于含氨苄青霉素(Amp)(50 μg/μL)、X-Gal(20 mg/mL)和IPTG(500 mmol/L)的LB固体培养基中培养,37 ℃培养约12 h后挑取菌落,放入具有Amp抗性的LB液体培养基中震荡培养过夜。 利用菌液PCR方法鉴定分析pEasy-T5-GABARAP阳性克隆,并测序鉴定。
1.4.4 生物信息学分析 用ORFfinder(https:∥www.ncbi.nlm.nih.gov/orffinder/)在线软件对中华蜜蜂GABARAP基因的阳性克隆序列进行核苷酸翻译;利用NCBI的BLAST程序对中华蜜蜂GABARAP基因序列进行比对;筛选出与GABARAP氨基酸序列相似性高的物种;应用Mega 5.1软件对氨基酸序列进行对比并利用邻接法建立系统进化树;采用PrediceProtein(https:∥www.predictprotein.org/)在线分析软件预测中华蜜蜂GABARAP蛋白二级结构及组成;通过SWISS-MODEL(https:∥swissmodel.expasy.org/)在线预测GABARAP蛋白三维结构[24]。
1.5 GABARAP的原核表达
1.5.1 pET-32a(+)-GABARAP重组质粒的构建与鉴定 用限制性内切酶BamHⅠ和NotⅠ将pEasyT5-GABARAP与pET-32a(+)原核表达载体于37 ℃酶切3 h,对双酶切产物鉴定并回收纯化,然后用T4 DNA连接酶连接。反应体系10 μL:5×T4 DNA Ligase Buffer 2 μL,pET-32a(+)酶切产物1 μL,pEasyT5-GABARAP酶切产物5 μL,T4 DNA连接酶1 μL,ddH2O 1 μL。25 ℃连接15 min。将重组质粒连接产物转化大肠杆菌DH5α感受态细胞,筛选阳性克隆并测序。最后将测序正确的阳性重组质粒转化大肠杆菌BL21(DE3)感受态细胞,涂布于具有Amp抗性的LB固体培养基中培养过夜。
1.5.2 GABARAP蛋白的诱导表达 挑取含有pET-32a(+)-GABARAP重组质粒的BL21(DE3)阳性菌,在含有氨苄青霉素(50 μg/mL)的LB液体培养基中振荡培养直至D600 nm值为0.8,保存菌液,取部分菌液作为对照组,余下菌液按1∶1 000加入IPTG进行诱导,于37 ℃摇床中振荡培养4 h后,取出少量菌液,离心后去上清,沉淀用PBS重悬后加入等体积的2×SDS-PAGE上样缓冲液,沸水中煮5 min,进行SDS-PAGE,之后用考马斯亮蓝染色初步鉴定GABARAP蛋白是否表达。
1.5.3 GABARAP蛋白的Western blotting鉴定 将经SDS-PAGE的蛋白条带转印至NC膜上,采用抗His标签鼠单克隆抗体进行一抗孵育,山羊抗小鼠IgG(H+L)二抗孵育后用One Step Western Kit HRP(MOUSE)进行显色,进一步验证表达产物。
1.6 GABARAP蛋白的纯化
1.6.1 GABARAP蛋白可溶性分析 对诱导的菌液用超声波破碎,经12 000 r/min离心30 min后,分别取上清和沉淀进行Western blotting,鉴定其表达形式。
1.6.2 GABARAP蛋白包涵体纯化 按照His标签蛋白纯化试剂盒操作说明书对包涵体蛋白进行纯化,将超声处理后的沉淀依次在包涵体洗涤液Ⅰ和洗涤液Ⅱ中进行重悬溶解,在含8 mol/L尿素的变性液中进行变性,然后在不同浓度尿素的复性液中低温透析,最后置换到PBS中,获得纯化蛋白[25]。
2 结 果
2.1 GABARAP基因克隆
中华蜜蜂幼虫总RNA经巢式PCR扩增结果显示,第1轮PCR扩增获得大小约606 bp的目的片段,第2轮PCR扩增得到大小约354 bp的目的片段(图1),均与预期相符。将目的片段成功转化后,利用GABARAP-F2/R2引物经菌液PCR方法扩增得到大小为354 bp的片段(图2),与第2轮PCR扩增的目的片段一致,且测序结果证明了该片段为GABARAP基因的有效序列,方向正确。NCBI同源检索表明中华蜜蜂GABARAP基因与西方蜜蜂GABARAP基因的序列一致性为100%。
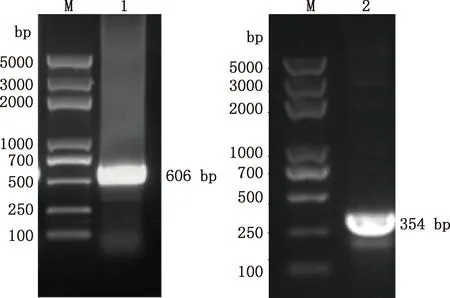
M,DL5000 DNA Marker;1,第1轮PCR产物;2,第2轮PCR产物M,DL5000 DNA Marker;1,The first round PCR product;2,The second round PCR product图1 中华蜜蜂GABARAP基因巢式PCR扩增结果Fig.1 Nested PCR amplification results of GABARAP gene of Apis cerana cerana
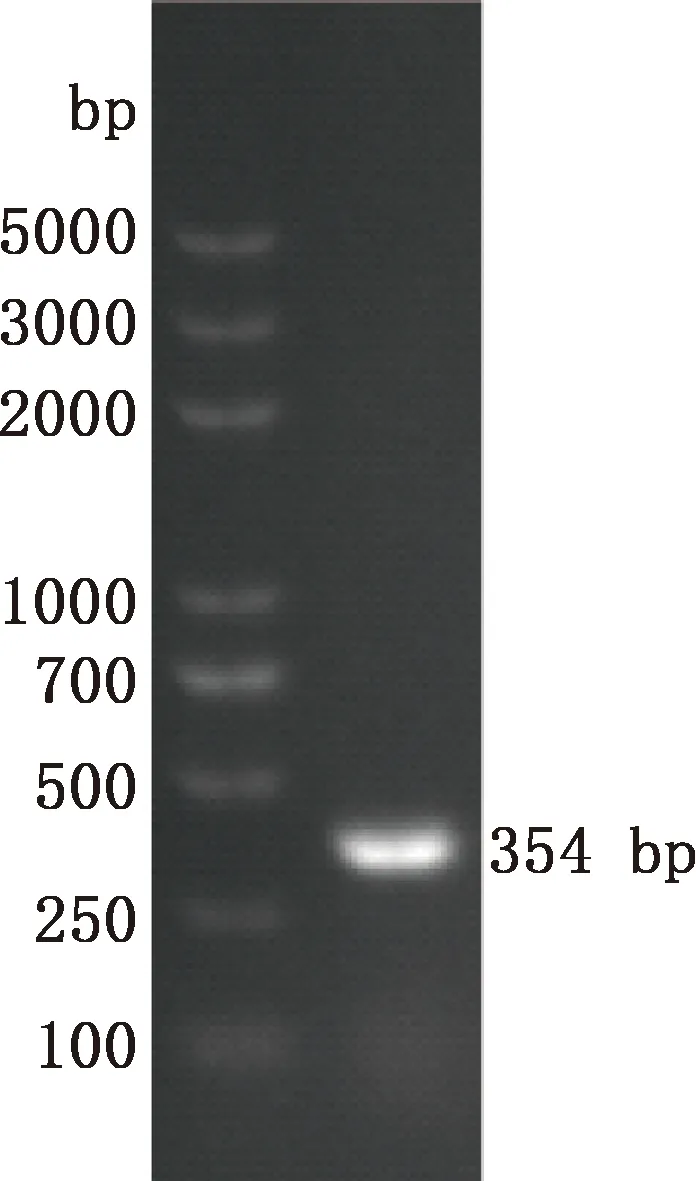
图2 重组质粒pEasy-T5-GABARAP的PCR检测Fig.2 PCR detection of recombinant plasmid pEasy-T5-GABARAP
2.2 GABARAP相似性比对与系统进化分析
GABARAP蛋白氨基酸序列分析显示,GABARAP基因的354 bp有效序列共编码117个氨基酸,分子质量为13.99 ku,等电点为9.48。
BLAST在线分析结果显示,中华蜜蜂GABARAP氨基酸序列与西方蜜蜂、大蜜蜂、小蜜蜂、欧洲熊蜂、东方熊蜂的氨基酸序列相似性均高达100%;与芦蜂的GABARAP氨基酸序列相似性也较高,达99%(表1)。由构建的进化树可知,中华蜜蜂与同为膜翅目的其他昆虫如西方蜜蜂、小蜜蜂、大蜜蜂、欧洲熊蜂和东方熊蜂亲缘关系最近,处于同一簇中(图3)。
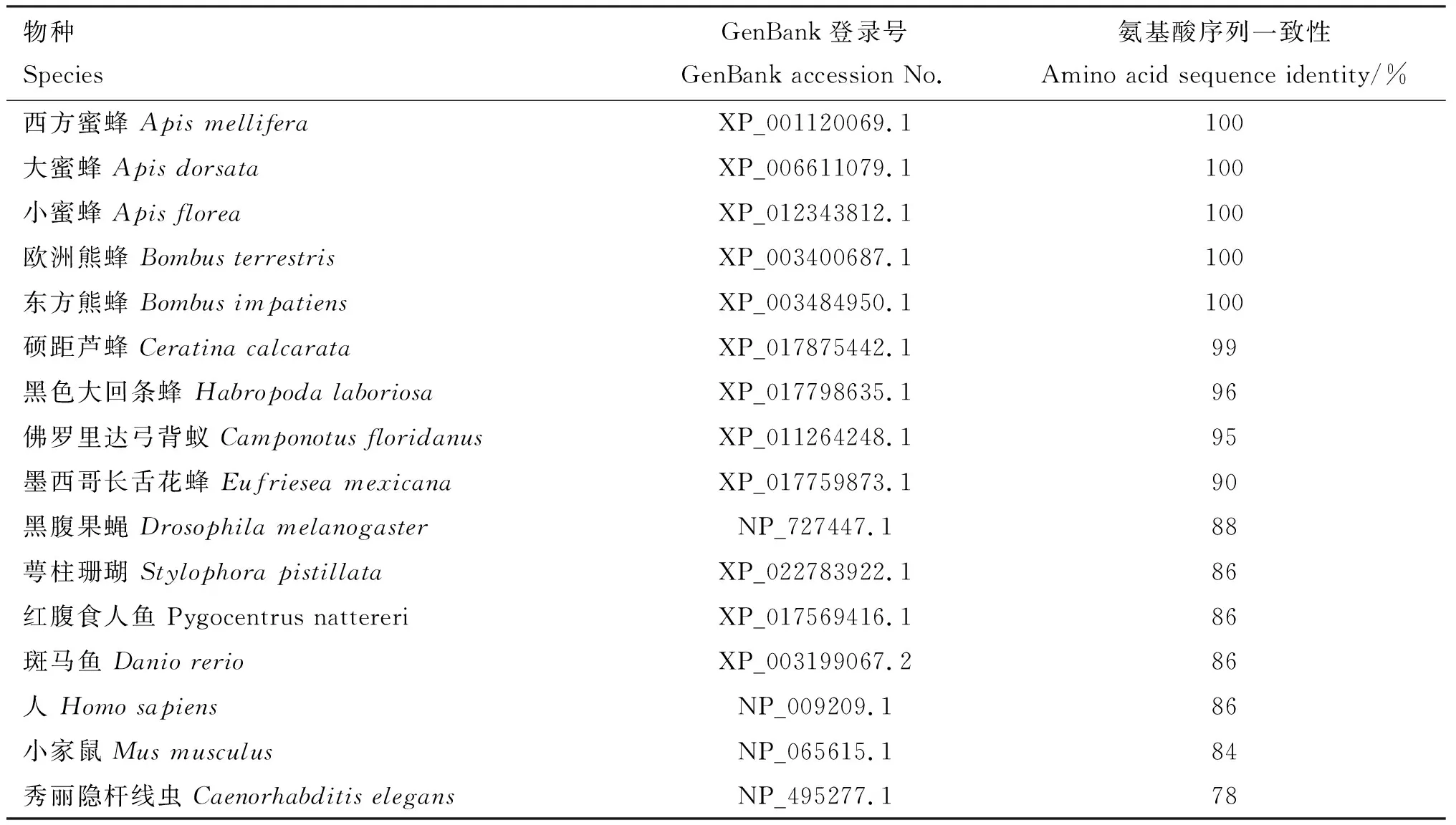
表1 中华蜜蜂GABARAP蛋白与其他物种同源蛋白氨基酸序列一致性比对
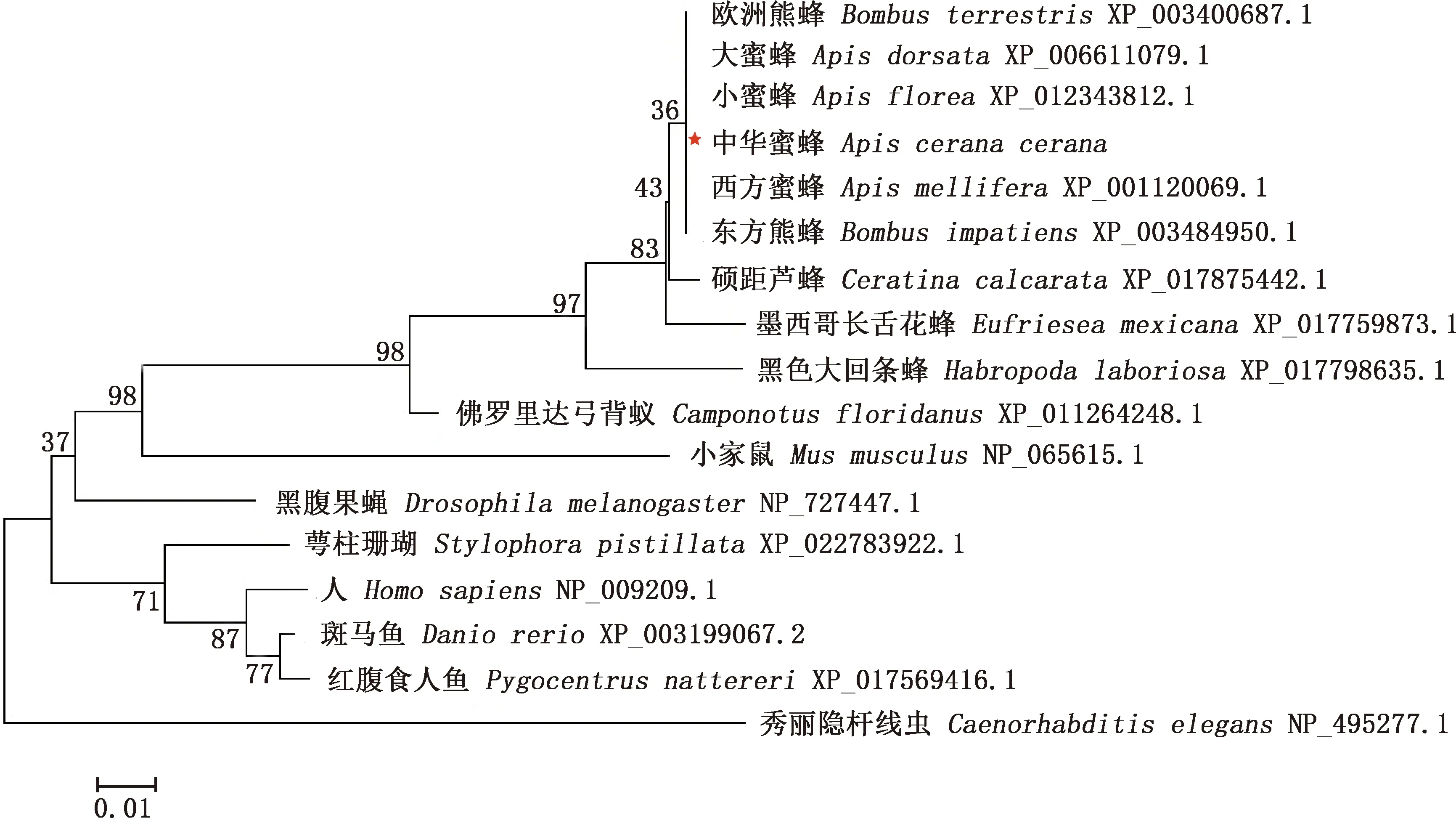
图3 基于中华蜜蜂与其他物种GABARAP氨基酸序列的系统进化树Fig.3 Phylogenetic tree based on amino acid sequences of GABARAP from Apis cerana cerana and other species
2.3 GABARAP蛋白结构功能预测
经PrediceProtein在线预测分析获得GABARAP基因编码蛋白二级结构,GABARAP蛋白含有3个α-螺旋和4个β-折叠结构,以alpha-beta-beta-alpha-beta-alpha-beta的排列方式存在,具有6个多肽结合位点,没有预测到蛋白含有二硫键或跨膜结构域(图4)。
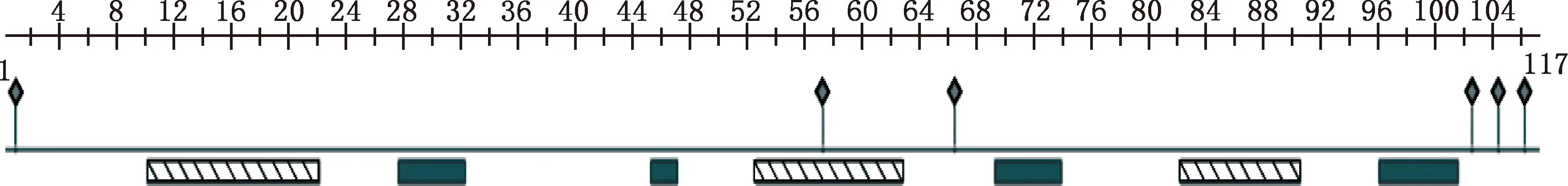
图中条纹框代表α-螺旋;填充框代表β-折叠;菱形框代表多肽结合位点The striped frame indicates alpha-helices;The fill frame indicates beta-sheets;The diamond frame indicates polypeptide binding sites图4 中华蜜蜂GABARAP蛋白二级结构预测Fig.4 Secondary structure prediction of GABARAP protein of Apis cerana cerana
利用SWISS-MODEL在线预测GABARAP蛋白三级结构。根据相似性选择氨基酸序列一致性为85.47%的1gnu.1.A作为同源模拟的模板,进行GABARAP单体的同源建模。由图5A可知,3个α-螺旋在图示蛋白结构的外表面,4个β-折叠在图示蛋白结构的内表面。预测到的中华蜜蜂GABARAP蛋白的三级结构与图5B中真核生物的GABARAP的晶体结构(PDB:1GNU)极为类似,由此推测中华蜜蜂GABARAP蛋白可能执行与真核生物GABARAP蛋白相似的功能。
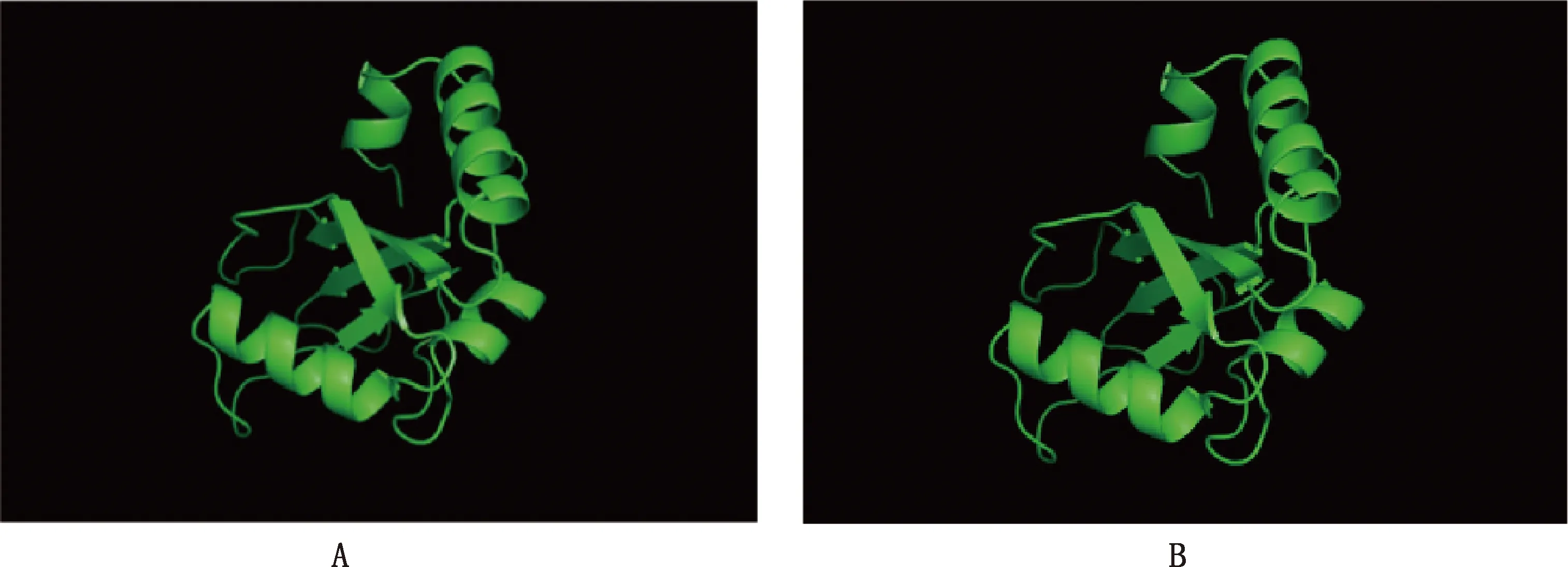
图5 中华蜜蜂GABARAP蛋白单体三级结构同源模拟(A)和1GNU三维结构(B)比较Fig.5 Comparison of the tertiary structure homology modeling in Apis cerana cerana GABARAP monomer protein (A) and 1GNU three-dimensional structure (B)
2.4 GABARAP蛋白原核表达
SDS-PAGE结果显示,诱导的pET-32a(+)-GABARAP重组质粒在35 ku处有一条特异蛋白条带,与预期大小一致,而未诱导样品中则无相应的条带(图6A)。利用His 标签抗体进行Western blotting检测进一步证明了35 ku的单一蛋白条带为重组蛋白(图6B)。
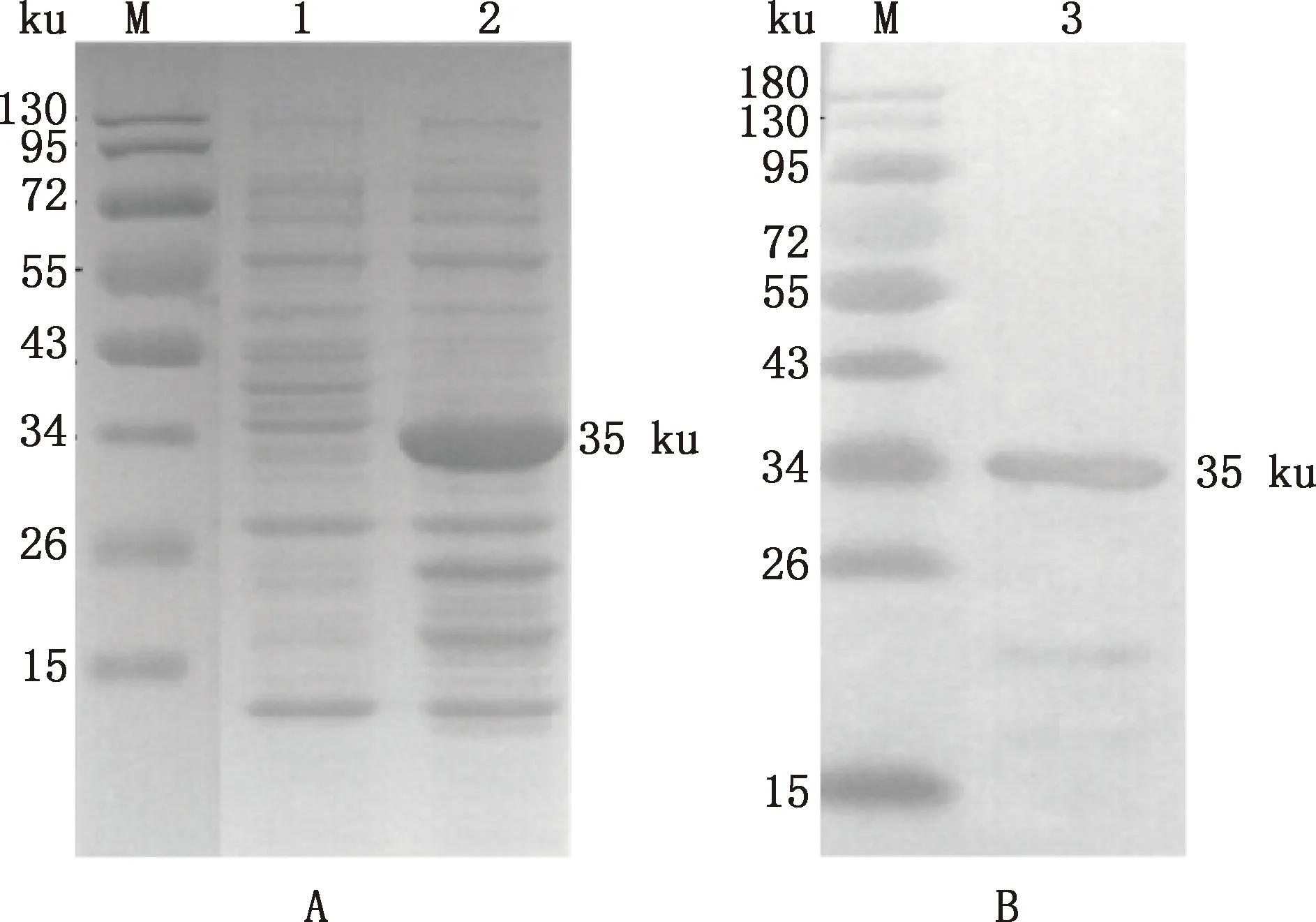
M,蛋白质分子质量标准;1,未诱导重组质粒;2、3,诱导后重组质粒M,Protein Marker;1,Uninduced recombinant plasmid;2 and 3,Induced recombinant plasmid图6 GABARAP蛋白的诱导表达(A)和Western blotting检测(B)Fig.6 Induced expression (A) and detection of Western blotting (B) of GABARAP protein
超声处理过的诱导表达重组菌液,经Western blotting分析可知该重组蛋白的表达在包涵体中(图7)。经His标签蛋白纯化试剂盒(包涵体蛋白)纯化后,在获得第3 mL穿流液时检测到重组蛋白(图8)。
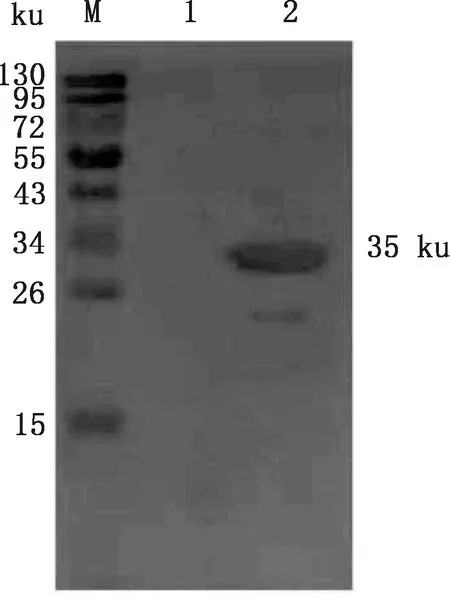
M,蛋白质分子质量标准;1,重组蛋白超声后上清;2,重组蛋白超声后沉淀M,Protein Marker;1,Supernatant of recombinant protein after ultrasonic processing;2,Precipitation of recombinant protein after ultrasonic processing图7 GABARAP重组蛋白可溶性分析Fig.7 Soluble analysis of recombinant protein GABARAP

M,蛋白质分子质量标准;1~6,第1~6 mL流穿液M,Protein Marker;1-6,The 1-6 mL filtration图8 重组蛋白GABARAP纯化Fig.8 Purification of the recombinant protein GABARAP
3 讨 论
细胞自噬广泛存在于真核生物中,是一种高度保守的自我降解系统,可参与生物的生长发育、分化、炎症反应及免疫调控等,在维持胞内环境稳定性方面发挥着重要作用[26]。自噬的发生与调节是由一系列的ATGs共同发挥作用。Atg8蛋白可通过调控自噬体膜的形状和功能影响细胞自噬。GABARAP蛋白是Atg8家族的成员,是一种高度保守的蛋白,能与多种细胞因子互作,高度调控自噬体的运输、形成与成熟等过程[4-6,27]。GABARAP能与上游调控因子MAPK15和ERK8发生相互作用,从而诱导自噬的起始[28-30]。Huber等[31]研究表明,GABARAP蛋白可通过不依赖脂化的方式调节泛素修饰蛋白活化酶5(UBA5)在内质网膜上的定位和功能。此外,在人类免疫缺陷病毒(HIV)感染早期辅助蛋白Nef(负调控因子)大量表达,该蛋白能通过干扰内吞和晚期分泌途径中的蛋白质来调控在免疫和病毒生命周期中起重要作用的各种细胞表面受体的表达[32]。综上,GABARAP蛋白与自噬体的发生、组织定位密切相关。
基于GABARAP功能的重要性,本研究克隆获得了中华蜜蜂GABARAP基因序列,经氨基酸序列分析发现,该基因编码117个氨基酸,蛋白分子质量为13.99 ku,研究结果与前期报道的人源GABARAP基因基本一致[33]。Bai等[34]研究表明,在杂色鲍中克隆GABARAP基因的cDNA全长得到963 bp,具有354 bp的开放阅读框,推导的蛋白分子质量为13.9 ku,等电点为8.73,该结果与本研究中华蜜蜂GABARAP基因的克隆及推导结果几乎完全相同,可见GABARAP基因在进化中高度保守,且该基因在应对病原体感染及胚胎发育中发挥着重要作用。GABARAP氨基酸序列比对和系统进化树分析也表明了该基因的保守性。 人源GABARAP蛋白二级结构含有4个α-螺旋,而中华蜜蜂GABARAP蛋白仅预测到3个α-螺旋,在第4-8位的氨基酸没有预测到α-螺旋,推测是此位置氨基酸的差异不易形成螺旋结构[8]。中华蜜蜂GABARAP三级结构预测结果与已发表的人源GABARAP蛋白的晶体结构(PDB∶1GNU)极为相似,Jatana等[35]研究表明,人源GABARAP蛋白高度参与自噬体的发生,从而调控细胞凋亡和免疫应答等。因此,推测中华蜜蜂GABARAP基因可能执行类似自噬调节相关的功能。GABARAP经原核表达并纯化得到了35 ku的蛋白,Western blotting结果验证了该蛋白的准确性,为后续中华蜜蜂GABARAP多克隆抗体的制备奠定了基础。人源GABARAP与其3个家族成员(GABARAPL1、GABARAPL2和GABARAPL3)相似性很高,抗体检测易与其家族成员产生交叉反应,对GABARAP抗体的进一步应用产生一定影响,西方蜜蜂Atg8家族成员仅包含GABARAP和LC3,因此不存在GABARAP抗体检测过程中的内源性干扰[23,36-37]。GABARAP蛋白广泛存在于多种组织中,在生物体的生长发育过程中不同程度地表达[12]。有研究证明GABARAP蛋白可以与自噬相关蛋白Atg13发生相互作用来调节自噬的发生[38-39],可见GABARAP蛋白是自噬的良好标记,在自噬过程中起着关键的调节作用。相关研究也发现家蚕感染核型多角体病毒(BmNPV)后可触发自噬的发生,表现为Atg8基因的上调表达且免疫荧光也观察到Atg8-GFP大量增加[40-41]。
4 结 论
本试验克隆了中华蜜蜂GABARAP基因,其长度为354 bp,编码117个氨基酸。氨基酸序列比对及进化树分析表明GABARAP基因保守,二、三级结构预测该蛋白主要由3个α-螺旋、4个β-折叠和6个多肽结合位点组成;成功表达出GABARAP蛋白,分子质量为35 ku,经Western blotting验证了GABARAP蛋白的特异性。本研究为进一步探索中华蜜蜂GABARAP蛋白的结构功能提供了基础材料,为开展中华蜜蜂GABARAP蛋白参与自噬的研究奠定了基础。
