安徽省三个‘黄山白茶’特异品种(系)的分子指纹图谱构建
2022-02-14华冰清管鹏鹏桂利权沈周高张爱嘉陶玲玲朱俊彦韦朝领刘升锐
华冰清,管鹏鹏,桂利权,沈周高,张爱嘉,陶玲玲,朱俊彦,韦朝领,刘升锐*
安徽省三个‘黄山白茶’特异品种(系)的分子指纹图谱构建
华冰清1,管鹏鹏1,桂利权2,沈周高1,张爱嘉1,陶玲玲1,朱俊彦1,韦朝领1,刘升锐1*
(1.安徽农业大学茶树生物学与资源利用国家重点实验室、农业农村部茶树生物学与茶叶加工重点实验室,安徽合肥 230036;2.谢裕大茶叶股份有限公司,安徽合肥 230036)
本研究筛选了6个多态性高且稳定性好的SSR标记作为一个核心标记组,对‘黄山白茶’三个特异茶树品种(系)及其余43份茶树品种(系)进行基因分型,根据扩增条带的大小构建了三个‘黄山白茶’特异品种(系)的分子指纹图谱。结果表明,6个标记扩增条带清晰,不同样品间具有较好的多态性,共扩增出等位基因数26个,平均为4.33;主效等位基因频率为0.283~0.370,均值为0.335;观测杂合度和期望杂合度均值分别为0.571和0.613;多态性信息含量为0.700~0.786,平均为0.740。根据等位基因片段大小分别构建了‘黄山白茶1号’品种、‘黄山白茶2号’品系和‘黄山白茶3号’品系的分子指纹图谱,为‘黄山白茶’种质资源鉴定、品种保护和推广利用提供重要理论依据。
黄山白茶;SSR标记;遗传多态性;分子指纹
我国茶树种质资源丰富多样,其中新梢叶色白化茶树品种是重要的特异资源,因其对气候因子敏感程度不同,可分为温度敏感型和光照敏感型[1]。‘黄山白茶’(‘Huangshan Baicha’)原产于安徽省歙县境内的新安江支流,因产地居古徽州府所辖,故又名‘徽州白茶’[2],属于温度敏感型白化茶树变种[3],其春茶芽叶呈玉白色,随着春季气温升高和芽叶变大,由叶片主脉、支脉、叶肉细胞依次返绿,叶色逐渐变成黄白色、黄绿色、浅绿色,夏秋茶则为绿色[3,4]。其制成的干茶色泽略显金黄、冲泡汤色明亮、香高持久、滋味鲜爽,游离氨基酸含量较高,且富含人体所需的硒、铁、锌等多种微量元素,兼具饮用与观赏价值,备受广大消费者青睐[4-6]。目前,通过短穗扦插繁育的无性系‘黄山白茶1号’品种(安徽省省级良种)、‘黄山白茶2号’品系和‘黄山白茶3号’品系已推广种植。现今,全国各地已选育出大量不同类型的白化茶树品种,仅通过传统的形态学鉴定难以区分,且对于温度敏感型白化茶树品种夏秋季返绿后与其它品种更加难以区分,为茶树资源保护和品种鉴别带来了一定的困难和挑战[7]。
分子标记技术是从DNA水平上对物种的遗传特性进行鉴定,鉴定结果准确、稳定、不受环境影响。SSR(Simple Sequence Repeat)分子标记具有共显性、稳定性好、多态性高、且基因组分布广泛等优点,是茶树遗传研究中最常用的分子标记技术之一[8,9]。目前,SSR分子标记已广泛应用于构建茶树品种分子指纹。如章志芳和马建强利用10个EST-SSR标记对14个茶树新品种进行了遗传多样性分析,并构建了各自特异的DNA分子指纹图谱[10];Tan等从30个标记中筛选了8个标记作为核心标记组,并构建了128份茶树品种的分子指纹图谱[11];Liu等从36个SSR标记中筛选了5个多态性高且稳定性好的SSR标记作为核心标记组,并构建了80个茶树品种(品系)的分子指纹图谱[12];阮旭等利用筛选的50对SSR标记对安徽省各个茶区共68份茶树品系进行遗传多样性分析,并选出8对核心标记组构建了其各自特异的分子指纹图谱[13];Guo等选用了6个SSR标记作为核心标记组,构建了126份广西茶树种质资源的分子指纹图谱[14]。
本研究以课题组先前开发的SSR标记为基础,进一步筛选了6个多态性高且稳定性好的SSR标记,将其作为核心标记组,对46份茶树品种(系)进行了快速的基因分型,构建了‘黄山白茶1号’‘黄山白茶2号’和‘黄山白茶3号’品种(系)特有的分子指纹图谱。研究结果为‘黄山白茶’特异茶树种质资源的鉴定、保护和利用提供了重要依据。
1 材料与方法
1.1 实验材料
三个‘黄山白茶’品种(系)及其余43份茶树品种(系)均来源于安徽农业大学皖中试验站的茶树生物学与资源利用国家重点实验室的茶树种质资源圃(31°25′N,117°09′E),取嫩叶后用干冰速冻,置于-80 ℃冰箱保存备用。样品名称及产地来源详见表1。
1.2 实验方法
1.2.1 DNA提取与检测
选用EZgene TMCPPlant Miniprep Kit (Biomiga, USA)试剂盒提取茶树样品基因组DNA。利用NanoDrop 2000紫外分光光度计和1%琼脂糖凝胶电泳检测DNA浓度和纯度,所有样品稀释至30~50 ng·μL-1用于PCR扩增实验。
首先对所有患牙进行完善的根管治疗后,再行牙周基础治疗,包括龈上洁治、龈下刮治及根面平整术等,必要时进行调。
1.2.3 PCR扩增及毛细管电泳检测
根据先前的研究,选取了6个多态性高、稳定性好的SSR标记作为核心标记组,并对46份供试茶树品种(系)进行扩增以构建‘黄山白茶’特异的分子指纹图谱。利用毛细管电泳检测PCR产物结果可知,6个标记对46份茶树品种(系)扩增条带清晰、片段大小在设计片段区间内、且均显示出较好的多态性(可参见图1)。
根据条带峰图进行人工方法读带,建立原始数据矩阵,并根据软件要求转换数据格式。利用POPGENE V1.32软件计算等位基因数(, number of alleles)和主效等位基因频率(, major allele frequency)。利用PowerMarker 3.25软件计算引物的观测杂合度(, Observed heterozygosity)、期望杂合度(, Expected heterozygosity)和多态性信息含量(PIC, polymorphism information content)。
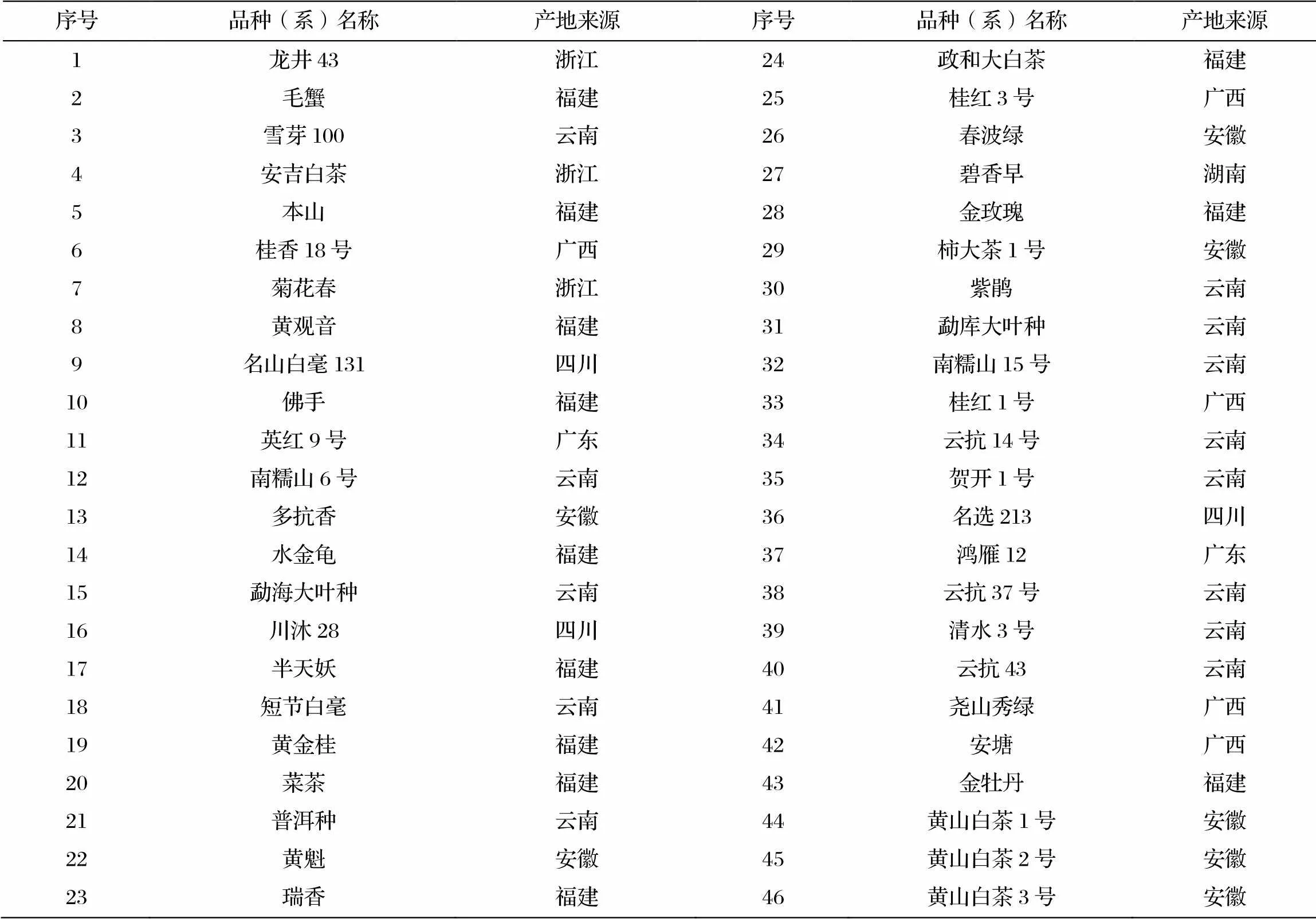
表1 选取的46份茶树品种(系)信息
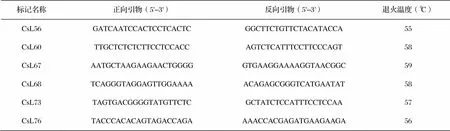
表2 六个标记的引物信息
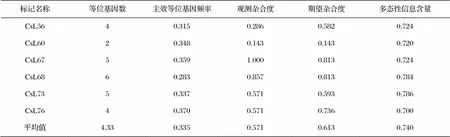
表3 六个标记对46份茶树品种扩增多态性分析

图1 六个标记对46份茶样扩增的毛细管电泳图

图2 三个‘黄山白茶’品种(系)的分子指纹图谱
田间初见玉米锈病病叶时,用20%三唑酮乳油900mL/hm2,或12.5%烯唑醇 (禾果利)450~600g/hm2对水喷雾防治,视病情酌情补治。玉米螟虫穗率达10%或花丝有虫50头/百穗时,先剪去穗顶花丝,再用4.5%高效氯氰菊酯乳油750~900mL/hm2对水喷玉米穗顶。
PCR反应体系、PCR扩增程序、毛细管电泳检测及条带分析参考相关文献[8,12]。
1.2.4数据整理与分析
“一带一路”项目建设中,金融发挥着十分重要的作用,金融不仅能够实现资源配置的优化,还可发挥杠杆作用,合理调节市场经济,在短期内快速聚集资金,为相关行业的发展奠定基础。但是,我国金融支持与合作还面临着很多的风险,这些均会影响金融支持与合作,使得金融行业内的不稳定因素增加,为“一带一路”项目建设金融支持与合作带来较大的风险与挑战。
从本课题组先前开发的SSR标记中选取6对SSR引物[8],序列由上海通用生物有限公司合成,引物序列及退火温度详见表2。
2 结果与分析
2.1 毛细管电泳检测扩增产物
1.2.2引物选择与合成
2.2 标记多态性分析
对检测的6个标记进行多态性分析(可参见表3)。结果显示,共检测到26个等位位点数,平均为4.33个;主效等位基因频率值在0.283(CsL68)至0.370(CsL76)之间,平均为0.335;观测杂合度从最低的0.143(CsL60)至最高的1.000(CsL67),平均为0.571;期望杂合度在0.143(CsL60)至0.813(CsL67和CsL68)之间,平均值为0.613;多态性信息含量(PIC)在0.700(CsL76)至0.786(CsL73)之间,平均为0.740。PIC值是衡量位点多态性的最重要的指标,当PIC>0.5时为高度多态位点,当0.25 毛细管电泳检测可以清晰的显示每个样品扩增条带的大小。为了更加直观地呈现结果,6个标记CsL56、CsL60 CsL67、CsL68、CsL73和CsL76分别用A、B、C、D、E和F替代。通过标记结合扩增条带大小的方式,编码每个品种(系)的指纹图谱。此外,分子指纹代码结合品种(系)名称、种质类型、亚种分类、选育地区等信息,构建每个品种(系)的特异分子指纹图谱,详见图2。 建立参数化模型,关键是能明确表达模型结构的参数变量以及它们之间的关系。压铆连接结构参数变量如表1所示,压铆连接模型的结构示意图如图1所示。 从区域分布上看,内蒙古地区“草原丝绸之路”可分为西部段和东部段两部分。西部段以呼和浩特、乌兰察布、包头、鄂尔多斯为重要支点,向西经宁夏、青海与新疆丝绸之路相连;东部段由呼伦贝尔、通辽、赤峰等重要节点城市为依托,连接着俄罗斯、蒙古国,是通往欧洲丝绸之路的重要通道。 分子标记广泛应用于茶树进化起源研究、遗传多样性分析、种质资源鉴定、基因定位、分子指纹图谱构建等方面,具有重要作用[7,8]。基于DNA分子标记构建指纹图谱,可以快速、准确的对植物新品种(系)及杂交后代等进行真伪鉴定,并且具有很强的个体特异性[10,11]。分子指纹可以进行品种真实性的鉴别从而保护品种权所有者的合法权益,也可以鉴定已知种质与新种质资源的区别,便于育种工作者进行遗传研究[13,15]。 本研究筛选了6个多态性高且稳定性好的SSR标记作为一个核心标记组,利用高通量、高分辨率的毛细管电泳技术进行鉴定,分析了6个标记的遗传多态性。结果表明,标记平均等位基因数、平均主效等位基因数和平均多态性信息含量分别为4.33、0.335和0.740,总体上各指标均较高。标记多态性的核心指标PIC值显著高于先前的研究结果[9,16],但与另外几个研究结果值差别不大[11,13,14],主要是由于这些指标受多种因素的影响,如SSR标记数目、SSR标记的重复基序次数和类型、样本数量和遗传背景差异大小、电泳检测方法等[8,12]。此外,利用筛选的核心标记组成功构建了三个‘黄山白茶’特异品种(系)的分子指纹图谱,为‘黄山白茶’特异种质资源鉴定、品种保护和推广利用奠定了坚实基础。 [1] 刘丁丁,梅菊芬,王君雅,等.茶树白化突变研究进展[J].中国茶叶,2020,42(04):24-35. [2] 毕军生.徽州白茶保护与开发[J].茶业通报,2003,25(03):109. [3] 周汉琛,刘亚芹,雷攀登.不同白化期的‘黄山白茶’代谢物差异分析[J].热带亚热带植物学报,2022,30 (02):187-194. [4] 沈周高,江稳华,方世辉.安徽歙县黄山白茶产业发展现状及对策思考[J].中国农学通报,2013,29(26):36-40. [5] 沈周高,周月琴,李叶云,等.黄山白茶短穗扦插快繁技术研究[J].茶业通报,2013,35(02):75-78. [6] 王龙平.宣城市白化、黄化品种茶产业发展现状及建议[J].茶业通报,2021,43(04):163-165. [7] 陈杰丹,马春雷,陈亮.我国茶树种质资源研究40年[J].中国茶叶,2019,41(06):1-5+46. [8] LIU S R, AN Y L, LI F D, et al. Genome-wide identification of simple sequence repeats and development of polymorphic SSR markers for genetic studies in tea plant ()[J]. Molecular Breeding, 2018, 38: 59. [9] 刘升锐,董心雨,郭锐,等.安徽省“太平猴魁”茶区柿大茶群体种遗传多样性的SSR分析[J].安徽农业大学学报,2020,47(04):499-504. [10] 章志芳,马建强.基于SSR标记的茶树新品种遗传多样性分析及指纹图谱构建[J].湖南农业科学,2012,19:1-4. [11] TAN L Q, PENG M, XU L Y, et al. Fingerprinting 128 Chinese clonal tea cultivars using SSR markers provides new insights into their pedigree relationships[J]. Tree Genetics & Genomes, 2015, 11: 90. [12] LIU S R, LIU H W, WU A L, et al. Construction of fingerprinting for tea plant () accessions using new genomic SSR markers[J]. Molecular Breeding, 2017,37: 93. [13] 阮旭,徐奕鼎,吴琼,等.安徽省各茶区茶树品系遗传多样性分析及指纹图谱构建[J].分子植物育种,2020,18(14):4692-4701. [14] GUO R, XIA X B, CHEN J, et al. Genetic relationship analysis and molecular fingerprint identification of the tea germplasms from Guangxi Province,China[J]. Breeding Science, 2021, 71: 584-593. [15] 张成才,刘园,姜燕华,等.SSR标记鉴定浙江省主要无性系茶树品种的研究[J].植物遗传资源学报,2014,15(05):926-931. [16] 王松琳,马春雷,黄丹娟,等.基于SSR标记的白化和黄化茶树品种遗传多样性分析及指纹图谱构建[J].茶叶科学,2018,38(01):58-68. S571.1 A 1006-5768(2022)04-174-05 2022-08-05 安徽农业大学校级大学生创新训练项目(XJDC2020015)和安徽省科技重大专项(202003a06020021) 华冰清(1992—),女,浙江省金华市人,茶学本科生,研究方向为茶树育种学,E-mail:1106805461@qq.com。 刘升锐(1985—),男,安徽省滁州市人,副教授,研究方向为茶树遗传与育种研究,E-mail:liushengrui@ahau.edu.cn。 投稿平台:https://cytb.cbpt.cnki.net (责任编辑:徐千懿)2.3 ‘黄山白茶’品种(系)分子指纹图谱构建
3 讨论与结论
