益气活血法通过抑制细胞焦亡减轻缺血性脑中风急性期大鼠脑组织炎症
2022-02-14江利敏刘向哲桑锋郭向东嵇朋
江利敏,刘向哲,桑锋,郭向东,嵇朋
[1.河南中医药大学第一附属医院体检中心,河南郑州450003;2.河南中医药大学第一附属医院脑病一区,河南郑州450003;3.河南中医药大学第一附属医院重点实验室,河南郑州450003;4.河南中医药大学第一附属医院耳鼻喉科,河南郑州450003;5.郑州市第三人民医院(河南大学肿瘤医院)神经内科三病区,河南郑州450003]
缺血性脑中风(脑卒中)是指脑组织局部供血障碍引起的缺血性坏死,可导致神经元损伤、神经系统功能失调,50%以上患者存在后遗症,对公共健康的危害性极高,目前在世界人口死亡原因中居第2位[1]。缺血性脑中风在《内经》中早有相关记载。《素问·经脉篇》中的“气绝则脉不通,脉不通则血不流”是对其气虚血瘀病机的早期认知。清代医者王清任专门以气虚血瘀立说,创制的补阳还五汤开创了中医用益气活血法治疗脑中风的先河。近代医者张锡纯进一步肯定了益气活血法在缺血性脑卒中急性期治疗中的价值[2]。中医现代研究也表明,缺血性脑卒中急性期的中医证候主要表现为气虚血瘀,常选择益气活血法[3-5]。
细胞焦亡是一种促炎性程序性细胞死亡方式,是机体重要的免疫防御反应,可破坏病原菌生长环境,在清除内源危险信号中发挥了重要的作用,但过度细胞焦亡可导致病理性炎症,诱发自身炎症。已有研究[6]表明,细胞焦亡参与了动脉粥样硬化、神经系统疾病等的发生与发展,而缺血性脑卒中损伤与脑组织炎症密切相关,因此,适度抗炎治疗有助于该病治疗。故本研究开展此次动物实验,旨在基于细胞焦亡探讨益气活血法对缺血性脑中风急性期大鼠脑组织炎症的治疗作用,以期为中医证治缺血性脑中风的研究提供新的依据,现将研究结果报道如下。
1 材料与方法
1.1 实验动物47只SPF级7周龄雄性SD大鼠,体质量260~270 g,购自上海南方模式生物科技股份有限公司,生产许可证号:SCXK(沪)2017-0010。实验开展前大鼠适应性饲养1周,自由摄食饮水,保持室温为(22±3)℃,相对湿度40%~60%,空气新鲜,自然光照,定期消毒笼具。
1.2 药物益气活血方由生黄芪30 g、益母草15 g、当归15 g、川芎9 g、全蝎9 g、石菖蒲9 g与冰片0.05 g(冲服)组成,中药材均购自河南康健医药药材股份有限公司,由河南中医药大学第一附属医院中药制剂室制备成汤剂。
1.3主要试剂与仪器2,3,5-氯化三苯基四氮唑(TTC)(南京森贝伽生物科技有限公司);苏木素染液、伊红染液(成都里来生物科技有限公司);白细胞介素1β(IL-1β)、白细胞介素18(IL-18)、肿瘤坏死因子α(TNF-α)酶联免疫吸附分析(ELISA)试剂盒(上海卡迈舒生物科技有限公司);兔抗大鼠嘌呤能受体P2X7(P2RX7)、半胱氨酸天冬氨酸蛋白酶-1(Caspase-1)、Caspase-11、消皮素D(GSDMD)等一抗(上海瑞齐生物科技有限公司);辣根过氧化物酶标记的山羊抗兔免疫球蛋白(IgG)二抗(上海碧云天生物技术有限公司)。A3型大脑中动脉闭塞(MCAO)栓线(北京西浓科技有限公司);BP211DAG电子天平(德国Sartorius公司);MK3全功能酶标仪(美国Thermo Fisher仪器有限公司);BA400Digital型数码三目摄像显微镜(麦克奥迪实业集团有限公司);Image-Pro Plus 6.0图像分析软件(美国Media Cybernetics公司)
1.4 分组、造模与干预47只SD大鼠留取9只作为假手术组,其余大鼠用线栓法建造缺血性脑中风急性期模型[7]。方法:用戊巴比妥钠麻醉大鼠,在颈正中纵向取2 cm长切口,暴露右侧颈总动脉、颈外动脉与颈内动脉,切断颈外动脉及其分支,阻断侧支循环血流。从颈外动脉残端经颈内动脉导入尼龙线,长度以颈内动脉、颈外动脉分叉处起18 mm至大脑前动脉起始处,造成大脑中动脉急性脑缺血,缝合颈部切口,切口外留1 cm丝线残端。参考Zea-Longa[8]的5级评分法评分:无神经损伤症状,计0分;无法完全伸展对侧前爪,计1分;向外侧转圈呈追尾状,计2分;爬行时向对侧倾倒,计3分;无法自发行走、丧失意识,计4分。1~3分表示造模成功。剔除死亡、造模后评分不达标的动物,共计30只造模成功。将30只模型大鼠随机分为模型组和中药低、高剂量组,每组10只。假手术组手术过程同造模大鼠,但不插入线栓阻断大脑中动脉。大鼠脑缺血24 h后灌胃给药:中药低、高剂量组分别对应给予益气活血方水煎液4.4、8.8 g(生药)/kg灌胃,模型组、假手术组给予等体积生理盐水灌胃,每天1次,连续给药15 d。
1.5 观察指标与方法
1.5.1 大鼠神经功能缺损程度评定造模后给药第3、7、15天,检查大鼠运动(异常动作、肌肉状态),感觉(触觉、视觉、本体感觉),反射情况,通过感觉、运动、平衡木实验以及不正常运动、反射丧失表现,进行神经功能缺损评分(mNSS)[9]。
1.5.2 TTC染色法观察大鼠脑梗死情况给药15 d后,处死大鼠,取出大脑(部分脑组织用体积分数10%中性甲醛固定,留待下一步病理学检测)部分脑组织于-22℃冷冻0.5 h,从前到后切片(厚度为2 mm),置入TTC溶液中,37℃孵育1 h。TTC被线粒体过氧化氢酶还原,可见组织片皮质梗死区呈白色,正常脑组织呈红色,部分为白色到红色过渡区。显色完全后置入体积分数50%甲醛溶液中固定24 h。分离红色、白色组织后分别称质量。计算脑梗死率:脑梗死率(%)=梗死组织湿质量/全脑湿质量。
1.5.3 ELISA法检测大鼠脑组织匀浆中IL-1β、TNF-α、IL-18含量取冷冻脑组织250 mg,制备匀浆,离心取上清,按照IL-1β、TNF-α、IL-18 ELISA试剂盒说明书进行检测:①在酶标包被板上设置空白对照孔、标准品孔、待测样品孔,在标准品孔内加入50 μL标准品,待测样品孔先后加入40 μL样品稀释液、10 μL待测样品,轻轻摇晃混匀;②封板后置入37℃温箱中温育1 h;③取出酶标板洗涤;④每孔加50 μL酶标试剂,后面操作步骤同①;⑤加入显色剂,摇匀后置入37℃温箱中避光显色15 min,取出酶标板加50 μL终止液;⑥应用酶标仪在450 nm波长处检测各孔光密度(OD)值,计算脑组织IL-1β、TNF-α、IL-18浓度(pg/mL)值。
1.5.4 HE染色法观察大鼠脑组织病理学表现取体积分数10%中性甲醛溶液固定的脑组织,脱水、透明、石蜡包埋,制作4 μm厚的切片。切片脱蜡复水,苏木素染色20 min,盐酸酒精分化10 s,50℃温水返蓝,置入85%酒精5 min,伊红染色5 min,水洗5 s,梯度酒精脱水,二甲苯透明,中性树胶封片。镜下观察脑组织病理学变化情况。
1.5.5 蛋白免疫印迹(Western Blot)法检测大鼠脑缺血半暗带组织P2RX7、Caspase-1、Caspase-11、GSDMD表达取冷冻脑组织100 mg,加入放射免疫沉淀分析(RIPA)裂解液,冰上裂解10 min,离心取上清,二喹啉甲酸(BCA)法测定蛋白浓度。加上样缓冲液,沸水浴变性,10%聚丙烯酰胺凝胶电泳,分离目的蛋白,转印聚偏氟乙烯(PVDF)膜,50 g/L脱脂奶粉封闭1.5 h。取PVDF膜分别置入P2RX7(1∶100)、Caspase-1(1∶1 000)、Caspase-11(1∶1 000)、GSDMD(1∶500)、β-actin(1∶5 000)一抗稀释液中,摇床上轻摇,4℃孵育过夜。洗膜,将PVDF膜放入辣根过氧化物酶标记的羊抗兔IgG二抗(1∶5 000)稀释液中,摇床轻摇,室温孵育3 h后洗膜。将PVDF膜平铺到保鲜膜上,滴加电化学发光液(ECL)显色,放入化学发光凝胶成像仪暗室内曝光。分析目的蛋白相对表达量,目的蛋白相对表达量=目的蛋白积分OD值/β-actin积分OD值。
1.6 统计方法采用SPSS 22.0统计软件进行数据分析,大鼠神经功能缺损评分、脑梗死率、炎症因子水平及蛋白相对表达量等计量资料以均数±标准差(±s)表示,多组比较采用单因素方差分析,进一步两两比较采用LSD-t分析,以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠神经功能缺损评分变化比较见图1。模型组,中药低、高剂量组大鼠神经功能缺损评分呈时间依赖性:模型组逐渐升高,中药低、高剂量组逐渐降低,假手术组无变化。在造模给药第3、7、15天,与假手术组比较,模型组,中药低、高剂量组大鼠神经功能缺损评分较高(P<0.05);与模型组比较,中药低、高剂量组大鼠神经功能缺损评分较低(P<0.05);与中药低剂量组比较,中药高剂量组大鼠神经功能缺损评分较低(P<0.05)。
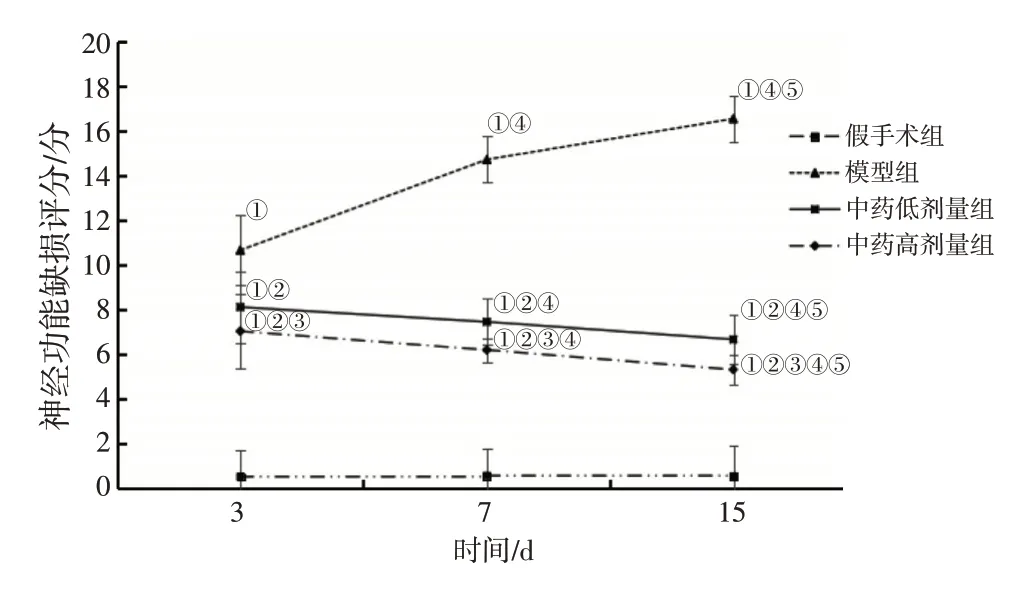
图1 各组大鼠神经功能评分变化比较Figure 1 Comparison of changes in neurological function scores of rats in various groups
2.2 各组大鼠脑梗死情况比较与假手术组比较,模型组,中药低、高剂量组大鼠脑梗死率较高(P<0.05);与模型组比较,中药低、高剂量组大鼠脑梗死率较低(P<0.05);与中药低剂量组比较,中药高剂量组大鼠脑梗死率较低(P<0.05)。具体结果见图2。
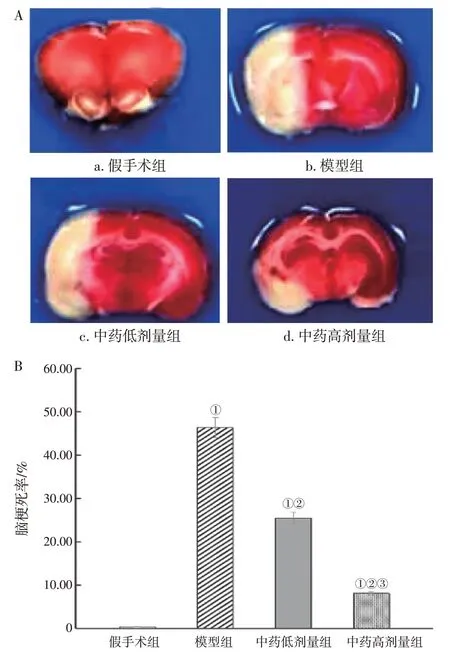
图2 各组大鼠脑梗死情况比较Figure 2 Comparison of cerebral infarction in rats of various groups
2.3 各组大鼠脑组织IL-1β、TNF-α、IL-18水平比较与假手术组比较,模型组,中药低、高剂量组大鼠脑组织中IL-1β、TNF-α、IL-18水平较高(P<0.05);与模型组比较,中药低、高剂量组IL-1β、TNF-α、IL-18水平较低(P<0.05);与中药低剂量组比较,中药高剂量组大鼠IL-1β、TNF-α、IL-18水平较低(P<0.05)。具体结果见图3。
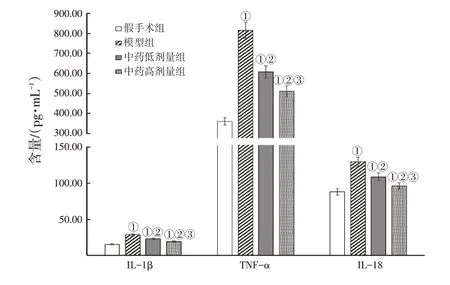
图3 各组大鼠脑组织IL-1β、TNF-α、IL-18水平比较Figure 3 Comparison of levels of IL-1β,TNF-α and IL-18 in rat brain tissue of various groups
2.4 各组大鼠脑组织病理学表现比较假手术组大鼠脑皮质结构完整、清晰,脑膜未见炎症渗出、水肿、充血,细胞层排列整齐,神经元形态正常;模型组大鼠脑组织大面积炎症渗出,水肿明显,细胞崩解,神经元空泡变性或呈点状坏死;中药低、高剂量组脑组织炎症渗出、水肿较模型组明显减轻,细胞形态、神经元空泡变性较模型组改善。具体结果见图4。
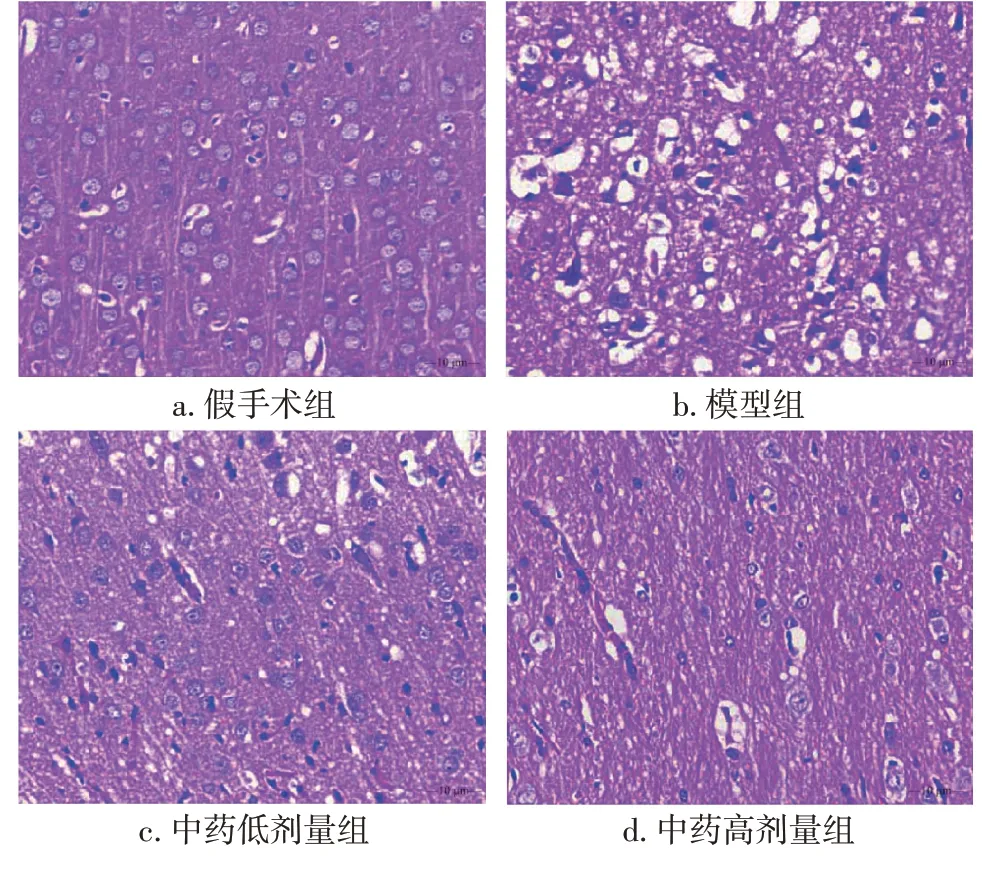
图4 各组大鼠脑组织病理学表现比较(HE染色,×400)Figure 4 Comparison of brain histopathological features of rats in various groups(by HE staining,×400)
2.5 各组大鼠脑缺血半暗带组织P2RX7、Caspase-1、Caspase-11、GSDMD蛋白表达水平比较与假手术组比较,模型组,中药低、高剂量组大鼠脑缺血半暗带组织P2RX7、Caspase-1、Caspase-11、GSDMD蛋白相对表达量较高(P<0.05);与模型组比较,中药低、高剂量组P2RX7、Caspase-1、Caspase-11、GSDMD蛋白相对表达量较低(P<0.05);与中药低剂量组比较,中药高剂量组P2RX7、Caspase-1、Caspase-11、GSDMD蛋白相对表达量较低(P<0.05)。具体结果见图5。
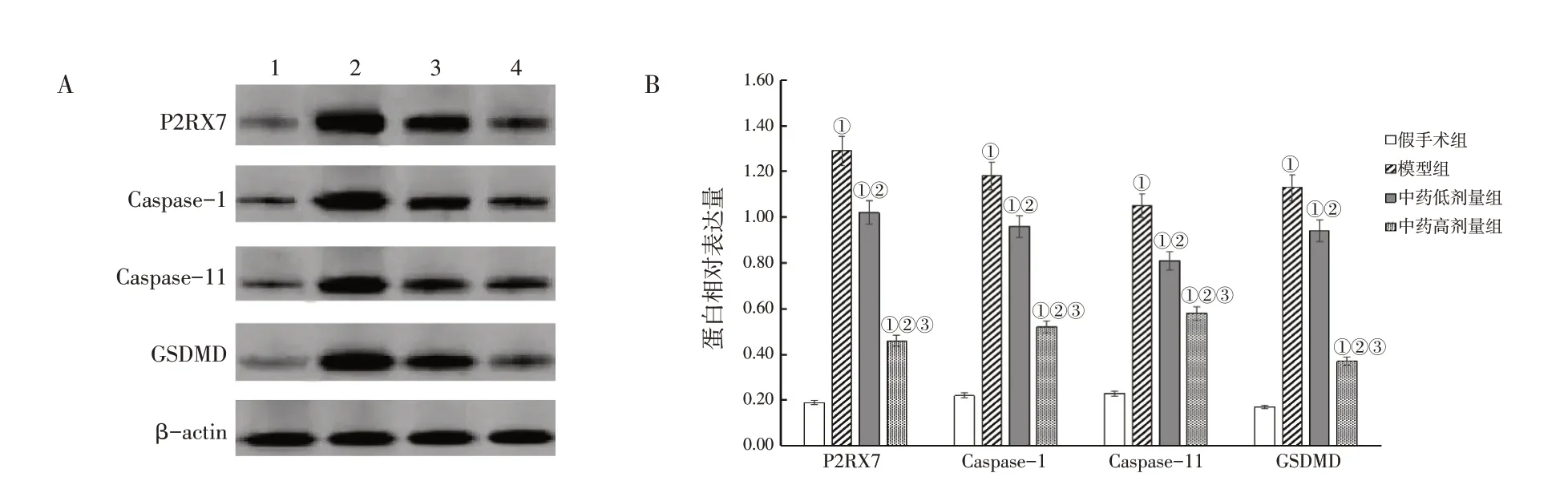
图5 各组大鼠脑缺血半暗带组织P2RX7、Caspase-1、Caspase-11、GSDMD蛋白表达比较Figure 5 Comparison of protein expression of P2RX7,Caspase-1,Caspase-11 and GSDMD of rat cerebral ischemia penumbra tissue in various groups
3 讨论
缺血性脑中风归属于中医学“中风”的范畴,主要病机为气虚血瘀,其中气虚为发病根源,血瘀为病邪核心[10]。因血脉瘀阻、气血不畅,血外渗为水,水停聚为痰,痰瘀水搏结于脑内,最终壅滞脑窍。益气,气行可化脉中瘀阻,气旺可助新血生化,可“治本”;活血,血活则瘀祛脉通,新血得生,可“治标”。益气、活血同治,则活血而不伤正,故中医学以益气活血法为缺血性脑中风急性期的主要治则。本研究中的益气活血方源自临床,由当归、黄芪、川芎、全蝎、益母草、石菖蒲、冰片构成。黄芪为“补气圣药”,可助血脉运行,气足则血生,为君药;当归、川芎、益母草可化瘀活血,共为臣药;全蝎可助川芎、当归通络活血,冰片、石菖蒲开痰涤窍,为佐使。全方共奏益气活血、通络涤痰之功,已在临床上取得可喜成果[11]。现阶段,神经保护剂相关研究日益深入,但中医药作为神经保护剂治疗脑中风的研究较少,故本研究通过动物实验,分析益气活血方在保护缺血性脑中风急性期大鼠神经功能以及消除脑组织炎症方面的作用。本研究结果显示,与模型组比较,中药低、高剂量组大鼠神经功能缺损评分较低,且随着给药时间延长而下降,脑梗死率也较低,提示益气活血方用于治疗缺血性脑卒中急性期,可改善神经功能缺损、减轻脑梗死。韦克克等[12]亦报道益气活血法可多途径、多靶点、多组分、多环节地保护脑缺血再灌注后神经元,从而缩小脑梗死体积,减轻神经功能损伤。
有研究[13-14]报道,炎症加重了缺血性脑卒中模型的脑损伤。炎症反应是一个复杂过程,大脑发生缺血性卒中后,中性粒细胞聚集、迁移至大脑缺血区域,可造成脑组织损伤,且缺血时被激活的细胞释放出IL-1β、TNF-α、IL-18等细胞因子,产生炎症级联反应,从而进一步加重脑缺血损伤,因此,抗炎是缺血性脑中风急性期治疗的关键环节。经现代药理学研究[15]发现,黄芪、当归、川芎、石菖蒲等均有抗炎作用。本研究结果显示,中药低、高剂量组大鼠脑组织IL-1β、TNF-α、IL-18水平均低于模型组;HE染色观察大鼠脑皮质病理学结果发现,模型组大鼠脑组织大面积炎症渗出,水肿明显,细胞崩解,神经元空泡变性或呈点状坏死,而中药低、高剂量组的脑组织炎症渗出、水肿、细胞形态与神经元坏死等情况均改善,提示益气活血方可降低缺血性脑中风急性期大鼠脑组织炎症相关因子表达,减轻缺血皮质区域炎症反应与病理损伤程度,保护神经元。
细胞焦亡为促炎性程序性细胞死亡,具有细胞肿胀、崩解、炎症因子渗出等特征,其过程包括Caspase-1依赖的经典途径、Caspase-11介导的非经典途径。Caspase-1活化后可介导IL-1β、IL-18前体崩解,将其转化为成熟的炎性细胞因子,最终形成“瀑布效应”,导致剧烈炎症反应发生。有研究表明,IL-18在Caspase-1表达上调时被激活,吸引白细胞向病灶聚集,因此,细胞焦亡过程即炎症反应过程,细胞焦亡程度可在一定情况下反映炎症进展,二者互相促进[16]。Caspase-11是Caspase-1亚家族成员,可能不直接激活Caspase-1底物IL-18、IL-1β,但可增强Caspase-1活化,与Caspase-1前体一起表达时,释放的IL-1β含量明显增多。GSDMD为促炎性Caspase主要基质与细胞焦亡执行蛋白,在脑中风病理生理学中对程序性细胞坏死具有重要作用。在细胞焦亡机制中,炎症反应可激活P2RX7受体蛋白表达,导致大量钾离子外流,使NOD样受体蛋白3、凋亡相关斑点样蛋白组成炎性体,募集Caspase-1,促进IL-1β等炎症细胞因子成熟、释放[17]。本研究结果显示,中药低、高剂量组P2RX7、Caspase-1、Caspase-11、GSDMD相对表达量低于模型组,提示益气活血方可能通过抑制细胞焦亡改善缺血性脑中风急性期大鼠脑组织炎症损伤。
综上所述,益气活血法可通过抑制细胞焦亡,减轻缺血性脑中风急性期大鼠脑组织炎症,达到脑保护的目的。
