化毒祛邪汤辅助CHOP化疗方案治疗非霍奇金淋巴瘤患者的疗效及其对血清sFas及FasL表达的影响
2022-02-14张红柏王硕闫晓婷李社改
张红柏,王硕,闫晓婷,李社改
(河北省退役军人总医院内一科,河北邢台054000)
非霍奇金淋巴瘤是一种起源于淋巴结和脾脏、胸腺等其他淋巴组织的恶性肿瘤,常原发于胃肠道,少数患者的中枢神经系统和皮肤等也存在病变,其发病率占胃肠道肿瘤发病率的2%~4%[1-2]。血清可溶性凋亡相关蛋白因子(sFas)为肿瘤坏死因子相关受体和神经生长因子受体家族成员,凋亡相关蛋白因子受体(FasL)为其特异性配体,是肿瘤坏死因子相关凋亡诱导受体,其与Fas特异性结合能诱导机体细胞凋亡过程。大量研究证实其异常表达与恶性肿瘤发生有关[3-4]。黄颖琦等[5]研究发现,非霍奇金淋巴瘤患者的血清sFas/FasL表达水平明显上升,认为该因子的表达水平对于该病的诊断有一定意义。该病临床治疗常采用手术联合放化疗方式。淋巴系统肿瘤常对化疗具有良好的反应性,故临床中大部分非霍奇金淋巴瘤患者需行化疗治疗。现常用的化疗方案为CHOP化疗方案,即采用环磷酰胺、表柔比星和长春新碱联合治疗。该化疗方案能有效破坏肿瘤细胞,抑制肿瘤细胞复制,但其对正常淋巴细胞亦具有杀伤作用,故化疗患者常表现免疫力下降,以及出现胸闷、局部疼痛、红肿等并发症[6-7]。化毒祛邪汤由多种补气活血中药熬制而成,具有补气活血、清热利湿、祛毒化瘀的功效,对于化疗患者能够有效恢复其气血,但对非霍奇金淋巴瘤化疗患者是否具有积极的辅助作用尚存疑问[8-9]。因此,本研究主要观察化毒祛邪汤辅助CHOP化疗方案治疗非霍奇金淋巴瘤患者的疗效及其对血清sFas及FasL表达的影响。现将研究结果报道如下。
1 对象与方法
1.1 研究对象及分组选取2016年5月至2019年5月河北省退役军人总医院收治的经病理组织学确诊的非霍奇金淋巴瘤患者,共120例。根据就诊先后顺序,采用随机数字表将患者随机分为观察组和对照组,每组各60例。2组患者入院后均行CHOP化疗方案治疗,观察组患者在此基础上加用化毒祛邪汤辅助治疗,28 d为1个治疗周期,共行4个周期治疗。本研究已获河北省退役军人总医院伦理委员会的审核批准,并且患者均签署了知情同意书。
1.2 病例选择标准
1.2.1 纳入标准①符合美国国家综合癌症网络(NCCN)指南中非霍奇金淋巴瘤的诊断标准[10];②能完成4个周期的中西医治疗(每个治疗周期为28 d);③同意参加本研究并签署了知情同意书的患者。
1.2.2 排除标准①肝肾功能不全的患者;②合并有血液系统、慢性呼吸系统及甲状腺功能疾病的患者;③合并有精神障碍性疾病的患者;④2个月内参加其他临床试验的患者;⑤依从性差,未按规定服用中药,或资料不全,影响疗效判定的患者。
1.3 干预方法
1.3.1 对照组给予CHOP化疗方案治疗。具体方案如下:化疗第1天予静脉推注环磷酰胺(CTX,江苏恒瑞医药有限公司生产,批准文号:国药准字H32020857)750 mg/m2,静脉推注盐酸表柔比星[EPI,辉瑞制药(无锡)有限公司生产,批准文号:国药准字H20000496]50 mg/m2,静脉推注长春新碱(VCR,海正辉瑞制药有限公司生产,批准文号:国药准字H20043326)1.4 mg/m2;化疗第1~5天,予泼尼松片(PDN,天津力生制药股份有限公司生产,批准文号:国药准字H12020123)口服,剂量为60 mg/m2。28 d为1个治疗周期,共进行4个治疗周期。
1.3.2 观察组在对照组的基础上加用化毒祛邪汤辅助治疗。化毒祛邪汤的方药组成:炒白术25 g,太子参20 g,当归15 g,水蛭12 g,生半夏10 g,生牡蛎10 g,茯苓15 g,薏苡仁15 g,陈皮10 g,蒲公英10 g,金银花10 g,白芍15 g,山茱萸10 g,柴胡6 g,紫草10 g,何首乌15 g,莪术5 g,乳香15 g,没药15 g,白花蛇舌草15 g,炙甘草6 g。上述中药均由河北省退役军人总医院中药房提供。每天1剂,常规煎取200 mL,于饭后1 h服用。28 d为1个治疗周期,共进行4个治疗周期。
1.4 观察指标
1.4.1 T淋巴细胞亚群比例测定分别于治疗前与治疗后抽取患者外周静脉血10 mL,使用流式细胞仪检测患者外周血T淋巴细胞亚群CD3+、CD4+、CD8+,并计算CD4+/CD8+比值。观察2组患者治疗前后T淋巴细胞亚群比例的变化情况。
1.4.2 血常规指标测定分别于治疗前与治疗后抽取患者外周静脉血10 mL,使用血常规分析仪监测患者外周血白细胞计数(WBC)、血小板计数(PLT)和血红蛋白(Hb)水平。观察2组患者治疗前后各项血常规指标的变化情况。
1.4.3 血清sFas及FasL表达水平测定分别于治疗前与治疗后抽取患者外周静脉血10 mL,离心后取上清液,用酶联免疫吸附法(ELISA)测定血清sFas及FasL水平。观察2组患者治疗前后血清sFas及FasL表达水平的变化情况。
1.4.4 不良反应发生情况观察2组患者治疗期间不良反应(恶心呕吐、转氨酶升高、骨髓抑制、胃肠道反应)发生例数,计算2组患者的不良反应发生率。
1.5 疗效评价标准
1.5.1 各项中医证候改善疗效评价标准参照《中药新药临床研究指导原则(试行)》[11],分别对患者治疗后胸闷、局部肿物、局部疼痛、大小便情况进行中医证候评分,根据各项中医证候积分治疗前后的变化情况评价中医证候改善疗效。证候积分减少率=(治疗前积分-治疗后积分)/治疗前积分×100%。显效:证候积分减少≥70%;有效:30%≤证候积分减少<70%;无效:证候积分减少<30%;总有效率=(显效例数+有效例数)/总病例数×100%。
1.5.2 临床疗效评价标准参考《血液病诊断及疗效标准》[12]对2组患者治疗后的临床疗效进行评价。完全缓解(CR):影像学检查病灶完全消失,淋巴结及肿块大小缩小至正常大小或缩小>75%;部分缓解(PR):6个最大淋巴结及肿物大小较治疗前缩小50%~75%;稳定(SD):肿物及淋巴结大小缩小或增大<50%;疾病进展(PD):任何淋巴结大小较治疗前增大>50%。总有效率=(CR+PR)/总病例数×100%。
1.6 统计方法采用SPSS 25.0统计软件进行数据的统计分析。计量资料用均数±标准差(±s)表示,治疗前后比较采用配对样本t检验,组间比较采用两独立样本t检验;计数资料用率或构成比表示,组间比较采用χ2检验。以P<0.05表示差异有统计学意义。
2 结果
2.1 2组患者基线资料比较观察组60例患者中,男38例,女22例;平均年龄(61.77±1.74)岁。对照组60例患者中,男36例,女24例;平均年龄(63.65±1.69)岁。2组患者的性别、年龄等基线资料比较,差异均无统计学意义(P>0.05),具有可比性。
2.2 2组患者治疗前后T淋巴细胞亚群占比情况比较表1结果显示:治疗前,2组患者的CD3+、CD4+、CD8+及CD4+/CD8+比较,差异均无统计学意义(P>0.05)。治疗后,2组患者的CD3+、CD4+、CD8+均较治疗前降低,而CD4+/CD8+观察组较治疗前升高,对照组较治疗前降低,差异均有统计学意义(P<0.01);组间比较,观察组患者的上述各项免疫指标均明显高于对照组,差异均有统计学意义(P<0.01)。
表1 2组非霍奇金淋巴瘤患者T淋巴细胞亚群占比情况比较Table 1 Comparison of the proportion of T lymphocyte subsets in the two groups of patients with NHL before and after the treatment (±s)
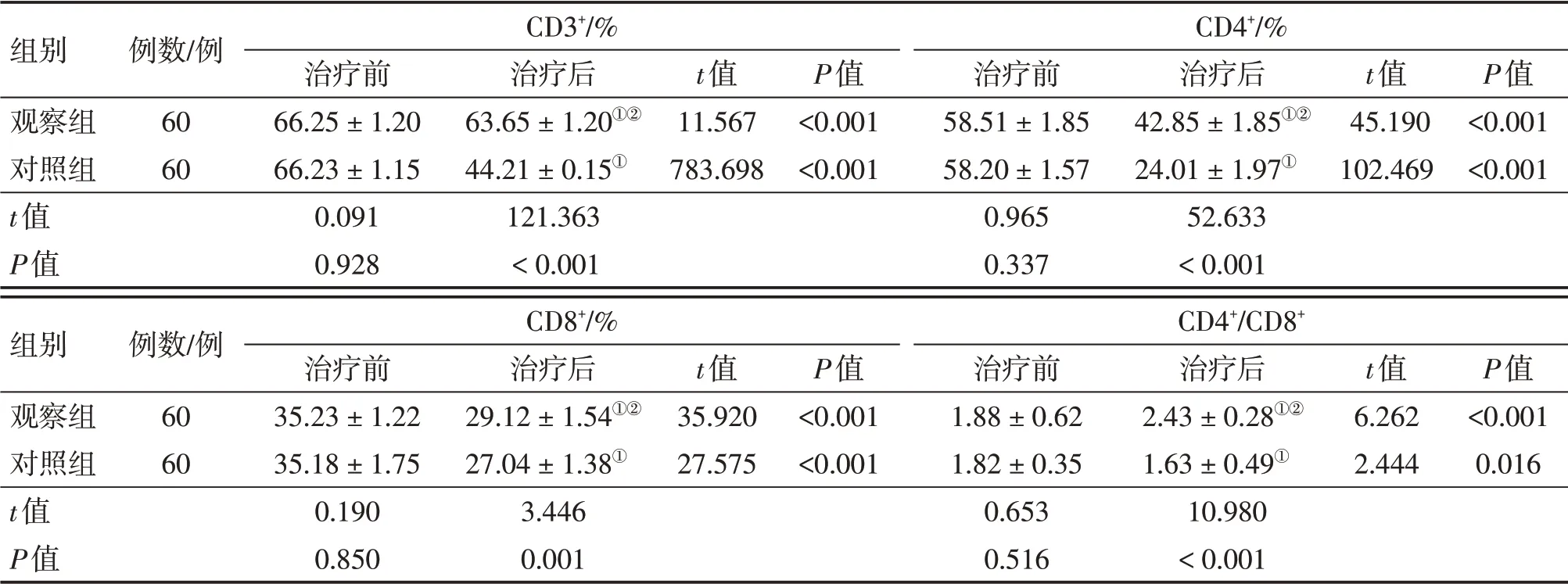
表1 2组非霍奇金淋巴瘤患者T淋巴细胞亚群占比情况比较Table 1 Comparison of the proportion of T lymphocyte subsets in the two groups of patients with NHL before and after the treatment (±s)
①P<0.01,与治疗前比较;②P<0.01,与对照组治疗后比较
组别观察组对照组t值P值例数/例60 60 CD3+/%治疗前66.25±1.20 66.23±1.15 0.091 0.928治疗后63.65±1.20①②44.21±0.15①121.363<0.001 t值11.567 783.698 P值<0.001<0.001 CD4+/%治疗前58.51±1.85 58.20±1.57 0.965 0.337治疗后42.85±1.85①②24.01±1.97①52.633<0.001 t值45.190 102.469 P值<0.001<0.001组别观察组对照组t值P值例数/例60 60 CD8+/%治疗前35.23±1.22 35.18±1.75 0.190 0.850治疗后29.12±1.54①②27.04±1.38①3.446 0.001 t值35.920 27.575 P值<0.001<0.001 CD4+/CD8+治疗前1.88±0.62 1.82±0.35 0.653 0.516治疗后2.43±0.28①②1.63±0.49①10.980<0.001 t值6.262 2.444 P值<0.001 0.016
2.3 2组患者治疗前后血常规指标比较表2结果显示:治疗前,2组患者的WBC、PLT和Hb水平比较,差异均无统计学意义(P>0.05)。治疗后,2组患者的WBC、PLT和Hb水平均较治疗前明显降低(P<0.01),但组间比较,观察组患者的上述血常规指标均明显高于对照组,差异均有统计学意义(P<0.01)。

表2 2组非霍奇金淋巴瘤患者治疗前后血常规指标比较Table 2 Comparison of the routine blood test indexes in the two groups of patients with NHL before and after the treatment
2.4 2组患者治疗前后血清sFas和FasL表达水平比较表3结果显示:治疗前,2组患者血清sFas和FasL表达水平比较,差异均无统计学意义(P>0.05)。治疗后,2组患者血清sFas和FasL表达水平均较治疗前明显降低(P<0.05或P<0.01),且观察组患者血清sFas和FasL表达水平均明显低于对照组,差异均有统计学意义(P<0.05或P<0.01)。
表3 2组非霍奇金淋巴瘤患者治疗前后血清sFas及FasL表达水平比较Table 3 Comparison of the expression levels of serum sFas and FasL in the two groups of patients with NHL before and after the treatment (±s)

表3 2组非霍奇金淋巴瘤患者治疗前后血清sFas及FasL表达水平比较Table 3 Comparison of the expression levels of serum sFas and FasL in the two groups of patients with NHL before and after the treatment (±s)
①P<0.05,②P<0.01,与治疗前比较;③P<0.05,④P<0.01,与对照组治疗后比较
组别观察组对照组t值P值例数/例60 60 FasL/(μg·L-1)治疗前0.81±0.34 0.84±0.54 0.355 0.723治疗后0.48±0.19②④0.65±0.17①5.034<0.001 t值6.397 2.534 P值<0.001 0.014 sFas/(μg·L-1)治疗前22.21±0.65 22.23±0.78 0.149 0.882治疗后11.47±0.24②③15.70±0.68②2.408 0.019 t值5.260 3.87 P值<0.001<0.001
2.5 2组患者治疗后临床疗效比较表4结果显示:治疗后,观察组的总有效率为66.7%(40/60),对照组为43.3%(26/60),组间比较,观察组的临床疗效明显优于对照组,差异有统计学意义(P<0.05)。
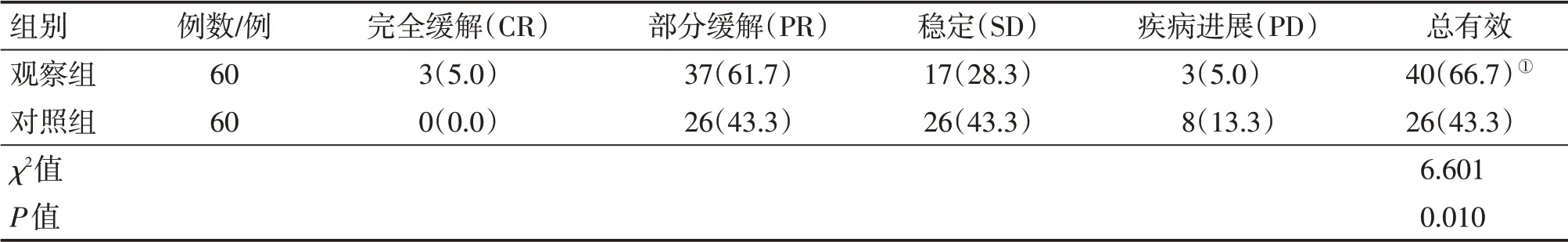
表4 2组非霍奇金淋巴瘤患者临床疗效比较Table 4 Comparison of the clinical effect in the two groups of patients with NHL [例(%)]
2.6 2组患者各项中医证候改善疗效比较表5结果显示:治疗后,观察组患者的胸闷、局部肿物、局部疼痛、小便赤短/大便干结等中医证候改善疗效均明显优于对照组,差异均有统计学意义(P<0.05)。

表5 2组非霍奇金淋巴瘤患者治疗后各项中医证候改善疗效比较Table 5 Comparison of curative effect on improving various TCM syndromes in the two groups of patients with NHL after treatment [例(%)]
2.7 2组患者不良反应发生情况治疗过程中,观察组患者共发生恶心呕吐18例,转氨酶升高患者15例,骨髓抑制患者5例,胃肠道反应患者27例;对照组患者发生恶心呕吐20例,转氨酶升高患者10例,骨髓抑制患者8例,胃肠道反应患者26例;2组患者的各项不良反应发生率比较,差异均无统计学意义(P>0.05)。
3 讨论
淋巴系统肿瘤根据其病理分型可分为霍奇金淋巴瘤与非霍奇金淋巴瘤两大类,其中非霍奇金淋巴瘤主要发生在淋巴结、脾脏、胸腺等淋巴器官,也可发生在淋巴结外的淋巴组织和器官的淋巴造血系统。非霍奇金淋巴瘤为我国常见造血系统恶性肿瘤,发病率位于所有恶性肿瘤前10位[13]。该疾病发生过程与大多数肿瘤细胞发生过程相似,均由肿瘤细胞异常增生、分化类型改变、肿瘤细胞凋亡异常3个基础步骤导致。sFas/FasL是细胞凋亡过程重要的相关因子,两者可于细胞表面特异性结合,通过呈递相关结构域蛋白,导致FADD蛋白聚集,FADD蛋白N端含有死亡效应结构域,可传递受体结合处凋亡信号,最终激活Caspase家族蛋白,完成凋亡过程[14-15]。非霍奇金淋巴瘤患者淋巴细胞恶性增殖广泛发生,细胞凋亡异常,因此,该类患者普遍存在sFas/FasL表达的异常升高,可将其作为非霍奇金淋巴瘤的诊断相关因子。
非霍奇金淋巴瘤属于中医“失荣”“石疽”“痰核”“恶核”等范畴。对于该病的治疗,CHOP是目前临床上常采用的化疗方案。中医学认为,化疗可损伤人体正气,致气机失调,肝郁气滞,阳虚寒痰瘀滞,导致患者阳虚气血不运而出现诸多并发症状[16]。既往研究[17]证明,采用中医药辅助CHOP化疗方案治疗非霍奇金淋巴瘤具有较好的增效减毒作用。
化毒祛邪汤由炒白术、太子参、当归、水蛭、生半夏、生牡蛎、茯苓、薏苡仁、陈皮、蒲公英、金银花、白芍、山茱萸、柴胡、紫草、何首乌、莪术、乳香、没药、白花蛇舌草、炙甘草等组成,方中炒白术有补脾益气、利尿消肿之功效,对化疗患者能起到调理气机、益气活血之作用,为君药;太子参、茯苓、薏苡仁等健脾祛湿,舒筋除痹,利湿而又不伤正气,为臣药;当归、水蛭、紫草、莪术、乳香、没药等活血祛瘀;生半夏、生牡蛎等化痰散结;蒲公英、金银花、白花蛇舌草等清热解毒;柴胡、白芍、何首乌、山茱萸等疏肝柔肝养肝,对淋巴系统肿瘤患者能起到很好的调理作用[18];陈皮行气止痛,共为佐药;炙甘草调和诸药,为使药;全方合用,共奏补气活血、清热利湿、祛毒化瘀之功效。
本研究结果显示:在疗效方面,观察组的临床疗效明显优于对照组(P<0.05);同时,观察组患者的胸闷、局部肿物、局部疼痛、小便赤短/大便干结等中医证候改善疗效也均明显优于对照组,差异均有统计学意义(P<0.05)。在T淋巴细胞亚群方面,治疗后,2组患者的CD3+、CD4+、CD8+均较治疗前降低,而CD4+/CD8+观察组较治疗前升高,对照组较治疗前降低,差异均有统计学意义(P<0.01);组间比较,观察组患者的上述各项免疫指标均明显高于对照组(P<0.01)。在血常规指标方面,治疗后,2组患者的白细胞计数(WBC)、血小板计数(PLT)和血红蛋白(Hb)水平均较治疗前明显降低(P<0.01),但组间比较,观察组患者的上述血常规指标均明显高于对照组(P<0.01)。在血清sFas和FasL表达方面,治疗后,2组患者血清sFas和FasL表达水平均较治疗前明显降低(P<0.05或P<0.01),且观察组患者血清sFas和FasL表达水平均明显低于对照组(P<0.05或P<0.01)。在不良反应方面,2组患者的恶心呕吐、转氨酶升高、骨髓抑制、胃肠道反应等各项不良反应发生率比较,差异均无统计学意义(P>0.05)。结果表明化毒祛邪汤辅助CHOP化疗方案治疗非霍奇金淋巴瘤较单纯化疗效果好,能有效改善患者T淋巴细胞亚群比例,降低患者血清可溶性凋亡相关蛋白因子(sFas)及凋亡相关蛋白因子受体(FasL)表达水平。
综上所述,采用化毒祛邪汤辅助CHOP化疗方案治疗非霍奇金淋巴瘤患者疗效确切,能有效改善患者T细胞亚群比例,降低患者血清sFas及FasL表达水平,其疗效优于单纯CHOP化疗。
