吉兰-巴雷综合征患者调节性B细胞与抑炎性细胞因子的水平分析
2022-02-13郭术俊华梦晴尹梅花宋传旺桑道乾
韩 雪,江 波,郭术俊,华梦晴,尹梅花,宋传旺,桑道乾
(蚌埠医学院 1.检验医学院免疫学教研室;2.第一附属医院神经内科;3.感染与免疫安徽省重点实验室;4.慢性疾病免疫学基础与临床安徽省重点实验室;5.检验医学院,安徽 蚌埠 233030)
吉兰-巴雷综合征(GBS)是急性多神经根病变的自身免疫病[1],以进行性肌无力为特征,最终导致呼吸衰竭[2]。调节性B细胞(Regulatory B cells,Bregs)是机体调节炎症等免疫学反应[3]的重要免疫调节细胞,人外周血中Bregs具有CD19+CD24hiCD38hi的表型[4]。Bregs是免疫抑制细胞,抑制过度炎症反应[5],通过产生IL-10、IL-35和TGF-β1等抑炎性细胞因子发挥作用[6-7]。
在系统性红斑狼疮、类风湿性关节炎等自身免疫病中,Bregs在数量和功能上均受损[8]。然而,Bregs和血清抑炎性细胞因子在GBS发病中的作用有待进一步明确。因此,本研究比较了40例新诊断的GBS患者与40例健康对照组的外周血Bregs、记忆性B细胞、浆细胞的数量和血清抑炎性细胞因子IL-10、IL-35、TGF-β1的水平。
1 材料和方法
1.1 病人和健康对照组本研究在蚌埠医学院第一附属医院进行GBS患者标本采集,标本采集时间为2019年11月至2021年1月。根据2019年中国GBS诊断标准进行GBS诊断。诊断标准如下:(1)多有前期感染史,起病急,进行性加重,多在4周内达到高峰;(2)严重GBS患者的四肢对称、延髓支配肌肉、面肌无力、呼吸肌无力;(3)可伴有感觉异常和自主神经功能障碍;(4)脑脊液中的蛋白质-细胞分离;(5)电生理检查提示周围神经脱髓鞘,如潜伏期延长、F波异常、传导阻滞、波形弥散异常等。
GBS患者和健康成年志愿者的纳入和排除标准如下:(1)为了避免因为免疫系统发育不成熟影响研究结果,本研究均选取年龄≥18岁的成年人为研究对象;(2)研究对象的性别根据临床患者性别情况及知情同意情况进行选取,健康对照组性别与GBS患者性别一致;(3)根据GBS起病急,进行性加重,多在4周内达到高峰的诊断标准,所有患者均为新确诊,参与研究时均处于GBS急性期;(4)由于药物治疗会影响研究结果,所有参与研究的GBS患者及健康对照组均未接受静脉注射免疫球蛋白治疗。
本研究对40名GBS患者(26名男性和14名女性)进行研究,同时以40名健康成年志愿者(26名男性和14名女性)作为健康对照组。两组研究对象均按照上述纳入和排除标准进行选择。本研究经蚌埠医学院伦理委员会批准,所有GBS患者都签署了知情同意书。
1.2 标本采集每名GBS患者和健康对照组人员采集5 mL外周静脉血,肝素抗凝。吸取1 mL外周静脉血用于流式细胞术实验(详见1.3)。剩余4 mL外周静脉血低速离心(1 847×g)10 min,分离血清用于检测IL-10、IL-35和TGF-β1含量。
1.3 B细胞亚型的数量检测全血与荧光抗体在4 ℃孵育30 min。所用荧光抗体分别为异硫氰酸荧光素(FITC)标记的抗CD24抗体、藻红蛋白(PE)标记的抗CD19抗体、PEcy5标记的抗CD27抗体和APC标记的抗CD38抗体(抗体均来自eBioscience, San Diego, CA, USA)。 然后用3 mL 0.83%氯化铵在22 ℃恒温水浴中裂解红细胞10 min,低速(1 847×g)离心5 min。弃上清液,用2 mL PBS 重悬细胞,再次低速(1 847×g)离心5 min,弃上清液后加入400 μLPBS。用流式细胞仪(BD FACSVerse; BD Biosciences, San Jose, CA, USA)检测CD19+B淋巴细胞,具体检测CD19+CD24hiCD38hiBregs、CD19+CD27+CD24hi记忆性B细胞和CD19+CD27hiCD38hi浆细胞的数量。
1.4 血清IL-10、IL-35和TGF-β1检测从GBS患者和健康对照组人员外周静脉血中分离的血清以500 μL/管进行分装,使用商品试剂盒(CUSABIO,中国湖北武汉)按照说明书进行IL-10、IL-35和TGF-β1的酶联免疫吸附检测,本实验采用定量酶免疫分析技术。所用商品试剂盒已将IL-10、IL-35和TGF-β1特异性抗体预包被于微孔板上。将标准品和血清样品移加入各孔中,包被的特异性固相化抗体结合血清标本中的IL-10、IL-35和TGF-β1。洗去所有未结合物质后,向孔中加入抗IL-10、IL-35和TGF-β1的生物素标记抗体。洗涤后,将亲和素结合的辣根过氧化物酶(HRP)加入各孔中。洗涤去除任何未结合的亲和素酶试剂后,向孔中加入底物溶液,显色颜色深浅与初始步骤中所结合的IL-10、IL-35和TGF-β1的量成正比。终止显色后,用酶标仪检测各孔450 nm处的吸光度值。
1.5 统计学分析采用SPSS 16.0软件对数据进行分析,计量数据以“均数±标准差”表示。组间结果采用t检验进行比较,P<0.05为有统计学意义。所有实验均独立重复3次。
2 结果
2.1 GBS患者外周血CD19+CD24hiCD38hiBregs占总B细胞的比例降低流式细胞术结果发现,与健康对照组相比,GBS患者外周血中CD19+CD24hiCD38hiBregs占总B细胞的比例显著降低(P<0.01,见图1)。GBS患者和健康对照组相比较,外周血CD19+CD27+CD24hi记忆性B细胞和CD19+CD27hiCD38hi浆细胞占外周血总B细胞的比例无显著差异(见图2和图3)。
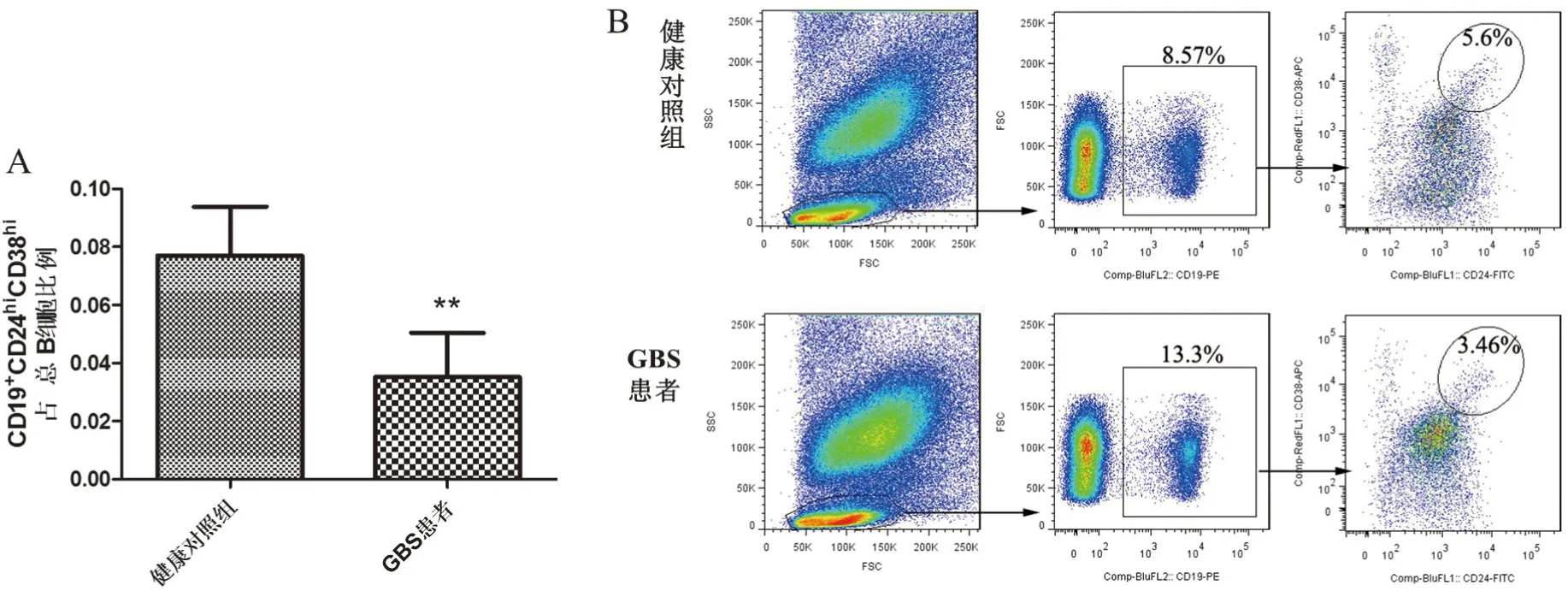
图1 GBS患者外周血CD19+CD24hiCD38hiBregs占总B细胞比例

图2 GBS患者外周血CD19+CD27+CD24hi记忆性B细胞占总B细胞比例
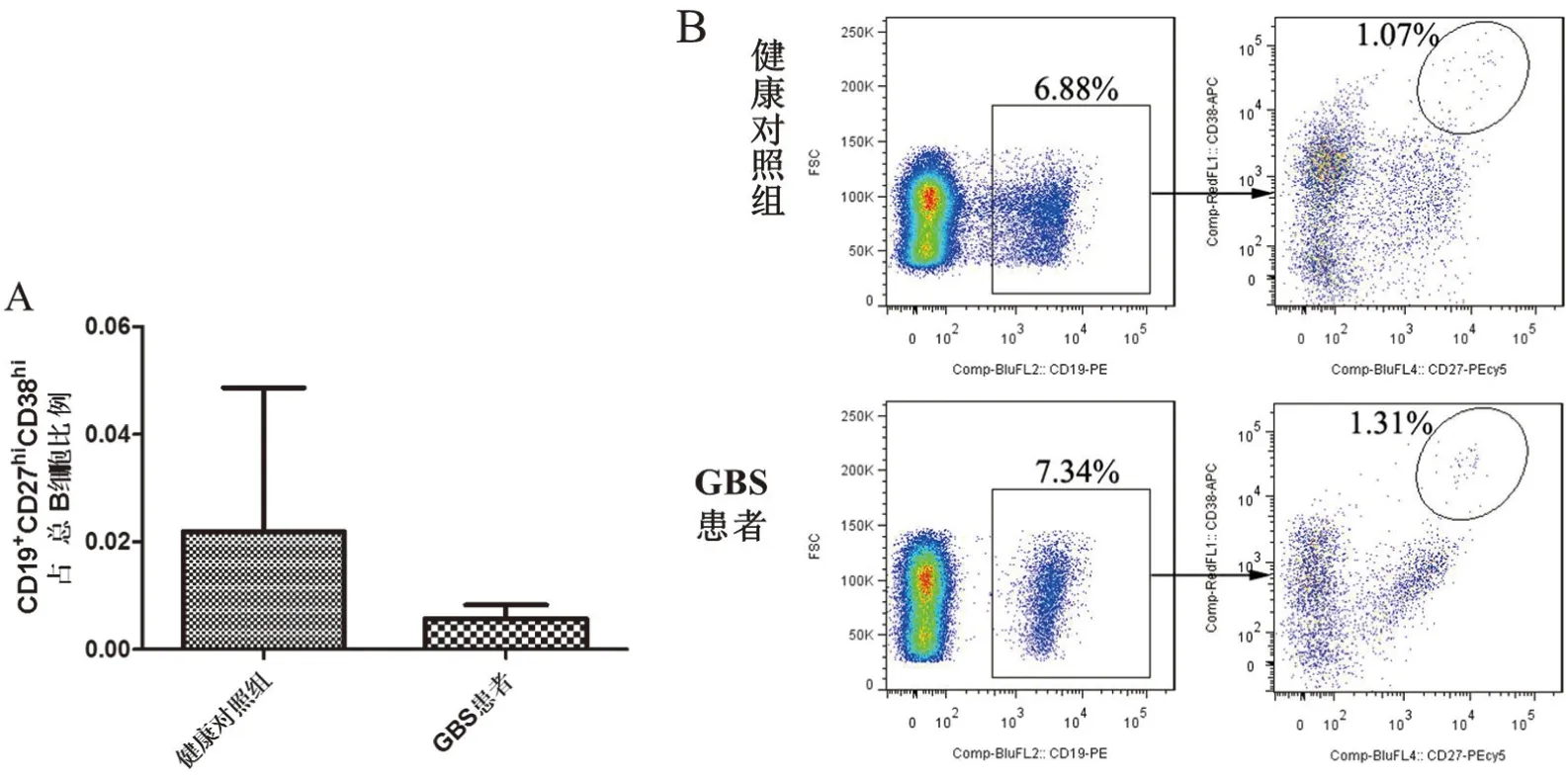
图3 GBS患者外周血CD19+CD27hiCD38hi浆细胞占总B细胞比例
2.2 GBS患者血清中IL-10、IL-35和TGF-β1水平升高与健康对照组相比,GBS患者血清中IL-10、IL-35和TGF-β1水平均升高(图4)。

图4 GBS患者血清IL-10、IL-35和TGF-β1的ELISA结果
3 讨论
在全球范围内,GBS是非脊髓灰质炎病毒急性弛缓性麻痹最常见的病因[9]。预先感染病原体通常是GBS的触发因素[10]。GBS的发病机制涉及分子模拟,一些病原体有类似于周围神经髓鞘和/或轴突表位的抗原。空肠弯曲杆菌、巨细胞病毒、Epstein-Barr病毒、肺炎支原体、流感嗜血杆菌、乙型肝炎病毒[11]、戊型肝炎病毒、SARS-CoV和MERS-CoV与GBS的发生有关。目前,在Zika病毒大流行和COVID-19大流行期间,GBS发病率有所上升[12]。
Bregs是实现自身免疫的关键参与者,是负向调节免疫的细胞。在自身免疫性疾病中,包括系统性红斑狼疮、类风湿性关节炎、多发性硬化症、免疫性血小板减少症和Graves病,CD19+CD24hiCD38hiBregs数量减少[8]。GBS是外周神经自身免疫性疾病,我们研究发现GBS患者外周血CD19+CD24hiCD38hiBregs占总B细胞的比例降低,这与上述研究[8]一致。
考虑到有研究表明记忆性B细胞和浆细胞在自身免疫性疾病的发病机制中发挥重要作用[13],我们同时也检测了外周血CD19+CD27+CD24hi记忆性B细胞和CD19+CD27hiCD38hi浆细胞占总B细胞的比例。本研究的创新点在于首次对GBS患者外周血CD19+CD27+CD24hi记忆性B细胞数量和CD19+CD27hiCD38hi浆细胞数量进行了分析,为阐明GBS疾病进展及发病机制提供部分依据。记忆性B细胞迅速分化为效应细胞,因此它们在自身免疫性疾病中的作用不容忽视。研究发现GBS患者外周血CD19+CD27+CD24hi记忆性B细胞数量与健康对照组相比无显著差异。缺乏差异可以反映GBS患者疾病处于早期阶段。如果抗体在疾病的发展中发挥重要作用,那么外周血的CD19+CD27hiCD38hi浆细胞的数量将与健康对照组不同。然而,我们发现在GBS患者和健康对照组中CD19+CD27hiCD38hi浆细胞的比例并没有显著差异,这表明抗体的功能可能在GBS发病机制中不占主导地位。
免疫应答的调节机制复杂,包括Bregs分泌的抑炎性细胞因子IL-10、IL-35和TGF-β1。因此,检测GBS患者血清中IL-10、IL-35和TGF-β1的水平对阐明GBS的发病机制具有重要意义。IL-10的分泌促进Bregs对自身抗原的耐受及其抗炎活性和对自身免疫反应的抑制[4,6],研究认为IL-35和TGF-β1也是免疫抑制/抗炎性细胞因子[7]。与这些观点不一致的是,我们发现与健康对照组相比,新发GBS患者血清中IL-10、IL-35和TGF-β1的表达却均升高。
调节性T细胞(regulatory T cells,Tregs)抑制B细胞的活化、增殖和分化[13]。在系统性红斑狼疮中,浆细胞样树突状细胞(plasmacytoi dsdendritic cells,pDCs)和Bregs之间存在异常反馈调节。狼疮动物模型中,骨髓源性抑制细胞(myeloids-derived suppressorc ells,MDSCs)作为一种免疫抑制细胞,通过诱导型一氧化氮合酶(nitric oxide synase,iNOS)发挥Bregs效应,从而抑制自身免疫反应。综上所述,Tregs、pDCs和MDSCs也可能参与了自身免疫性疾病GBS的发病。在自身免疫性疾病的发病机制中,T细胞和单核细胞也可能产生和释放IL-10、IL-35和TGF-β1[14]。据此分析,在自身免疫性疾病患者中,Bregs来源的抑炎性细胞因子可能仅占体内IL-10、IL-35和TGF-β1的一部分。本研究中,GBS患者外周血Bregs减少,而血清中IL-10、IL-35和TGF-β1的表达均增加。根据上述研究基础,我们推测可能是其他免疫调节性细胞(如Tregs、pDCs和MDSCs)对GBS患者血清中这些抑炎性细胞因子的分泌进行了代偿。因此,GBS患者外周血Bregs与其他免疫调节性细胞之间的关系有待进一步研究。
我们的研究发现,与健康对照组相比,GBS患者外周血CD19+CD24hiCD38hiBregs占总B细胞的比例降低,而外周血CD19+CD27+CD24hi记忆性B细胞和CD19+CD27hiCD38hi浆细胞占总B细胞的比例无显著差异。与健康对照组相比,GBS患者血清IL-10、IL-35和TGF-β1水平显著上调。
综上所述,Bregs在GBS中是重要的负性自身免疫调节细胞,这增加了我们对GBS发病机制的认识。本研究的重要意义在于,联合检测分析外周血中CD19+CD24hiCD38hiBregs占总B细胞比例以及血清中抑炎性细胞因子IL-10、IL-35和TGF-β1水平,可以作为揭示GBS临床特征及探讨发病机制的重要方法。
