基于超滤浓缩法和差速离心法制备细菌OMVs的方法探讨
2022-02-13陈光璋范芳芳梁坤鹏
陈光璋,范芳芳,梁坤鹏,韦 莉,3
(1.感染与免疫安徽省重点实验室;2.蚌埠医学院第二附属医院检验科;3.蚌埠医学院病原生物学教研室,安徽 蚌埠 233030)
蛋白质、多糖以及各种因子的分泌是重要的生命活动。在细菌和真菌等微生物中,这些过程大多与细胞外囊泡(extracellular vesicle,EV)有关[1-2]。EV是细胞主动分泌的具有磷脂双分子层结构、纳米到微米级大小的膜囊泡的统称[3]。革兰阴性菌EV起源于外膜,因此通常被称为外膜囊泡(out membrane vesicle,OMVs)[4]。最早被发现存在于大肠埃希菌(E.coli)的培养基中。早期,人们一直认为OMVs是细菌生长的代谢产物。然而越来越多的研究证实,它是原核细胞有目的产生的纳米结构,发挥类似于真核生物外泌体的功能,可作为媒介在细菌和宿主之间传递细胞表面组分、毒力因子和抗原等生物信息[5-6]。
OMVs的提取是研究其在细菌毒力、耐药以及细胞间通讯机制的基础。本实验以E.coli为实验对象,利用超滤浓缩法和差速离心法提取OMVs,旨在分析不同方法的提取效率并比较其优缺点以及对细胞存活率的影响,为建立高效的细菌OMVs制备方法提供实验依据。
1 材料与方法
1.1 材料
1.1.1 菌株 来自蚌埠医学院第二附属医院痰培养的E.coli,耐药表型为超广谱β-内酰胺酶阳性。
1.1.2 主要试剂和仪器 LB肉汤培养基(Solarbio,北京);1×PBS缓冲液(Solarbio,北京);BCA蛋白浓度定量试剂盒(碧云天生物技术有限公司,上海);100 KDa超滤离心管(Minipore,美国);超速离心管、超速离心机(BeckmanL-80XP,美国)和配套的70TI定角转子,HT-7700透射电镜(Hitachi,日本),ZetaVIEW纳米颗粒跟踪分析仪(PARTICLEMETRIX,德国),多功能酶标仪(Synerge II,美国Bio-Tex)。
1.2 实验方法
1.2.1 细菌培养及生长曲线的测定 冻存菌种接种于LB固体培养基,置37 ℃过夜活化、挑取单菌落转种到5 mL LB液体培养基中,在200 rpm的转速和37 ℃的温度下培养过夜。从过夜培养的E.coli试管中按照1∶100的比例接种到含有250 mL LB液体培养基的锥形瓶中,以200 rpm转速、37 ℃温度条件培养过夜。定时取样测定OD值,绘制生长曲线。
1.2.2 超滤浓缩法提取OMVs 细菌用LB液体培养基培养至OD 600为0.8时收集菌液,4 000×g,15 min;离心后取上清经0.22 μm无菌滤膜过滤除去细胞碎片等杂质,收集滤液,用截留分子量为100 KDa的超滤管离心浓缩(4 000×g、4 ℃、5 min),加PBS洗涤并重复此步骤重复2~3次,收集处于超滤管内的液体,约为原体积的1/10。将浓缩后的上清转移至无菌超速离心管,150 000×g,超速离心120 min,弃去上清,将沉淀重悬于400 μL PBS缓冲液中。
1.2.3 差速离心法提取OMVs 细菌用LB液体培养基培养至OD 600为0.8时收集菌液,4 000×g,15 min;离心后取上清经0.22 μm无菌滤膜过滤除菌,收集滤液转移至超速离心管,150 000×g,离心120 min,弃去上清,将沉淀重悬于足量的PBS缓冲液中;再次150 000×g,超速离心120 min,弃去上清,将沉淀重悬于400 μL PBS缓冲液中。
1.2.4 BCA蛋白定量 用BCA蛋白浓度测定试剂盒测定提取样品的蛋白质浓度。将试剂A与试剂B按体积比50∶1混合,配成BCA工作液。取5 mg/mL BSA蛋白标准溶液用PBS溶液配置至终浓度为1.0 mg/mL。用1×PBS缓冲液依照浓度梯度(0 μg/mL,25 μg/mL,125 μg/mL,250 μg/mL,500 μg/mL,750 μg/mL,1 000 μg/mL,1 500 μg/mL,2 000 μg/mL)配置BSA标准测定溶液,体积均为20 μL。将适当体积的待测样品移入微孔板中,并用PBS补足到20 μL,向微孔板中添加200 μLBCA工作液,混匀,37 ℃孵育30 min;测定A 562 nm处的吸光值;以不含BSA的样品的光吸收度作为空白对照。标准曲线以A562为横坐标,BSA含量为纵坐标,计算OMVs的蛋白浓度。以蛋白产率比每1010个细菌获得的蛋白量(μg)计算OMVs产率(OD 600所对应细菌量为2×109CFU/mL)。
1.2.5 透射电镜(transmission electron microscope,TEM)检测OMVs形态 取10 μL OMVs滴加于铜网上沉淀1 min,滤纸吸去浮液。随后醋酸双氧铀10 μL滴加于铜网上沉淀1 min,滤纸吸去浮液,常温静置数分钟,待干燥后透射电镜观察形态,检测成像。
1.2.6 纳米颗粒跟踪分析(Nanoparticle tracking analysis,NTA)技术检测OMVs粒径大小分布和浓度 将制备的OMVs悬液冰上放置,PBS稀释后涡旋震荡混匀,置样本池中,进行粒度测量,Zetasizer软件分析OMVs的直径范围。
1.2.7 RAW264.7细胞的复苏与传代 取出冻存于液氮中的RAW264.7细胞,于37 ℃水浴锅孵育,复温后吸取细胞悬液加入到含5 mL完全培养基(1%双抗、10%FBS、90%DMEM基础培养基)的离心管中离心弃上清液,用1 mL的完全培养基重悬细胞,接种于含完全培养基的细胞培养瓶中,置于37 ℃,5%CO2培养箱中培养,隔天换液。待细胞长到80%左右获取细胞,洗涤离心后用新鲜完全培养基重悬细胞,加入到含完全培养基的培养瓶中,置37 ℃,5%CO2培养箱中培养,隔天换液。
1.2.8 CCK8法测OMVs对RAW264.7细胞存活率的影响 调整细胞浓度至5×104/mL,按100 μL/孔加入96孔板培养过夜,分别于各孔中加入不种方法提取的终浓度100 μg/mL OMVs,同时设对照组;置5%CO2,37 ℃细胞培养箱培养24 h后,每孔加入10 μL CCK-8,轻轻混匀后继续培养2 h。在酶标免疫检测仪上以450 nm测定吸光度。细胞存活率(%)=[A(实验)-A(空白)]/[A(对照)-A(空白)]×100%。
1.3 统计学方法采用SPSS 21软件进行统计学分析,计量资料用“均数±标准差”表示,组间比较采用配对t检验,P<0.05差异有统计学意义。
2 结果
2.1 E.coli的生长曲线由E.coli的生长曲线(图1)可见OD600为0.8时细菌处于对数生长期,OMVs提取实验均采用此吸光度值的菌液操作。
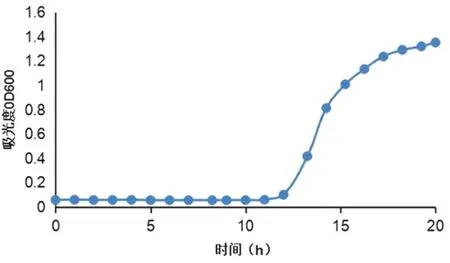
图1 E.coli生长曲线的测定
2.2 BCA法测定OMVs的蛋白浓度根据试剂盒提供的标准品绘制标准曲线,标准方程为:y=1010.4x-37.498,r2=0.9951。通过待测样品吸光度值计算出差速离心法和超滤浓缩法提取的OMVs产率,分别为(2.7±0.1)μg/1010CFU和(3.3±0.3)μg/1010CFU。超滤浓缩法提取的OMVs量明显高于差速离心法提取的OMVs的量(P<0.05)(图2)。


图2 OMVs蛋白浓度测定
2.3 负染电镜观察OMVs的形态通过TEM对提取的OMVs进行观察,结果发现:两种方法提取的OMVs均为脂质双分子层、大小不等的球状囊泡结构,背景干净,形态典型(图3)。
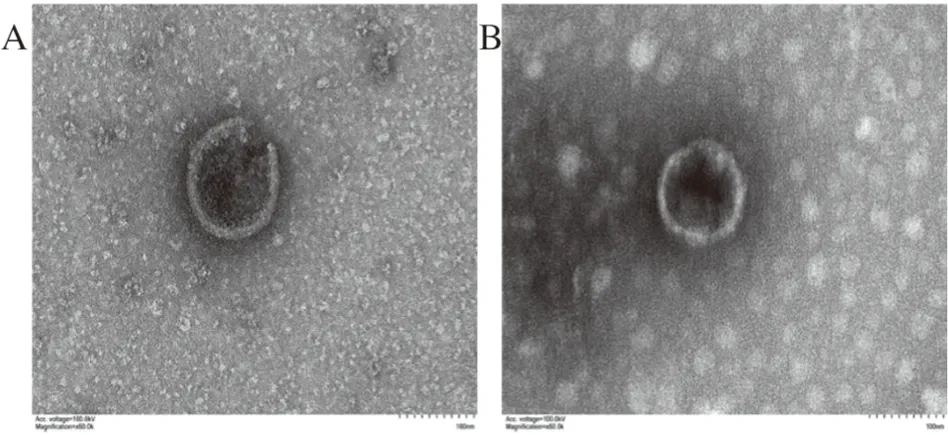
图3 OMVs电镜下形态结构观察
2.4 OMVs粒径分布与浓度检测结果显示:差速离心法提取的OMVs粒径峰值169.5 nm,平均粒径(186.0±112.8)nm,主要分布在47.5~367.5 nm之间,直径<247.5 nm囊泡数量占总量(82.3±4.6)%;超滤浓缩法提取的OMVs粒径峰值144.8 nm,平均粒径(170.6±71.7)nm,主要分布在77.5~327.5 nm之间,直径<247.5 nm囊泡数量占总量(88.8±3.7)%(图4,表1、2)。相对于差速离心法,超滤浓缩法提取的直径<247.5 nm的囊泡法所占百分比更高(P<0.05)(图5)。
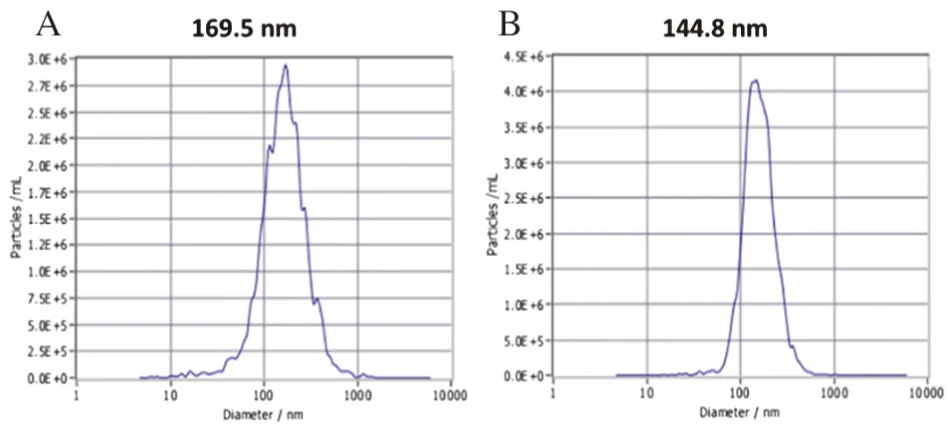
图4 NTA检测OMVs粒径分布察
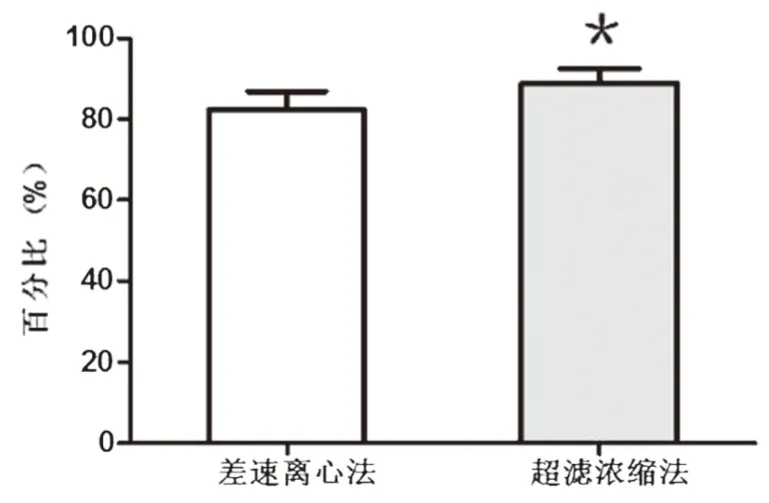
图5 小于247.5 nm的囊泡数量所占百分比
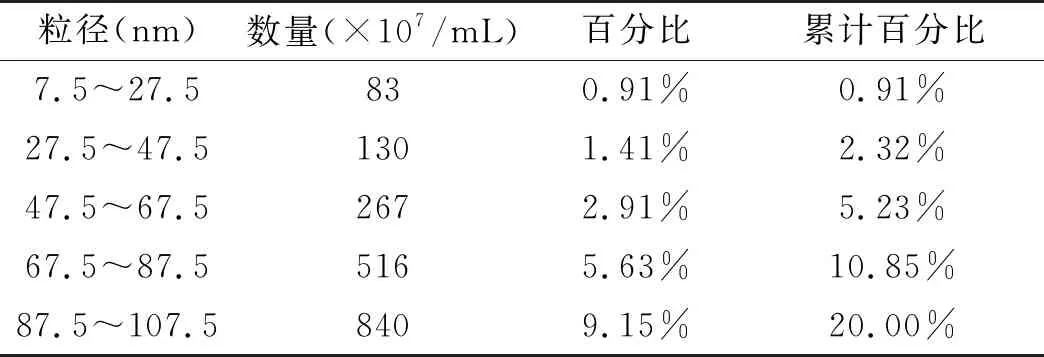
表1 NTA检测差速离心法提取OMVs粒径分布区间累计百分比

表1续表

表2 NTA检测超滤法提取OMVs粒径分布区间累计百分比
2.5 OMVs对RAW264.7细胞存活率的影响CCK8结果显示:与空白组相比,两种方法提取的OMVs(100 μg/mL)均对RAW264.7细胞存活率产生影响(P均<0.05)。差速离心法提取的OMVs作用后,细胞存活率为(84.0±4.6)%,超滤浓缩法提取的OMVs作用组细胞存活率为(74.1±6.6),组间无显著性差异(P>0.05)(图6)。

图6 OMVs对RAW264.7细胞存活率的影响
3 讨论
OMVs是细菌生命活动中不断从细胞表面脱落形成的功能性囊泡,内含核酸、脂质、蛋白质和代谢物等[7]。大量研究表明,几乎所有革兰阴性菌均能产生OMVs,其生物起源是一个精细、有选择性的过程[8]。细菌通过释放OMVs去除胞内不必要物质,以抵御外界应激压力。同时,OMVs在发病机制、细胞间通讯、生物膜形成以及基因水平转移等方面也发挥重要作用[9]。
高效便捷的提取方法是研究OMVs生物学功能及应用的基础,目前常用的制备OMVs的方法多且各自存在优缺点[10],如何选择满足自身实验需求的方法是研究者共同关心的问题。OMVs为细菌生长过程中分泌到菌体外的成分,本研究通过常规培养E.coli,获取上清后用超滤浓缩法和差速离心法提 取OMVs,结果发现两种方法均能够成功提取OMVs,电镜观察发现超滤浓缩法和差速离心法提取的OMVs形态上无明显差异,均为直径约20~250 nm的球状立体膜结构,且对细胞存活率的影响无差异。但差速离心法耗时较长,需要重复离心,提取的OMVs更易受到机械力影响而破裂,镜下可见包膜不完整。NTA对OMVs表征进一步分析发现,两种方法提取的OMVs粒径分布不同,超滤浓缩法提取的OMVs平均粒径更加集中,直径<247.5 nm的囊泡数量占总量(88.88±3.78)%,高于差速离心法制备的OMVs。
综上,本研究发现超滤浓缩法具有更高的提取效率,制备的OMVs完整性、纯度和蛋白浓度均高于差速离心法。当然,在进行OMVs研究时也应充分考虑试验需求,差速离心法利用样品中各种组分的沉降系数不同依次去除不同杂质,最终利用超高速离心力使OMVs沉淀实现分离制备的目的。因操作简单,底物可重复利用等优点成为分离提取OMVs最经典的方法,适合于大体积样本。超滤浓缩法则是通过使用截留分子量为100 KDa的超滤管进行样品浓缩,提高了回收效率,并大大缩短离心时间,仅需2.5 h左右便可完成OMVs的提取,克服了差速离心技术的缺陷与不足,是一种操作方便、简单易行的提取细菌OMVs的方法,具有良好的应用前景。总之,研发新的制备方法或改良现有方法,使OMVs分离达到 “高纯度、高效率 ”是未来的研究方向,可以为针对OMVs的生物学活性研究、以及以OMVs为靶点治疗和预防感染性疾病奠定坚实的实验基础。
