咪唑类离子液体的合成及其对氯苯的吸收-解吸性能研究
2022-02-13陈宋辉史淑芳
陈宋辉,史淑芳
(南京浩普新材料科技有限公司,江苏 南京 210000)
氯苯类有机物(CBs)广泛用于染料、有机合成等生产过程,是含氯挥发性有机化合物(VOCs)的重要组分。CBs化学性质稳定,有致突变、致癌和致畸效应,是较难处理的有机废气之一。烷基咪唑类离子液体具有很强的溶解性[1-2],可以作为吸收剂吸收许多有机、无机化合物及金属离子[3]。
作者以溴代正丁烷、N-甲基咪唑为原料,采用二步法(非微波)合成咪唑类离子液体,首先合成中间体溴化1-丁基-3-甲基咪唑([Bmim]Br),然后合成1-丁基-3-甲基咪唑六氟磷酸盐([Bmim]PF6)和1-丁基-3-甲基咪唑四氟硼酸盐([Bmim]BF4),通过红外光谱和核磁共振氢谱表征离子液体结构;以离子液体为吸收剂对氯苯气体(模拟工业含氯苯废气)进行吸收实验,考察吸收温度、吸收时间和进气氯苯浓度对离子液体吸收氯苯气体性能的影响,并研究离子液体吸收剂的解吸能力[4-6]。离子液体的合成路线如图1所示。
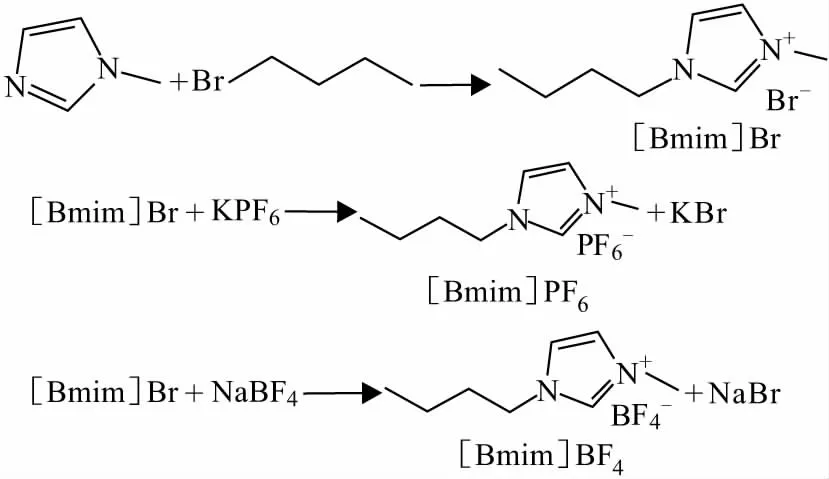
图1 离子液体的合成路线Fig.1 Synthetic routes of ionic liquids
1 实验
1.1 试剂与仪器
无水乙醇、氯代苯,南京化学试剂有限公司;甲醇,上海凌峰化学试剂有限公司;乙酸乙酯、N-甲基咪唑,无锡亚盛化工有限公司;氧化铝、六氟磷酸钾、四氟硼酸钠,上海阿拉丁生物科技有限公司;溴代正丁烷,永华化学科技(江苏)有限公司;以上试剂均为分析纯。
UV2450型傅立叶变换红外光谱仪,美国赛默飞科技公司;SHB-Ⅲ型循环水式多用真空泵,郑州长城科工贸有限公司;BGG-QQ75A型电热鼓风干燥箱,上海一恒科学仪器有限公司;RE52CS型旋转蒸发仪,上海亚荣生化仪器厂;SKA/NE-101型VOCs检测仪,深圳圣凯安科技有限公司;Avance 500MHz核磁共振波谱仪,德国Bruker公司。
1.2 咪唑类离子液体的合成
1.2.1 溴化1-丁基-3-甲基咪唑的合成
将16.4 gN-甲基咪唑、30.14 g 溴代正丁烷和40 mL甲醇加入250 mL三口烧瓶中,通冷凝水,70 ℃搅拌反应6 h;将反应混合物倒入250 mL旋蒸瓶中,减压蒸馏1 h,得粗产物溴化1-丁基-3-甲基咪唑;将粗产物置于105 ℃真空干燥箱干燥12 h,得到精制后的溴化1-丁基-3-甲基咪唑。
1.2.2 1-丁基-3-甲基咪唑六氟磷酸盐的合成
将36.8 g(0.2 mol)六氟磷酸钾、48.3 g(0.2 mol)溴化1-丁基-3-甲基咪唑和100 mL甲醇加入250 mL三口烧瓶中,通冷凝水,60 ℃下搅拌反应12 h,真空抽滤除去盐分。称取2 g中性氧化铝,加入到盛有离子液体的烧杯中,室温搅拌10~20 min,抽滤,收集滤液,用旋转蒸发仪旋干甲醇,抽滤除去析出的盐分,将滤液装入广口瓶中,105 ℃真空干燥24 h,得1-丁基-3-甲基咪唑六氟磷酸盐。
1.2.3 1-丁基-3-甲基咪唑四氟硼酸盐的合成
将22 g(0.2 mol)四氟硼酸钠、48.3 g(0.2 mol)溴化1-丁基-3-甲基咪唑和100 mL甲醇加入250 mL三口烧瓶中,通冷凝水,60 ℃下搅拌反应12 h,真空抽滤除去盐分。称取2 g中性氧化铝,加入到盛有离子液体的烧杯中,室温搅拌10~20 min,抽滤,收集滤液,用旋转蒸发仪旋干甲醇,抽滤除去析出的盐分,将滤液装入广口瓶中,105 ℃真空干燥24 h,得1-丁基-3-甲基咪唑四氟硼酸盐。
1.3 咪唑类离子液体的表征
采用红外光谱(FTIR)和核磁共振氢谱(1HNMR)对咪唑类离子液体的结构进行表征。
1.4 对氯苯气体的吸收-解吸实验
采用自行设计的吸收实验台,进行咪唑类离子液体吸收氯苯气体(模拟工业含氯苯废气)实验,流程如图2所示。
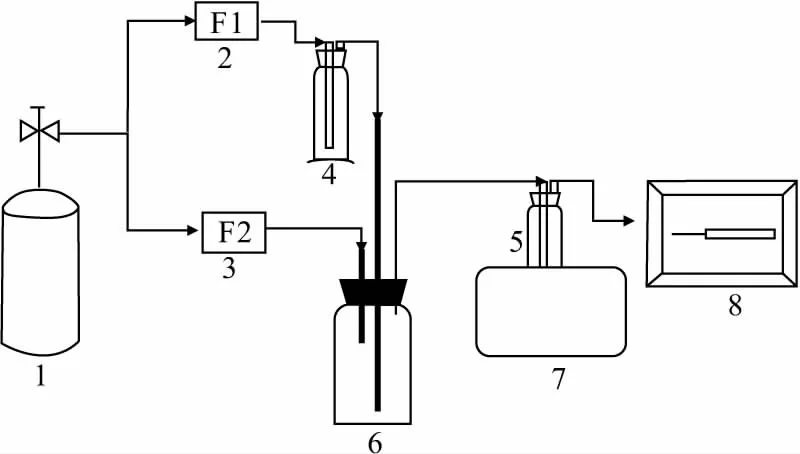
1.空气压缩机 2、3.气体流量计 4、5.洗气瓶 6.缓冲瓶 7.恒温水浴锅 8.VOCs检测仪图2 离子液体吸收氯苯气体的实验流程Fig.2 Experimental process of absorption of chlorobenzene gas by ionic liquid
由空气压缩机提供一定量的空气经气体流量计导入装有氯苯液体的洗气瓶,吹脱氯苯液体,通过调节流量计来控制氯苯气体的浓度。氯苯气体经离子液体吸收后从洗气瓶上部排气口排出,通过VOCs检测仪测定氯苯气体经离子液体吸收前后的浓度。采用单因素实验考察吸收温度、吸收时间、进气氯苯浓度对氯苯吸收效率的影响。吸收效率按下式计算:

式中:c1为进气氯苯浓度,mg·m-3;c2为出气氯苯浓度,mg·m-3。
吸收饱和后的离子液体采用旋转蒸发仪进行氯苯的解吸实验,至离子液体质量恒定,解吸温度135 ℃。解吸后的离子液体重复进行吸收-解吸实验5次,比较[Bmim]PF6和[Bmim]BF4的解吸性能。
2 结果与讨论
2.1 离子液体的表征
2.1.1 [Bmim]PF6的结构表征
[Bmim]PF6的红外光谱如图3所示。

图3 [Bmim]PF6的红外光谱Fig.3 FTIR spectrum of [Bmim]PF6
由图3可知,3 169 cm-1、3 121 cm-1归属为咪唑环上C-H伸缩振动;2 966 cm-1、2 939 cm-1、2 878 cm-1归属为饱和烃C-H伸缩振动;1 620 cm-1、1 576 cm-1归属为C=N骨架振动;1 468 cm-1归属为C-H面内弯曲振动;1 350 cm-1归属为饱和C-H变形振动;1 170 cm-1归属为咪唑环上C-H面内变形振动;856 cm-1归属为P-F伸缩振动;758 cm-1、624 cm-1、558 cm-1归属为咪唑环上C-H面外弯曲振动。此外,在3 645 cm-1和3 420 cm-1处有强吸收峰,表明产物离子液体[Bmim]PF6中还有水分的存在。
1HNMR(500 MHz,CDCl3),δ:8.59(s,1H,CH),7.47(s,1H,CH),7.27(m,1H,CH),4.24(m,2H),3.87(m,3H,NCH3),1.89(m,2H),1.33(m,2H,CH2),0.96(m,3H,CH3)。
结合红外光谱和核磁共振氢谱数据,表明成功合成了目标离子液体[Bmim]PF6。
2.1.2 [Bmim]BF4的结构表征
[Bmim]BF4的红外光谱如图4所示。
由图4可知,3 158 cm-1、3 115 cm-1归属为咪唑环上C-H伸缩振动;2 963 cm-1、2 937 cm-1、2 876 cm-1归属为饱和烃C-H伸缩振动;1 633 cm-1、1 576 cm-1归属为C=N骨架振动;1 464 cm-1归属为C-H面内弯曲振动;1 384 cm-1、1 338 cm-1归属为饱和C-H变形振动;1 170 cm-1归属为咪唑环上C-H面内变形振动;1 064 cm-1归属为B-F伸缩振动;852 cm-1、754 cm-1归属为咪唑环上C-H面外弯曲振动。另外,3 500~3 300 cm-1处有很强的吸收峰,表明产物离子液体[Bmim]BF4中还有水的存在。
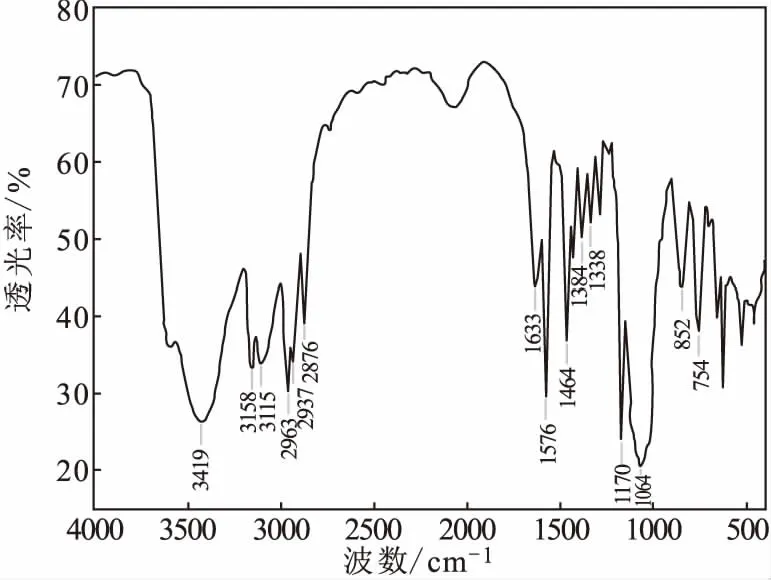
图4 [Bmim]BF4的红外光谱Fig.4 FTIR spectrum of [Bmim]BF4
1HNMR(500 MHz,CDCl3),δ:9.39(s,1H,CH),7.47 (s,1H,CH),7.44(s,1H,CH),4.16(m,2H,NCH2),3.95(s,3H,NCH3),1.84 (m,2H,NCH2CH2),1.33(m,2H,CH2),0.88(m,3H,CH3)。
结合红外光谱和核磁共振氢谱数据,表明成功合成了目标离子液体[Bmim]BF4。
2.2 影响离子液体吸收氯苯气体性能的因素
2.2.1 吸收温度
在进气氯苯浓度为900 mg·m-3、进气量为0.55 L·min-1、离子液体质量为40 g、吸收时间为20 min的条件下,分别在5 ℃、10 ℃、20 ℃、30 ℃、40 ℃下进行氯苯吸收实验,结果如图5所示。
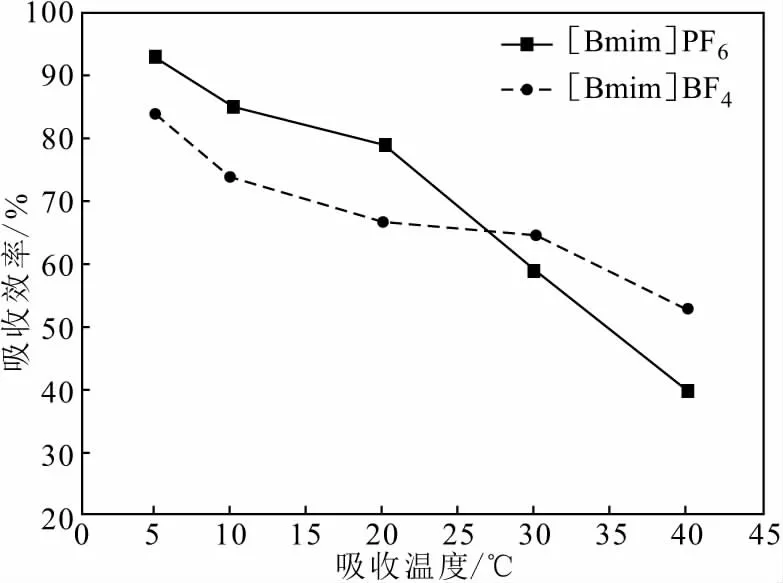
图5 吸收温度对氯苯吸收效率的影响Fig.5 Effect of absorption temperature on absorption efficiency of chlorobenzene
由图5可知,随着吸收温度的升高,离子液体对氯苯的吸收效率逐渐降低,表明温度越低更有利于咪唑类离子液体吸收氯苯。当吸收温度在5~20 ℃时,[Bmim]PF6吸收氯苯的性能较[Bmim]BF4更好;而在30~40 ℃时,[Bmim]BF4吸收氯苯的性能较[Bmim]PF6更好,但氯苯吸收效率较低。考虑到工业实际应用时低温较难控制,故吸收温度选用20 ℃进行后续实验。
2.2.2 吸收时间
在进气氯苯浓度为1 500 mg·m-3、进气量为0.55 L·min-1、离子液体质量为40 g、吸收温度为20 ℃的条件下,分别在不同吸收时间下进行氯苯吸收实验,结果如图6所示。
由图6可知,随着吸收时间的延长,两种离子液体对氯苯的吸收效率均呈下降趋势;40 min以内时,[Bmim]PF6对氯苯的吸收效率都很高,从96%下降到74%,[Bmim]BF4对氯苯的吸收效率则从89.5%下降到54%;60 min以后,[Bmim]PF6的吸收效率缓慢下降至持平,[Bmim]BF4则继续下降,在200 min时,吸收效率降至10%,此时[Bmim]PF6的吸收效率仍有40%。因此,吸收时间选用两者吸收效率都较高的30 min。

图6 吸收时间对氯苯吸收效率的影响Fig.6 Effect of absorption time on absorption efficiency of chlorobenzene
2.2.3 进气氯苯浓度
在进气量为0.55 L·min-1、离子液体质量为40 g、吸收温度为20 ℃、吸收时间为30 min的条件下,分别在进气氯苯浓度为480~500 mg·m-3、870~900 mg·m-3、1 150~1 200 mg·m-3、1 440~1 500 mg·m-3下进行氯苯吸收实验,结果如图7所示。

图7 进气氯苯浓度对氯苯吸收效率的影响Fig.7 Effect of inlet chlorobenzene concentration on absorption efficiency of chlorobenzene
由图7a可知,[Bmim]PF6体系中,进气氯苯浓度从480~500 mg·m-3增大到1 150~1 200 mg·m-3时,出气氯苯浓度比较稳定;当进气氯苯浓度为1 440~1 500 mg·m-3时,出气氯苯浓度增大明显。因此,在进气氯苯浓度为1 150~1 200 mg·m-3时,[Bmim]PF6对氯苯的吸收效率最佳,是一个顶峰。对于[Bmim]PF6体系,从低浓度到高浓度对氯苯的吸收效率都较好,稳定在80%以上。由图7b可知,[Bmim]BF4体系中,进气氯苯浓度增大时,出气氯苯浓度也增大,在870~900 mg·m-3时,吸收效率达到最高,为79%左右。
2.3 解吸次数对吸收效果的影响
离子液体能否应用于实际工业氯苯废气吸收处理,除了需考察其吸收性能,其解吸性能也很关键。若吸收剂在多次解吸后吸收效果仍很好,则有较好的应用前景。如前所述,低温有利于离子液体吸收氯苯,高温有利于离子液体解吸氯苯。
在进气氯苯浓度为2 500 mg·m-3、[Bmim]PF6质量为40 g、进气量为0.8 L·min-1、吸收温度为20 ℃的条件下,连续吸收氯苯气体至吸收平衡。由第一次吸收实验可知,40 g [Bmim]PF6连续吸收氯苯气体16 h时达到吸收平衡,最终氯苯吸收量为1.75 g,饱和吸收量为43.75 mg·g-1。在进气氯苯浓度为900 mg·m-3、[Bmim]BF4质量为40 g、进气量为0.8 L·min-1、吸收温度为20 ℃的条件下,连续吸收氯苯气体至吸收平衡。由第一次吸收实验可知,40 g [Bmim]BF4连续吸收氯苯气体14 h时达到吸收平衡,最终氯苯吸收量为1.29 g,饱和吸收量为32.25 mg·g-1。由第一次解吸实验可知,解吸90 min 后,离子液体质量恒定,最终确定其解吸时间为90 min。重复吸收-解吸实验5次,[Bmim]PF6和[Bmim]BF4解吸次数对饱和吸收量的影响如图8所示。
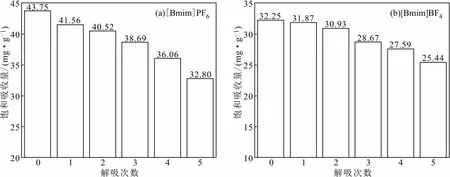
图8 解吸次数对饱和吸收量的影响Fig.8 Effect of desorption times on saturated absorption amount
由图8可知,对于离子液体[Bmim]PF6和[Bmim]BF4,随解吸次数的增加,饱和吸收量下降,前3次饱和吸收量下降趋势缓慢;第5次解吸后,[Bmim]PF6和[Bmim]BF4的饱和吸收量分别为第1次的75.0%、78.9%。后2次饱和吸收量减少可能是由于前期氯苯未完全解吸以及部分吸收剂残留在旋蒸瓶内壁,导致再吸收时饱和吸收量下降。总体而言,两种离子液体解吸性能很好,均可循环再生。
3 结论
(1)以溴代正丁烷、N-甲基咪唑为原料,合成离子液体[Bmim]PF6和[Bmim]BF4,红外光谱和核磁共振氢谱表征所合成产物结构与目标化合物结构一致。
(2)以离子液体[Bmim]PF6和[Bmim]BF4为吸收剂,考察其对氯苯气体的吸收性能。随着吸收温度升高,离子液体吸收氯苯效果变差,低温更有利于离子液体吸收氯苯。[Bmim]PF6吸收性能受温度影响更大,而[Bmim]BF4受温度影响较小。因此,低温5~20 ℃时[Bmim]PF6吸收效果更好,高于30 ℃时[Bmim]BF4吸收效果更好。
(3)5次吸收-解吸实验表明,[Bmim]PF6对氯苯气体的饱和吸收量较[Bmim]BF4高,两种离子液体的解吸性能都很好。5次再生后,两种离子液体仍能达到最初性能的75%以上,可作为氯苯废气的高效吸收剂在工业上广泛应用。
