TLR4基因多态性与宫颈癌易感性的关联性分析
2022-02-13孙亚楠杨红玉蔡玉茹
孙亚楠,杨红玉,郭 婧,李 楠,蔡玉茹
宫颈癌是全球女性癌性死亡的一个主要原因,病死率仅次于乳腺癌,近年我国宫颈癌发病率呈上升趋势,严重影响了女性健康[1-3]。人类乳头瘤病毒(HPV)感染被认为是宫颈癌发生发展的影响因素[4],在已知的200种HPV类型中,HPV 16和18感染关联的患病率约为70%[5]。虽然HPV感染已成为宫颈癌发病的一个明确原因,但是并非所有感染HPV的妇女都会发展为宫颈癌,而未感染HPV的妇女也会患宫颈癌,这表明个体遗传因素的变异在影响女性HPV感染和宫颈癌易感性方面发挥了关键作用,其中一个因素为先天免疫系统病原体识别受体即Toll样受体(TLRs)。TLRs在细菌、病毒和其他病原体及抗肿瘤免疫应答方面均有重要作用,其也是感染、组织损伤等多种因素引发炎症反应的起始因子[6]。同时,炎症也是重要的致癌因素,炎症相关TLR基因的遗传变异在影响致病性感染和癌症易感性方面具有潜在作用[7]。单核苷酸多态性(SNPs)是广泛存在于生物基因组中的一种新型分子标志物,可能影响基因的调控、表达和功能[8-10],基于炎症在宫颈癌中的重要作用及TLR基因SNPs与宫颈癌易感性的关联性,本研究旨在检测TLR4基因SNPs,探讨其与宫颈癌易感性的关系,以期为宫颈癌的防治提供参考依据。
1 对象与方法
1.1研究对象 选取解放军联勤保障部队第九八〇医院妇产科和河北医科大学第二医院妇科2012—2020年来院的503例宫颈癌(宫颈癌组)和495例体检健康者(对照组)。宫颈癌患者入组条件:经病理检查确诊,排除患有其他癌症、接受过放化疗者,患者彼此间无亲属关系。对照组纳入标准:无肿瘤家族史和宫颈相关疾病者。纳入对象基本特征信息包括年龄、初婚年龄和生育史。宫颈癌组临床信息包括肿瘤类型和肿瘤分期,肿瘤分期依据国际妇产科学联合会(FIGO)标准。本研究通过医院医学伦理委员会批准并经患者知情同意。
1.2位点筛选和基因分型 选取TLR4基因的4个SNPs位点:rs4986790、rs10759931、rs11536889和rs1927911。全血DNA提取:收集所有样本的外周血2 ml,采用全血DNA提取试剂盒提取基因组DNA(北京艾德莱),DNA样本采用微量分光光度计定量,并于-70 ℃环境下保存备用。采用聚合酶链式反应-限制性片段长度多态性技术行基因分型,酶切产物采用3%琼脂糖凝胶电泳进行分型。PCR试剂盒购自Takara公司,限制性内切酶为快反应内切酶购自Thermo公司。位点基本信息、引物设计和限制性内切酶见表1。

表1 TLR4基因SNPs基本信息和PCR-RFLP实验条件
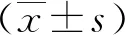
2 结果
2.1临床资料比较 宫颈癌组年龄为(44.43±7.60)岁,对照组年龄为(44.05±7.08)岁;宫颈癌组初婚年龄为(24.52±3.02)岁,对照组初婚年龄为(26.16±3.166)岁;宫颈癌组初产年龄为(26.23±2.80)岁,对照组初产年龄为(27.98±3.17)岁;宫颈癌组产次≤2次者485例,>2次者18例;对照组产次≤2次者483例,>2次者12例。2组在初婚年龄、初产年龄方面比较差异有统计学意义(P<0.01),在年龄、产次方面比较差异无统计学意义(P>0.05)。因此,在后续Logistic回归分析时应对初婚年龄和初产年龄予以校正。此外,宫颈癌组病理分型为鳞癌479例(95.2%),腺癌19例(3.8%),其他5例(1.0%);FIGO分期Ⅰ期218例(43.3%)、Ⅱ期196例(39.0%)、Ⅲ期56例(11.1%)、Ⅳ期33例(6.6%)。
2.2平衡性校验结果 所有SNPs位点在2组群体中符合Hardy-weinberg平衡(P>0.05),表明研究群体具有良好的代表性;连锁不平衡检验结果显示:4个SNPs位点间不存在连锁遗传,D'趋近于1,因此可以进行单倍型分析。见表2。

表2 TLR4基因多态性与宫颈癌易感性的平衡性校验分析
2.3基因多态性分析 TLR4基因rs4986790、rs10759931和rs11536889等位基因和基因型分布2组间比较差异有统计学意义(P<0.01),而rs1927911的基因型分布2组间比较无差异(P>0.05)。校正初婚年龄和初产年龄后,rs4986790的AG基因型、rs10759931的GG基因型和rs11536889的CC基因型与宫颈癌的发病风险增加有关(P<0.05,P<0.01)。此外,通过对宫颈癌早期(Ⅰ+Ⅱ期)和晚期(Ⅲ+Ⅳ期)与基因型分布的关系发现,TLR4的4个SNPs位点基因多态性与宫颈癌FIGO分期无明显关联,TLR4的4个SNPs位点等位基因和基因型分布与宫颈癌发病风险相关联。见表3。

表3 TLR4的4个SNPs位点的等位基因和基因型分布与宫颈癌发病风险的关联性分析
2.4单倍型多态性分析 在单倍型分布率与宫颈癌发病风险的关联性分析中,以单倍型A-A-G-C为参考,单倍型G-A-G-T、G-A-C-C和A-A-C-T与宫颈癌发病风险增加相关,而单倍型A-A-C-C则与宫颈癌发病风险降低有关(P<0.05,P<0.01);宫颈癌组和对照组单倍型G-A-G-T分布率分别为0.166和0.133,携带该单倍型个体的宫颈癌易感性风险值为1.627(95%CI:1.224,2.163,P=0.001)。见表4。

表4 宫颈癌单倍型分布与发病风险的关联性分析
3 讨论
TLR4基因位于9号染色体q32-q33,包含4个外显子,在淋巴细胞、单核细胞、巨噬细胞、树突状细胞、多形核白细胞和脾细胞中高度表达[11]。TLR4在免疫系统中发挥关键作用,参与介导机体对病毒、细菌、真菌等外来病原体引起的炎症反应[12],并参与多种肿瘤的发生发展,尤其是以感染作为危险因素的肿瘤[13-15]。宫颈癌易感性受遗传和环境因素的影响,HPV感染是宫颈癌发病的主要环境因素,研究表明,TLR4的表达与HPV阳性宫颈癌的发生和发展密切相关,而发生在TLR4启动子区的变异会影响TLR4的表达水平[16]。随着全基因组关联分析的不断深入,已有多项研究报道TLR 2、4和9基因多态性在宫颈癌易感性中的重要作用[17-20],但这些研究得出的结果并不一致。
基于TLR4基因在炎症和肿瘤中的易感性,本研究选取了TLR4基因的4个功能型SNPs位点,分别位于5'-UTR(rs10759931)、3'-UTR(rs11536889)、外显子(rs4986790)和内含子(rs1927911),涵盖了该基因的不同区域。本研究结果显示:rs4986790、rs10759931和rs11536889位点与宫颈癌的发病存在明显关联,携带基因型AG(rs4986790)、GG(rs10759931)和CC(rs11536889)的个体具有潜在的宫颈癌易感性,发病风险分别增加了1.687、1.888和3.776倍。ZIDI等[19]报道TLR4 rs4986790位点的G等位基因和AG基因型与宫颈癌风险增加有关,印度北部地区群体的rs11536889杂合基因型GC与宫颈癌风险增加有关[20-22],而且位于TLR4基因3'-UTR区的SNPs(rs11536889)的G等位基因被证实在TLR4表达中发挥关键作用[23]。与本研究所得出结果不同的是,印度宫颈癌群体TLR4基因内含子rs1927911位点的杂合基因型与宫颈癌风险显著相关[22],而在波兰女性群体中,rs10759931变异则对宫颈癌发病起保护作用[18]。可见,不同群体的疾病易感基因谱不尽相同。
由于单倍型分析较单一的SNPs分析更能体现出遗传易感性在肿瘤发病中的表现度[24],本研究对TLR4基因的4个SNPs位点进行分析,结果显示4个SNPs位点不存在连锁遗传,共构成单倍型10种,其中7种单倍型分布率超过4%,通过对单倍型分布率分布和宫颈癌发病情况进行分析,发现单倍型A-A-G-C和G-A-G-T分布率与宫颈癌发病风险存在明显关联,以单倍型A-A-G-C作为对照,3种单倍型与宫颈癌发病风险增加相关,1种单倍型与宫颈癌发病风险降低有关,但由于单倍型G-A-C-C、A-A-C-T和A-A-C-C分布率2组间均较低,不能准确反映其与宫颈癌发病的关联性,而单倍型G-A-G-T分布率在研究群体中相对较高,其风险值评估可以作为参考,携带单倍型G-A-G-T的个体患宫颈癌的风险提高了1.627倍。
本研究仍存在较多不足之处,首先,由于HPV感染是宫颈癌发病的重要因素,较多研究将HPV感染作为混杂因素对基因多态性分析进行校正[21-22,25],本研究由于样本收集较早,早期并未对HPV感染的临床数据收集完善,若剔除早期样本量又不能很好反映基因多态性与宫颈癌发病的关联。近些年,随着宫颈癌患者和健康体检者HPV感染检测的常规化,后续将对HPV感染类型和靶基因多态性的关系进行深入探讨;其次,本研究基于病例对照研究,缺少相应机制和功能学的同步佐证,后续我们将研究TLR家族参与炎症所致肿瘤的机制;再次,本研究样本只收集本地区的2家医院,存在选择偏倚情况,扩大收集范围和增加样本量仍是今后研究应改进之处。
综上,TLR4基因rs4986790、rs10759931和rs11536889位点的多态性与宫颈癌发病风险存在明显关联,TLR4可以作为宫颈癌的易感基因,为宫颈癌的早期筛查和个性化诊治提供参考依据。
