早春短生植物鸢尾蒜在干热和湿润环境下的比较转录组研究∗
2022-02-13李岩李周康张雪妮吕光辉
李岩,李周康,张雪妮,吕光辉
(新疆大学 资源与环境科学学院,绿洲生态教育部重点实验室,新疆乌鲁木齐 830017)
0 引言
干旱作为一种胁迫因子,对植物的生长、发育、繁殖等多种生物学过程均产生不利影响[1].干旱对植物的影响及植物对干旱的响应和适应机理是植物学研究的重大问题之一.国内外诸多学者开展了大量的研究,从形态、行为、生理、生化、分子等方面揭示了干旱的效应及植物的适应机制[2−5].随着分子生物学和生物信息学的快速发展,组学成为研究植物抗旱分子机制的重要手段.转录组能够从整体水平研究基因功能以及基因结构,从而揭示特定生物学过程的分子机理[6−7].比较转录组学分析,如抗旱性不同的近缘物种间、同一植物物种耐旱性不同的基因型个体(如耐受型和敏感型)或不同水分梯度上的群体/个体、人工梯度干旱胁迫处理[8−11]等,在阐明生物体适应逆境的各种生物学途径及其作用,全面了解植物抗逆分子机制发挥了重要作用.
新疆准噶尔盆地北部分布的短生植物类群属于避旱植物[3],在结构、生理、物候、生繁模式等方面形成了对干热气候的独特适应性策略,如植株矮小(株高约5~30 cm)[12]、具有极强的结实性[3,13];植株分化简单、中生结构明显;叶栅栏组织发达、具花环状维管束鞘[14−16];生活周期短,只有2个月左右[17];表型和生活周期具有可塑性,在生长期内有充足水分供应时,短生植物能迅速适应变化使生活周期延长,与一年生中生草本植物类似或变为越年生植物[17].国内外学者对短生植物的荒漠环境适应机制开展了较多的研究[18−19],然而植物适应新疆干热条件的分子机理、生活史可塑性的分子调控机理尚不明确.在野外调查过程中,我们发现早春短生植物鸢尾蒜(Ixiolirion tataricum)的个体形态、生理特点在林下湿润生境(林下生境)和阳光直射干燥生境(干热生境)表现出明显的差异.干热生境中植株的生长状态较差,密度小,且个体矮小瘦弱,植株结实和死亡时间早;而林下生境中植株十分茂盛,个体高大强壮,生长期较长.我们认为两种生境中个体表型和生活周期的差异,反映了鸢尾蒜对不同环境的适应性.因此我们对两种生境中的鸢尾蒜个体进行了转录组测序,通过比较转录组学分析探讨鸢尾蒜适应干热环境的分子机理,丰富短命植物的基因组数据,为后续的研究提供可用的遗传资源.
1 材料与方法
1.1 样品采集
研究区位于乌鲁木齐蜘蛛山(43°51′N、87°32′E,海拔730 m)和西山农场(43°47′N、87°25′E,海拔930 m).西山农场为自然草地,无乔灌木覆盖(指鸢尾蒜群落内)(图1A),蜘蛛山为人工林生境(图1B).样品采自2018年5月12日上午,天气晴朗,采集日前三天无降雨.蜘蛛山群落平均土壤含水量11.28%,西山农场群落平均土壤含水量9.6%.每个生境中随机选择5个个体,个体间距离至少30 m,每个体上取2~3片叶片,迅速用锡箔纸包裹后置于液氮罐中,用于RNA提取和转录组测序.之后每个生境中随机选择20~30个个体,个体间距不小于10 m,整株挖出,用于统计生理参数.

图1 鸢尾蒜在干热生境(A)和林下生境(B)中的图片
1.2 样品生理参数统计
样品采集完带回实验室后,立即测量个体高度(包括地上高度、地下高度)、叶片数、花数.将叶片全部取下置于牛皮纸信封中,随后将剩余部分按地上和地下分开,分别置于信封内.把叶片、地上、地下部分置于烘箱内烘干至恒重(24 h),并称重,之后统计地上、地下生物量、总生物量等生理指标.利用单因素方差分析检验生境间生理参数的差异性.
1.3 总RNA提取、转录组文库构建和测序
采用Trizol法(Invitrogen)提取叶片总RNA,利用琼脂糖凝胶电泳和Nanodrop微量分光光度计(艾本德)进行质量检测和定量.利用Illumina mRNA转录组文库构建试剂盒(HieffNGSTMMaxUp Dual-mode mRNA Library Prep Kit)(YEASEN)构建文库.主要流程:利用oligo(dT)磁珠分离和纯化mRNA;mRNA片段化(94°C,5 min);双链cDNA合成;利用磁珠(HieffNGSTMselection beads)法纯化cDNA;修复cDNA末端并添加poly(A)尾;连接Illumina接头;产物纯化和片段大小分选;文库扩增、利用磁珠纯化扩增产物,并对片段大小进行分选(300~500 bp);通过凝胶电泳检测文库质量,质量合格的文库用于高通量测序.最终,每个生境挑取3个合格的文库,送至上海生工生物有限公司,利用Illumina HiSeq XTen测序平台进行测序.
1.4 转录组组装及功能注释
使用Trimmomatic[20]过滤原始数据(raw reads).去除带N碱基的序列、接头序列,去除低质量碱基(Q值<20),使用滑窗法去除读长(reads)尾部质量值在20以下的碱基(窗口大小为5 bp),去除长度小于35 nt的读长,得到质控后数据(clean数据).
使用Trinity[21]将clean数据de novo组装成转录本,参数min−kmer−cov 2,其余默认.拼装的转录本去冗余后,取每个转录本聚类中最长的转录本作为同基因(unigene),以此作为后续分析的参考序列.利用Blast+得到同基因在KOG、COG、NR、NT、PFAM、Swissprot、TrEMBL数据库的注释信息,根据Uniprot的注释信息得到基因本体(Gene Ontology,GO)[22]功能注释,利用KAAS(KEGG Automatic Annotation Server)[23]得到KEGG注释信息.
1.5 差异基因筛选及功能富集
采用DESeq 2检测生境间的显著差异基因,筛选条件设为FDR(False Discovery Rate)校正后P值(Q值)≤0.05且表达差异倍数(|FoldChange|)≥2,利用R的gplots2软件包完成显著差异基因的表达模式聚类.使用TopGO v.2.24进行GO富集分析,对每一个GO分类,利用卡方检验和Fisher检验测试差异表达转录本的富集情况,筛选显著富集的GO功能分类(Q≤0.05).使用Cluster Profiler v.3.0.5进行KEGG通路富集分析,利用上述统计方法检测差异表达转录本在代谢通路中的富集情况.
1.6 生物学样本重复性检测
将过滤后的所有转录本的表达量作为列表输入到R中,利用cor函数计算样本间的皮尔森相关系数,检测样本生物学重复的相关性.
2 结果
2.1 生境间植株生理参数比较
鸢尾蒜生理参数(植株高度、生物量、地上/地下生物量比、叶片数)的统计分析表明,林下生境的植株个体高度、地上高度、叶片数、花朵数显著高于干热环境,而叶片生物量和总生物量表现为干热生境高于林下生境.地上/地下生物量比在生境间无显著差异(表1).

表1 鸢尾蒜在两种生境中的生理参数
2.2 转录组测序结果
6个样品的测序数据量均大于6 G,随着reads数量的增多,检测到的基因数也随之上升,最后趋于饱和.样本间的皮尔森相关指数表明,干热生境内的重复样本(TD1~TD3)的相关性都高于生境间,林下生境的TZ3与其它两个重复(TZ1、TZ2)的相关性较低(分别为0.79、0.62),因此剔除该样本,利用剩余的5个样本开展后续分析.同时,基于样本间Bray-Curtis距离矩阵构建的聚类树显示,不同生境内的样本各自聚为一个分支,说明不同生境的样本转录组具有明显差异(图2).
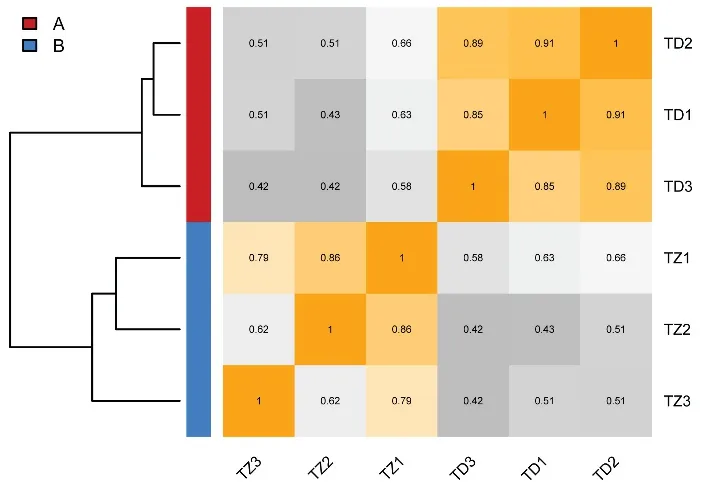
图2 基于Bray-Curtis距离矩阵构建的样品聚类关系(左)及样品间的皮尔森相关系数(右)
2.3 转录组组装结果
转录组统计结果显示碱基质量值Q20在98%以上,GC含量在46%~47%左右(表2).从头组装后,共得到352 993个转录本,150 702个同基因,N50为752 bp,最长转录本为12 389 bp,平均长度663 bp(表3).

表2 转录组测序数据统计
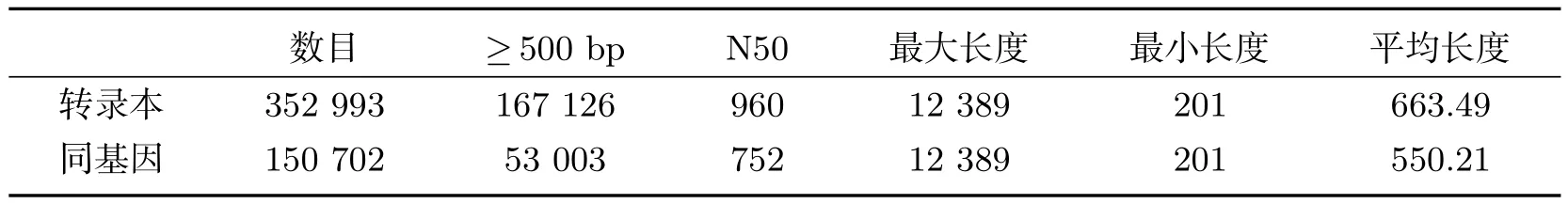
表3 转录组组装结果统计
2.4 转录本功能注释信息
共注释到同基因蛋白150 702条,其中:注释到NR数据库43 786条、KOG数据库18 226条、GO数据库40 304条、KEGG数据库10 922条,在至少一个数据库中得到注释的基因有50 413条,注释于所有数据库的有3 964条(表4).

表4 转录本在多个数据库成功注释的数目和比例
2.5 生境间差异基因
干热生境与林下生境相比,表达量有显著差异的基因(Differentially Expressed Genes,DEGs)共1 929个,其中827个上调,1 102个下调,差异基因的聚类关系见图3.

图3 差异表达基因聚类热图
2.6 差异基因功能GO富集分析
GO功能注释分类显示,差异基因富集到3大GO本体的49个条目中.生物过程本体主要富集到细胞过程、刺激响应、代谢过程、生物合成、生物调节、生物过程调节、定位、多细胞过程、增殖、信号、发育过程、繁殖等条目中.细胞组分本体主要富集到细胞、细胞部分、细胞器、细胞器部分、细胞膜、细胞膜部分、含蛋白复合体等条目中.分子功能本体主要富集到结合、催化、转运、信号转导等条目(表5).
差异基因GO功能上下调分析发现,生物过程本体内细胞过程、代谢过程、生物调节、刺激响应、细胞成分的生物合成;细胞组分内细胞、细胞部分、细胞器、细胞器部分、含蛋白复合体;分子功能内催化活性、结合、结构分子等功能组基因下调基因数量大于上调基因,下调基因涉及三个本体的多个条目,说明干热环境对鸢尾蒜的抑制作用是多方面和复杂的.与之相反,定位、多细胞生物过程、发育过程、繁殖、信号转导等功能组中上调基因数量大于下调基因数量(表5).

表5 差异基因的GO功能富集分类
2.7 差异表达基因的KEGG通路富集
共获得30个显著富集的KEGG通路(Q<0.05),其中上调通路16个,下调代谢通路14个(表6).下调基因显著富集在光合作用(包括天线蛋白、卟啉与叶绿素代谢)、碳代谢(包括碳固定、磷酸戊糖途径)、氨基酸代谢和蛋白质加工等代谢通路中;上调基因显著富集在次生代谢产物相关代谢通路中,包括淀粉与蔗糖、黄酮和黄酮醇、牛磺酸和次牛磺酸代谢、苯丙素、不饱和脂肪酸(α-亚麻酸、花生四烯酸)、谷胱甘肽的合成、溶酶体、过氧化物酶体代谢通路,这些物质与植物适应逆境相关,参与调节细胞渗透压、清除氧化压力提高细胞质膜结构稳定性;另外,促分裂原活化蛋白激酶(Mitogen-Activated Protein Kinase,MAPK)信号通路也得到上调.

表6 差异基因的KEGG代谢通路富集
3 讨论
干旱胁迫对植物生长发育造成严重的影响.当植物遭受干旱胁迫时,其体内的一系列信号被激活并传递,进而增强或者抑制某些基因的表达,最终在形态建成、生长发育、生理生化等方面作出适当的回应以抵御干旱损伤,促使植物正常生长[4−5].干旱对植物生长具有抑制作用,能减少叶片数量和生物量[11],本研究发现干热生境下的鸢尾蒜个体株高显著低于林下湿润生境的个体,但是叶片数、花朵数、叶片生物量、总生物量却升高,说明在干热环境下,鸢尾蒜通过改变生物量在茎和叶的分配、增加叶片数和花朵数、降低植株高度来适应环境,个体叶片数量增加可能对提高光合作用效率、促进物质的积累并快速完成生活周期有利.
植物对干旱胁迫的响应是一个非常复杂的过程,涉及多个基因、多种途径以及多种代谢产物的合成[1−2].GO富集发现,鸢尾蒜两种生境中检测到的1 929个差异表达基因富集到3个GO本体49个条目下.细胞过程、刺激响应、信号、代谢、调节、发育、繁殖等过程或功能均有不同程度的基因富集,说明干热环境对鸢尾蒜的生物学功能产生了整体的、复杂的影响.KEGG代谢途径富集分析发现,差异基因主要富集在光合作用、蛋白质加工和代谢、次生物质代谢、抗氧化活性、信号转导等通路,与GO富集相一致.在干热条件下,光合作用及其相关的叶绿体组分和天线蛋白、碳代谢通路、氨基酸代谢和蛋白质加工等通路受到影响,使得植物光合作用和物质积累受到抑制,这可能是干热环境中植株高度降低的主要原因.研究发现多条代谢通路涉及光合作用等相关途径,说明干旱胁迫对光合作用产生了显著影响[24].另外,吲哚生物碱合成途径也受到抑制,吲哚乙酸作为植物生长激素,在植物生长发育过程中起重要调控作用[25],该通路基因表达下调,对植物生长造成了不利影响,可能是植株高度降低的一个原因.最后,我们发现雌激素信号通路、抗原加工递呈和伸长调节途径也受到抑制,与苦荞在盐胁迫下通路变化相似[26].
干热胁迫下许多抗旱相关基因被诱导表达,一类是具有保护作用的功能基因,如渗透调节物质、抗氧化物质和其它功能蛋白[27−28];一类是具有调节作用的调节因子,如转录因子和蛋白激酶[29].本研究中,我们发现参与次生代谢物质合成、细胞渗透压调节物质、抗氧化、信号转导相关代谢通路的差异基因显著上调.这些基因中的大部分己经在其它植物响应干旱胁迫的转录表达中被鉴定出来[30−31],表明植物在响应干旱胁迫时具有一些共同的分子响应机制[32].次级代谢产物在植物机体防御、信号转导和抵御逆境胁迫等生命过程中起着重要作用[33−34].干热条件下次生代谢增强,对维持细胞内环境稳定和代谢活动的正常运转,提高植物抵抗干旱胁迫能力具有重要作用[33−36].鸢尾蒜在干热生境下,蔗糖、二羧酸代谢、甘氨酸、丝氨酸和苏氨酸代谢、黄酮和类黄酮、苯丙素、牛磺酸和次牛磺酸代谢通路显著上调.另外,α-亚麻酸代谢、花生四烯酸代谢通路上调,亚麻酸是植物膜脂所含的主要脂肪酸之一,其分解产物茉莉酸是抗逆生长调节物质,是植物适应外界温度逆境的重要物质基础,很可能是植物适应外界不良环境从而调低主代谢(如光合作用减弱)的主要感受器,具有重要的生态和进化意义[37].植物体代谢过程中能够产生对自身造成损伤的活性氧,同时活性氧也是植物受到水分胁迫时的早期产物,作为第二信使激活随后的适应性响应[38−39],诱导抗氧化酶及还原性物质的表达,增强机体清除活性氧的能力,降低活性氧对细胞的膜系统和酶活性的损害[35,40−41].干热生境中,鸢尾蒜过氧物酶体、溶酶体、谷胱甘肽代谢通路相关的多个基因上调,利于清除细胞代谢过程中累积的自由基,减轻细胞所受的干旱胁迫损伤.
植物为适应干旱环境进化出一系列复杂的信号转导机制,干旱刺激被传递到胞内转化为相对应的胞内信号以调控下游反应.植物受到干旱胁迫时,干旱信号被转换为第二信使,如磷酸肌醇和活性氧[42],并调节Ca2+通道[43]以及植物激素的信号转导[44],激活蛋白激酶信号通路和磷酸化级联反应[45−46],最终诱导相关转录因子和胁迫响应基因(如渗透调节物质、抗氧化物质、抗氧化酶)表达[42,45].脱落酸(Abscisic Acid,ABA)在植物生长发育、生物和非生物胁迫的应答中发挥重要调控作用,当植物遭受逆境胁迫,细胞内ABA合成增加,导致气孔关闭及胁迫响应基因表达[47].本研究发现,干热环境中,ABA合成相关基因DN44249−c2−g1和DN49356−c0−g1上调,这有利于调节ABA应答基因表达,增强植物抵抗逆境的能力.蛋白激酶是一类重要的膜蛋白,能接受胞外信号转导并启动响应机制,在植物抗逆反应中具有重要作用[45−47].促分裂原活化蛋白激酶(MAPK)是动植物体中的一类较为保守的丝氨酸/苏氨酸蛋白激酶,主要负责扩大胞外信号的刺激和调节胞间信号的传递,诱导细胞产生对应的生化反应,该信号通路在抵御植物的生物和非生物胁迫(冷、热、高盐、低温、干旱、活性氧胁迫、细菌、真菌侵染等)中发挥了重要的作用[48−49],我们也发现干热生境中鸢尾蒜MAPK信号通路中MPK3基因(DN39790−c2−g1)上调,可能有助于增强机体的防卫能力.
生活周期的可塑性是短生植物适应干热环境的一个重要方式,能迅速适应环境变化进而调节生活周期.研究发现,短生植物在新疆干热夏季到来之前快速完成生活周期;如果环境水热条件适宜,短生植物生活周期将延长,与典型一年生中生草本植物类似或变为二年生植物[17].GO功能基因上下调分析发现细胞结构和组分、分子功能、代谢、调节和刺激响应等生物过程的基因下调数量大于上调,说明干热环境对鸢尾蒜的抑制作用是多方面、复杂的.与之相反,定位、多细胞生物过程、发育过程、繁殖、信号转导等功能组中上调基因数量大于下调,表明干热胁迫下鸢尾蒜通过上调发育、繁殖、信号转导等过程相关的基因表达,促进发育和繁殖,保证鸢尾蒜在干热季到来前,及时完成生活周期;而在环境相对适宜时,鸢尾蒜则更倾向于将代谢和生物量分配于营养生长,这也解释了林下湿润生境中鸢尾蒜个体高度高于干热生境中的个体.目前同一植物不同生活周期的个体是否具有生物学效应的差异,比如种子大小、数量和活力以及对后代生长发育的作用还不清楚,这些问题需要进一步研究.
4 结论
干旱高温能够影响鸢尾蒜植株的光合作用等多个生物学过程,抑制体内糖类和蛋白质的合成,从而使植株生长发育延缓,植株个体矮小.同时,在干热环境下,与植株的渗透调节和抗氧化相关次生代谢通路以及信号转导通路显著上调,表明植株通过激活信号转导、提高渗透调节物质的表达,增加抗氧化物质、抗氧化酶的含量以维持细胞内稳态、结构完整和功能正常,积极适应不利环境,维持正常的生长发育.此外,发育过程和繁殖过程相关基因表达增强,促进了鸢尾蒜植株快速生长发育完成生活周期.
