多囊卵巢综合征并肥胖患者的临床特点及危险因素
2022-02-12万红娇王守俊
万红娇,王守俊
(郑州大学第一附属医院 内分泌及代谢病科,河南 郑州 450000)
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是青春期及育龄期女性常见的生殖内分泌疾病,常表现为临床和(或)生化高雄激素血症、卵巢功能障碍及多囊卵巢形态,临床表现主要包括多毛、痤疮、脱发、月经紊乱、不孕等[1]。根据我国不同地区流行病学调查,PCOS发生率为5%~10%,我国成人汉族群体内发生率为5.6%[2]。50%以上的PCOS患者伴随肥胖,且多为向心性肥胖,较非肥胖患者更易发展为代谢综合征、胰岛素抵抗、糖脂代谢障碍、糖尿病、心血管疾病等,严重威胁女性健康[3]。目前PCOS病因及发病机制暂不完全明确,相关治疗常需个体化。本研究旨在评估PCOS并肥胖患者的临床特点,分析其影响因素,进一步指导临床治疗。
1 对象和方法
1.1 对象根据2003年鹿特丹诊断标准[4],选取2016年1月至2021年9月于郑州大学第一附属医院内分泌及代谢病科住院的362例PCOS患者。排除标准:(1)既往3个月内口服激素类药物、降糖药物、降脂药物、降压药物、免疫抑制剂等;(2)患有已知活动性感染或炎症性疾病,如系统性红斑狼疮、溃疡性结肠炎、克罗恩病等;(3)慢性疾病,如糖尿病、自身免疫性疾病、慢性肝炎、盆腔炎症疾病、血液系统疾病或其他慢性炎症疾病;(4)严重肝、肾功能不全,恶性肿瘤等;(5)其他高雄激素血症相关疾病,如先天性肾上腺皮质增生症、库欣综合征、雄激素分泌性肿瘤等;(6)临床资料不全。最终纳入123例患者,根据我国超重及肥胖指南依据体质量指数(body mass index,BMI)分为两组,BMI<25 kg·m-2为正常体质量组,≥25 kg·m-2为超重/肥胖组。
1.2 资料收集仔细询问相关病史,收集年龄,测量身高、体质量,计算BMI。空腹12 h,清晨取静脉血分别测定卵泡刺激素(follicle stimulating hormone,FSH)、黄体生成素(luteinizing hormone,LH)、睾酮(testosterone,T)、雌二醇(estradiol,E2)、泌乳素(prolactin,PRL)、白细胞计数(white blood cell,WBC)、中性粒细胞绝对值、淋巴细胞绝对值、平均血小板体积(mean platelet volume,MPV)、游离三碘甲腺原氨酸(free triiodothyronine,FT3)、游离甲状腺素(free thyroxine,FT4)、促甲状腺激素(thyroid stimulating hormone,TSH)、总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白(high density lipoprotein cholesterol,HDL)、低密度脂蛋白(low density lipoprotein cholesterol,LDL)、25-羟维生素D3(25-hydroxyvitamin D3,25(OH)D3)。行75 g葡萄糖耐量及胰岛素释放实验,记录空腹血糖(fasting blood glucose,FBG)、空腹胰岛素(fasting insulin,FINS)。计算稳态模型胰岛素抵抗指数(homeostasis model assessment of insulin resistance,HOMA-IR)[5]及中性粒细胞/淋巴细胞绝对值(neutrophil / lymphocyte value,NLR)。性激素及胰岛素测定采用化学发光法,甲状腺激素测定应用化学发光免疫分析法,HDL、LDL采用均相法酶连续循环比色法,TC、TG采用酶比色法,25(OH)D3应用电化学发光免疫分析法,仪器均为全自动分析仪。血常规测定采用血常规分析仪。
1.3 胰岛素抵抗评估HOMA-IR≥2.69为胰岛素抵抗,HOMA-IR<2.69为非胰岛素抵抗。

2 结果
2.1 不同BMI分组间临床资料分析
2.1.1基本情况及慢性炎症分析 123例PCOS患者中,超重/肥胖组72例,占58.54%。与正常体质量组相比,超重/肥胖组WBC、中性粒细胞绝对值、淋巴细胞绝对值、NLR较大,MPV较小,差异有统计学意义(P<0.05)。两组年龄、25(OH)D3相比,差异无统计学意义(P>0.05)。见表1。
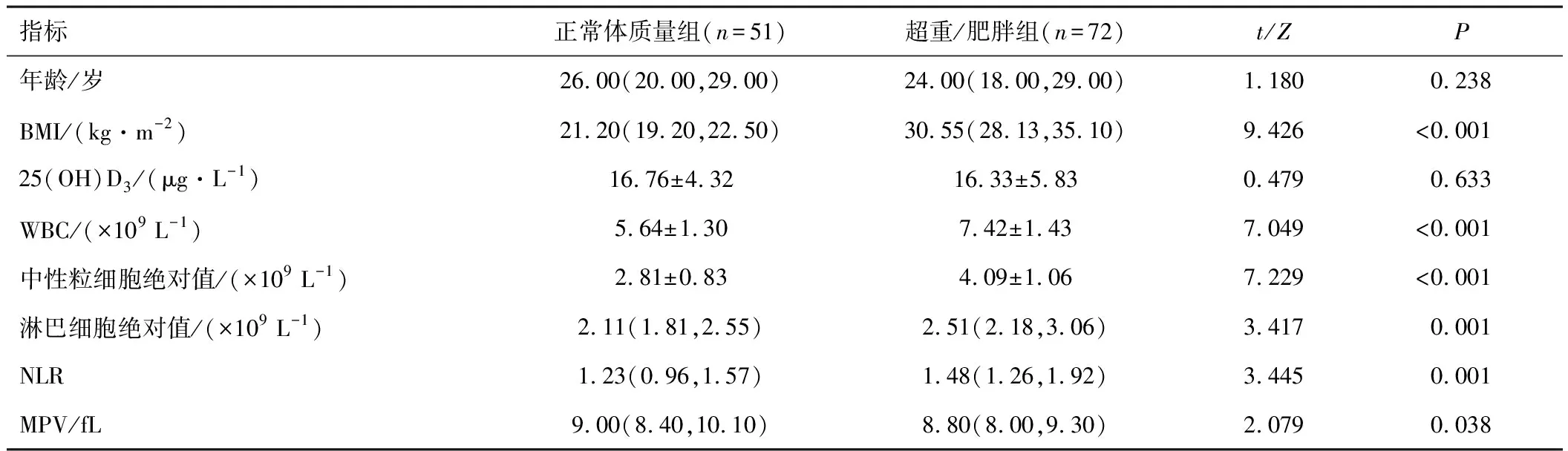
表1 不同BMI分组间基本情况及慢性炎症数据分析
2.1.2性激素及甲状腺激素分析 两组LH、FSH、LH/FSH、E2、T、PRL、FT3、FT4、TSH比较,差异无统计学意义(P>0.05)。见表2。
2.1.3糖脂代谢分析 与正常体质量组相比,超重/肥胖组FINS、HOMA-IR、TG、LDL更高,HDL更低,差异有统计学意义(P<0.05),两组间FBG、TC差异无统计学意义(P>0.05)。超重/肥胖组胰岛素抵抗发生率高于正常体质量组(P<0.05)。见表3。

表2 不同BMI分组间性激素及甲状腺激素水平比较[M(P25,P75)]

表3 不同BMI分组间糖脂代谢比较
2.2 PCOS患者BMI与各指标相关性分析PCOS患者BMI与LH、HDL呈负相关(P<0.05),与WBC、中性粒细胞绝对值、淋巴细胞绝对值、NLR、MPV、FINS、HOMA-IR、TG、LDL呈正相关(P<0.05),未发现BMI与年龄、25(OH)D3、FSH、LH/FSH、E2、T、PRL、FT3、FT4、TSH、FBG、TC的相关性。见表4。

表4 BMI与各指标相关性分析
2.3 PCOS并肥胖相关危险因素分析将两组比较差异有统计学意义的指标纳入二元logistic回归分析,结果显示,FINS、NLR及WBC是PCOS并肥胖患者的独立危险因素(OR值分别为1.524、4.576、2.024,P<0.05)。未发现余指标与PCOS并发肥胖的相关性(P>0.05)。见图1。

图1 FINS、NLR及WBC与PCOS并肥胖患者的相关性分析
3 讨论
PCOS病因及发病机制复杂,目前暂不完全明确,具有异质性,受多种因素影响。目前研究表明,氧化应激、慢性炎症、遗传及环境、基因等因素在PCOS发病过程中发挥重要作用[6]。超过50%的PCOS患者伴随肥胖[3]。本研究结果显示,超重/肥胖组PCOS占58.54%,这与先前的研究结果[7]是一致的。
维生素D参与钙代谢,已被证实与多种疾病相关,25(OH)D3是体内维生素D状态的功能指标。目前许多研究已经证明其与PCOS多种临床表现密切相关,25(OH)D3缺乏在PCOS患者中常见,超过60%的PCOS患者体内25(OH)D3水平低于20 μg·L-1[7]。本研究中维生素D缺乏患者96例,占78%,这与先前研究结果大致相同[8-9]。Yildizhan等[7]临床研究显示,PCOS患者BMI与25(OH)D3水平呈负相关。本研究也发现25(OH)D3水平随BMI升高而下降。该研究中正常体质量组25(OH)D3水平与超重/肥胖组比较无明显差异,也有部分研究发现25(OH)D3水平在正常体质量与超体质量组间无差异[10],这与研究人群的选择有关。与体质量正常组相比,肥胖患者饮食、活动及维生素D生物活性下降等多种因素均可导致25(OH)D3水平下降。因此,对于PCOS并肥胖患者,需密切监测维生素D水平,必要时通过口服补充。目前关于维生素D治疗对于PCOS患者代谢及激素改变的研究较多,可以确定其有效性。
先前研究已指出慢性炎症与PCOS的相关性[11],NLR、MPV作为新的炎症标志物得到越来越多的关注,已有研究表明PCOS患者MPV及NLR升高[12-13],肥胖患者也存在低度炎症,我们合理猜测PCOS并肥胖患者存在双重效应。本研究中超重/肥胖组WBC、中性粒细胞绝对值、淋巴细胞绝对值、NLR及MPV均高于正常体质量组。在相关性分析中,上述血常规指标均与BMI呈正相关,表明肥胖可加重PCOS患者体内炎症状态。同时,该研究发现WBC及NLR是PCOS患者并发肥胖的独立危险因素,每升高1个单位,PCOS并发肥胖的危险分别增加1.024、3.576倍。在后续研究中可增加其他炎症因子测定,增加研究可信度。
高雄激素血症是PCOS的主要特征之一,可增加腹部的脂肪沉积,又触发多种机制导致雄激素进一步增加,这是一个恶性循环。研究表明肥胖可显著提高PCOS患者雄激素水平[14]。本研究中超重/肥胖组T水平稍高于正常体质量组,但差异无统计学意义,这可能与采血周期密切相关,后续研究可严格规定取样时间,增加样本可信度。本研究发现LH水平与BMI呈负相关,但超重/肥胖组LH水平与正常体质量组无明显差异,由此说明体质量可能并不是影响LH变化的单一因素,同时BMI并不是评判肥胖的金标准。研究发现TSH可作用于脂肪细胞表面的TSH受体,从而诱导其增殖分化,进一步导致肥胖的发生[15]。本研究中超重/肥胖组TSH水平较高,但差异无统计学意义,后续可扩大样本量做进一步研究。
肥胖患者特别是腹型肥胖,通过增强体内多种代谢物的可用性影响胰岛素的代谢和分泌[16],与非肥胖患者更容易发生胰岛素抵抗及高胰岛素血症,本研究发现肥胖并胰岛素抵抗患者占68.06%,差异有统计学意义。同时先前研究发现,以全身性高胰岛素血症为特征的疾病如肥胖症并发PCOS的概率增加。西班牙的一项针对绝经前超重及肥胖女性的调查研究发现,PCOS的发生率为28.3%,较消瘦型(5.5%)明显增加[17]。高胰岛素血症通过多种机制增加雄激素水平,而这进一步增加肥胖概率,为一恶性循环。本研究中超重/肥胖组FINS明显升高,且FINS为PCOS并发肥胖的独立危险因素,每增加1个单位,并发肥胖的风险增加52.4%。
综上所述, PCOS并发肥胖患者更易发生胰岛素抵抗、糖脂代谢障碍、高雄激素血症、慢性炎症状态,并可相互影响,进一步增加治疗复杂性。因此,无论是否患有PCOS,均应提高体质量管理概念,改善饮食和生活习惯,严格控制体质量变化。
