成熟度指数对不同品种橄榄油脂肪酸、酚类化合物及风味属性的影响
2022-02-12吕孝飞马君义郭俊炜杨立华任晓霞雍巧宁孔维宝
吕孝飞,马君义,郭俊炜,杨立华,任晓霞,雍巧宁,孔维宝,邓 煜
(1.西北师范大学 生命科学学院,兰州 730070; 2.陇南市经济林研究院 油橄榄研究所,甘肃 武都 746000)
油橄榄(OleaeuropaeaL.)属木犀科木犀榄属常绿乔木,是一种重要的木本油料植物,主要分布于西班牙、意大利、希腊等地中海沿岸的国家[1]。我国自1964年开始引进和栽培油橄榄,主要种植于四川、云南和甘肃等干旱和炎热的山谷地带,特别是在白龙江、嘉陵江和金沙江流域[2]。1998年,国际油橄榄理事会将甘肃陇南武都划入世界油橄榄分布图。目前,武都已成为我国最大的油橄榄种植和加工基地[3]。
橄榄油是一种通过物理冷压技术从新鲜油橄榄果实中提取的植物油,富含均衡的脂肪酸、抗氧化酚类化合物、维生素、色素和挥发性化合物,被誉为“飘香的软黄金”[4]。临床研究证明,橄榄油中较高比例的单不饱和脂肪酸(MUFA)可降低心血管疾病的风险,降低血液中低密度脂蛋白胆固醇水平,而酚类化合物具有降低冠心病风险,预防某些癌症,抗菌和抗病毒活性等作用[5-7]。橄榄油中的脂肪酸、抗氧化性物质(极性酚类化合物和生育酚)、挥发性风味物质和色素的含量受到采收时间、品种、气候环境和加工条件的影响[8-9]。目前,国内关于油橄榄的研究主要集中在果实含油率、橄榄油脂肪酸组成和活性成分分析等方面[10-11],而基于不同品种和不同果实成熟度指数的橄榄油脂肪酸、酚类化合物和风味属性进行品质分析的研究少有报道。本文以甘肃陇南武都引种栽培的‘城固32号’和‘莱星’2个品种的油橄榄果为研究对象,分析不同品种、不同成熟度指数对橄榄油脂肪酸、酚类化合物及风味属性的影响,为确定油橄榄果实的最佳采收时间,揭示油橄榄果实的品质形成,开展橄榄油真伪鉴别与品牌区分提供参考。
1 材料与方法
1.1 实验材料
1.1.1 原料与试剂
‘城固32号’(Chenggu 32)和‘莱星’(Leccino)油橄榄果实,采自甘肃省陇南市油橄榄研究所种质资源基因库(33°24′03″N,104°53′30″E,海拔1 036~1 048 m,年平均降雨量为468 mm,主要集中在6—9月;年气温在-7~38.2℃,年平均气温15.3℃;年平均相对湿度56.6%,日照时间1 871 h,沙质土壤pH为7.9)。油橄榄树树龄均为10年,间距为4 m×7 m,每年修剪,在干旱季节进行补充灌溉。于2019年9—11月在5棵树势和挂果量基本相同的油橄榄树冠中部的前后左右4个方位随机采摘健康无损的油橄榄果实,每样每次2.5 kg,并依国际油橄榄理事会COI/OH/Doc. No. 1/2011计算果实的成熟度指数,见表1。
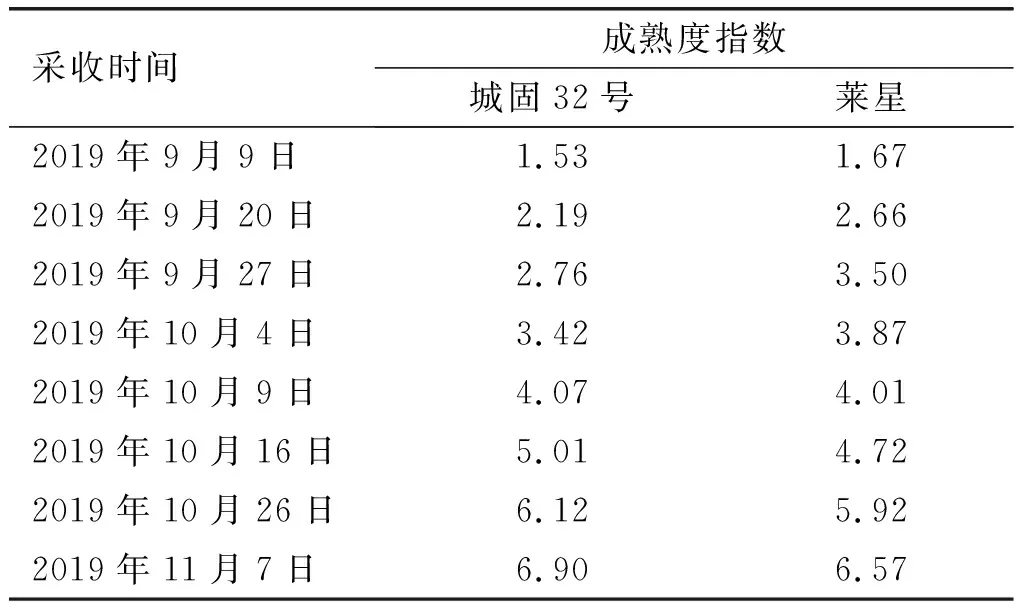
表1 果实采收时间与相应的成熟度指数
10种脂肪酸甲酯混标(C16~C22,美国NU-CHEK-PREP公司),羟基酪醇(批号MUST-20052802)、酪醇(批号MUST-19111609)、橄榄苦苷(批号MUST-20052502)及木犀草素(批号MUST-19102418)对照品(纯度≥98%,成都曼斯特生物科技有限公司),香草酸对照品(批号5282,纯度98.9%,上海诗丹德标准技术服务有限公司),木犀草苷对照品(批号20031803,纯度98%,北京诺博莱德科技有限公司),没食子酸对照品(批号20160925,纯度99.9%,北京坛墨质检科技有限公司),色谱纯甲醇(批号20190426016,山东禹王和天下新材料有限公司),石油醚(沸程30~60℃)、甲醇、碳酸钠、福林酚、三氯化铝、氢氧化钠、无水硫酸钠等均为分析纯。
1.1.2 仪器与设备
Trace 1300 ISQ型气相色谱-质谱联用仪和UltiMate 3000型高效液相色谱仪(美国Thermo Fisher Scientific),MC2型Abencor橄榄分析系统(西班牙Ingenieria公司),UV-2800A型紫外-可见分光光度计(尤尼柯上海仪器有限公司),PEN 3.5型电子鼻气体指纹分析仪(德国Airsense公司)。PEN 3.5型电子鼻E-Nose的10种金属氧化物半导体传感器及其敏感物质见表2。

表2 PEN 3.5型电子鼻的10种传感器及其敏感物质
1.2 实验方法
1.2.1 橄榄油的提取
通过MC2型Abencor橄榄分析系统,在锤磨机中粉碎至少2.5 kg的橄榄果并混匀。称取750 g样品到融合罐中,在30℃、50 r/min条件下搅拌融合60 min,之后加入30℃的水30 mL继续融合30 min。融合后的样品置于离心机中以5 000 r/min离心3 min,再加入30℃的水50 mL,重复上述步骤两次,合并提取液,静置后吸取上层油样于棕色玻璃瓶中,在4℃存储备用。平行操作3组。
1.2.2 脂肪酸组成与含量的分析
参考文献[12]的方法对橄榄油进行脂肪酸组成和含量分析。
1.2.3 多酚类化合物的提取与分析
1.2.3.1 多酚类化合物的提取
依国际油橄榄理事会COI/T.20/DOC.29/Rev.1 2017方法进行多酚类化合物的提取。
1.2.3.2 多酚类化合物组成和含量的测定
采用UltiMate 3000型高效液相色谱仪和紫外检测器,在Silversil C18色谱柱(4.6 mm×250 mm,5 μm)、进样量5 μL、流速1.0 mL/min、等度洗脱条件下测定多酚类化合物组成和含量。
其他测定条件:对于羟基酪醇、酪醇、香草酸及木犀草苷,流动相为30%甲醇+70%体积分数为0.2%的乙酸,柱温35℃,检测波长280 nm;对于橄榄苦苷、木犀草素,流动相为50%甲醇+50%体积分数为0.1%的磷酸,柱温40℃,检测波长分别为231 nm和351 nm。
1.2.3.3 总酚含量的测定
采用Folin-Ciocalteu显色法[13]。在10 mL容量瓶中依次加入1 mL不同质量浓度的没食子酸标准溶液和0.5 mL福林酚试剂及2 mL 7.5%的Na2CO3溶液,超纯水定容,避光反应2 h后于765 nm处测定吸光值。以吸光值(X)为横坐标,没食子酸质量浓度(Y)为纵坐标绘制标准曲线,得到回归方程Y=7.374 1X-0.005(R=0.999 3)。用多酚化合物提取液代替没食子酸标准溶液,按上述操作测定吸光值,按照回归方程计算橄榄油中的总酚含量。
1.2.4 风味识别与区分
取10 mL橄榄油样品于顶空进样瓶中,30℃下温育30 min,取瓶内顶空气体进行E-Nose检测,检测条件为样品采集70 s,传感器清洗120 s,调零5 s,进样准备5 s,进样流量300 mL/min。
1.2.5 数据处理与统计分析

2 结果与分析
2.1 脂肪酸组成与含量
橄榄油中主要脂肪酸含量随成熟度指数的变化见图1。由图1可知,‘城固32号’和‘莱星’橄榄油的主要脂肪酸为油酸、亚油酸、硬脂酸和亚麻酸,与张东等[14]的研究结果一致。‘城固32号’和‘莱星’橄榄油中油酸含量最高,分别为59.25%~61.92%和69.13%~72.32%,亚油酸含量分别为15.06%~20.18%和5.68%~7.49%,硬脂酸含量分别为2.03%~2.59%和1.82%~2.13%,亚麻酸含量分别为0.96%~1.50%和0.57%~0.80%。除亚麻酸外,橄榄油样品其余脂肪酸含量均在GB/T 23347—2009《橄榄油、油橄榄果渣油》规定的标准范围内。

橄榄油中饱和脂肪酸(SFA)、不饱和脂肪酸(UFA)含量以及单不饱和脂肪酸/多不饱和脂肪酸(MUFA/PUFA)和油酸/亚油酸值随成熟度指数的变化见图2。由图2可知:随着成熟度指数的增大,‘城固32号’和‘莱星’橄榄油中SFA含量分别从20.37%和20.50%降低到17.87%和18.24%,UFA含量分别从80.01%和79.19%升高到81.95%和81.69%;‘城固32号’中MUFA/PUFA值从3.85降低到2.88,而‘莱星’从8.74升高到10.22;‘城固32号’中油酸/亚油酸值从4.09降低到2.94,而‘莱星’从9.49升高到10.70,且‘莱星’MUFA/PUFA和油酸/亚油酸值高于‘城固32号’。

Alowaiesh等[15]研究表明,橄榄油脂肪酸组成及含量受到品种、采收时间等的影响。本研究中‘城固32号’橄榄油的硬脂酸、亚油酸和亚麻酸含量较高,而‘莱星’橄榄油的油酸含量较高。随着成熟度指数的增大,‘城固32号’橄榄油中的硬脂酸、油酸、亚麻酸、SFA含量及MUFA/PUFA、油酸/亚油酸值呈降低趋势,亚油酸和UFA含量呈升高趋势,而‘莱星’橄榄油中亚油酸、亚麻酸和SFA含量呈降低趋势,油酸和UFA含量及MUFA/PUFA、油酸/亚油酸值呈升高趋势,与钟诚等[16]关于陇南地区‘莱星’和‘城固32号’等品种橄榄油脂肪酸组成及含量的研究结果相似。由图1可知,‘城固32号’和‘莱星’橄榄油中油酸和亚油酸含量变化趋势相反,油酸含量的降低和亚油酸含量的升高与油酸去饱和酶的活性有关,该酶可以将油酸转化为亚油酸[17]。油酸/亚油酸和MUFA/PUFA值不仅是鉴别橄榄油品种的依据,也是判定橄榄油稳定性的一个重要参数,比值越高说明橄榄油的稳定性越好[18]。本研究中,‘莱星’橄榄油较‘城固32号’橄榄油具有更高的油酸/亚油酸和MUFA/PUFA值,据此比值可鉴别‘莱星’和‘城固32号’橄榄油。同时‘城固32号’橄榄油中油酸/亚油酸和MUFA/PUFA值随成熟度指数的增大呈下降趋势,而‘莱星’橄榄油与之相反,呈上升趋势,这表明为了提高橄榄油的稳定性,有效延长货架期,‘城固32号’可在较低成熟度指数时提早采收,而‘莱星’可在较高成熟度指数时错峰延后采收。
对不同成熟度指数的‘城固32号’和‘莱星’橄榄油脂肪酸组成及含量进行PCA分析,结果见图3。由图3可知,2个主成分的累积方差贡献率为73.97%,说明提取的信息能反映原始数据大部分信息。得分散点图的各象限中数据点分布越离散其差异越大,越接近其差异越小。‘城固32号’数据点分布较离散,说明不同成熟度指数‘城固32号’橄榄油的脂肪酸组成及含量差异相对较大;而‘莱星’数据点分布相对集中,说明不同成熟度指数‘莱星’橄榄油的脂肪酸组成及含量差异较小;但‘城固32号’和‘莱星’数据点并未重合,彼此区分明显,表明可以根据脂肪酸组成和含量有效区分不同成熟度指数的‘城固32号’和‘莱星’橄榄油。

注:图中数字代表不同的果实成熟度指数。下同
2.2 多酚类化合物组成与含量
‘城固32号’和‘莱星’橄榄油中多酚类化合物的组成及含量随成熟度指数的变化情况见表3。

表3 橄榄油中多酚类化合物的组成及含量随成熟度指数的变化情况
由表3可知,‘城固32号’和‘莱星’橄榄油中,主要多酚类化合物为羟基酪醇、酪醇和橄榄苦苷,而香草酸、木犀草苷和木犀草素的含量相对较低,与其他报道的研究结果相似[19-20]。‘城固32号’和‘莱星’橄榄油中橄榄苦苷含量分别为0.36~34.96 mg/kg和未检出~22.63 mg/kg,‘莱星’在成熟度指数为4.01和4.72时未检测到橄榄苦苷,可能是果实含水量导致此时多酚类物质的分配不同,Alloggio等[21]的研究也证实这一点。‘城固32号’和‘莱星’橄榄油中羟基酪醇的含量分别为0.45~3.77 mg/kg和0.24~1.18 mg/kg;酪醇的含量分别为2.84~12.97 mg/kg和1.72~12.39 mg/kg;香草酸的含量分别为0.66~2.63 mg/kg和1.06~1.82 mg/kg;木犀草素与其他酚类化合物相比含量较低,分别为未检出~1.02 mg/kg和0.10~0.93 mg/kg,‘城固32号’在成熟度指数为1.53时未检测到木犀草素;木犀草苷的含量在整个果实成熟过程中均为0.22 mg/kg左右。‘城固32号’橄榄油中的总酚含量变化范围为54.66~82.89 mg/kg,而‘莱星’为54.37~90.13 mg/kg。
橄榄油中多酚类化合物不仅可提高其抗氧化活性,也赋予了橄榄油特有的苦味,还会影响橄榄油的风味[22]。由表3可知,随着成熟度指数的增大,2个品种橄榄油中酪醇含量总体呈减少趋势,香草酸和木犀草素含量稍有增加,木犀草苷含量保持不变,羟基酪醇含量在‘城固32号’中总体逐渐减少,而在‘莱星’中总体逐渐增加,橄榄苦苷含量则呈现波动性变化。多酚类化合物的含量因油橄榄品种和果实成熟度指数的不同而存在差异,且这种差异与遗传有关[23]。Baccouri等[24]研究发现,总酚含量在果实发育期逐渐增加直至果实开始转色,而在果实成熟阶段逐渐减少。本研究发现,随着果实成熟度指数的增加,‘城固32号’和‘莱星’橄榄油中总酚含量总体均呈减小趋势。
对不同品种、不同成熟度指数的橄榄油多酚类化合物组成及含量进行PCA分析,结果如图4所示。

图4 基于多酚类化合物组成及含量的PCA得分散点图
由图4可知,2个主成分的累积方差贡献率为74.69%,说明提取的信息能反映原始数据的大部分信息。除成熟度指数为2.76的‘城固32号’和成熟度指数为3.50的‘莱星’及成熟度指数分别为5.01和6.90的‘城固32号’数据点存在一定程度的重合外,其余各数据点间的离散程度较大,彼此区分明显,表明可以根据多酚类化合物组成及含量区分不同成熟度指数的‘城固32号’橄榄油或不同成熟度指数的‘莱星’橄榄油。
2.3 风味属性
橄榄油风味是判定橄榄油感官品质的重要依据,E-Nose的10种金属氧化物半导体传感器对橄榄油中风味物质产生的信号雷达图如图5所示。
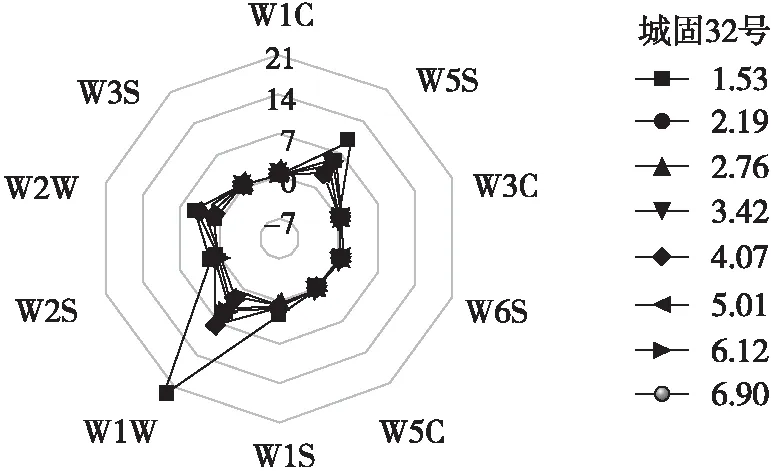
由图5可知,‘城固32号’和‘莱星’橄榄油在不同成熟度指数时的信号响应值存在差异,且橄榄油风味物质的E-Nose信号响应值随油橄榄成熟度指数的升高而明显降低,与Kalua等[25]关于果实成熟状态、品种和化学成分对橄榄油风味影响的研究结果相似。本研究中W1W、W2W和W5S传感器在不同成熟度指数的橄榄油中信号响应值最强,表明这3种传感器对橄榄油顶空气体的信号响应最敏感。而W1S、W1C、W6S、W2S和W3S传感器信号响应值在不同成熟度指数的橄榄油中较W1W、W2W和W5S传感器敏感度稍低,也存在部分差异。‘城固32号’和‘莱星’橄榄油在传感器W1W信号响应值范围分别为2.62~22.79和4.37~10.77,W2W信号响应值范围分别为1.47~5.24和2.16~6.21,W5S信号响应值范围分别为2.99~10.16和4.30~7.74,W1S信号响应值范围分别为1.63~2.61和1.81~2.41,W1C信号响应值范围分别为0.61~0.85和0.75~0.86,W6S信号响应值范围分别为1.03~1.26和1.14~1.33,W2S信号响应值范围分别为1.20~2.01和1.11~1.27,W3S信号响应值范围分别为1.00~1.11和1.02~1.05。W1W信号响应值在不同成熟度指数时的变化较W2W和W5S更为明显。成熟度指数为1.53的‘城固32号’橄榄油E-Nose的W1W和W5S信号响应值强于成熟度指数为1.67的‘莱星’橄榄油,这可能归因于‘城固32号’在此成熟度指数时含有较高含量的羟基酪醇、酪醇和橄榄苦苷等酚类化合物,与Bendini等[26]有关不同酚类化合物含量的橄榄油与其感官特性的相关性研究报道结果一致。
对‘城固32号’和‘莱星’橄榄油的风味物质进行PCA分析,结果如图6所示。

图6 基于风味属性的PCA得分散点图
由图6可知,2个主成分的累积方差贡献率为87.95%,说明提取的信息能反映原始数据大部分信息。不同成熟度指数的‘城固32号’和‘莱星’橄榄油数据点分布较离散,彼此区分明显。综合Haddi等[27]利用E-Nose并结合PCA和LDA分析区分不同产地橄榄油以及田维芬等[28]基于E-Nose和GC-MS研究不同品牌橄榄油挥发性风味物质的结果,可以利用风味物质的E-Nose信号响应值差异结合PCA分析来区分不同成熟度指数的‘城固32号’橄榄油或不同成熟度指数的‘莱星’橄榄油。
3 结 论
油橄榄品种和成熟度指数影响橄榄油的脂肪酸、酚类化合物及风味属性。‘城固32号’和‘莱星’橄榄油的主要脂肪酸是油酸、硬脂酸、亚油酸和亚麻酸,其含量随成熟度指数发生变化,除亚麻酸外,其余脂肪酸含量均在GB/T 23347—2009《橄榄油、油橄榄果渣油》规定的标准范围内。在研究的成熟度指数范围内,‘莱星’橄榄油较‘城固32号’橄榄油具有更高的MUFA/PUFA和油酸/亚油酸值,其储运稳定性更好,货架期更长。同时,可用油酸/亚油酸和MUFA/PUFA值区分‘城固32号’和‘莱星’橄榄油。成熟度指数对橄榄油酚类化合物含量的影响因品种而异,但木犀草苷含量基本不受果实成熟度指数的影响。橄榄油风味物质的E-Nose信号响应值随油橄榄果实成熟度指数的升高而明显降低。利用橄榄油中脂肪酸和酚类化合物的组成与含量以及风味属性的信号响应值差异结合PCA分析可有效鉴别和区分不同成熟度指数的‘城固32号’和‘莱星’橄榄油。
