自身免疫性肝炎诊断和治疗指南(2021)
2022-02-12中华医学会肝病学分会
中华医学会肝病学分会
1 概述
自身免疫性肝炎(autoimmune hepatitis,AIH)的临床特点包括血清氨基转移酶水平升高、高免疫球蛋白G(IgG)血症、血清自身抗体阳性,肝组织学上存在中重度界面性肝炎等。早期诊断和恰当治疗可显著改善AIH患者的生存期和生活质量,减轻社会医疗负担。
2015年由中华医学会肝病学分会、中华医学会消化病学分会和中华医学会感染病学分会组织国内有关专家制订了我国首部《自身免疫性肝炎诊断和治疗共识(2015)》[1],在规范我国AIH的诊断和治疗方面发挥了积极作用。在此基础上,中华医学会肝病分会组织有关专家结合国内外最新进展制定本部指南,旨在进一步提高我国AIH诊治水平。指南中提及的证据和推荐意见按照GRADE系统(推荐分级的评估、制定和评价)进行分级(表1)。
2 流行病学
AIH可以在任何年龄和种族人群中发病。欧洲与亚洲人群中以女性患者居多,发病率和疾病状态存在种族差异[2-3]。在欧洲国家,AIH的时点患病率为10/10万人~25/10万人。新西兰一项前瞻性研究[4]显示2008年至2010年AIH的发病率为1.37/10万人,而在2014年至2016年增长到2.39/10万人。同样,日本的两次流行病学调查发现2004年AIH的时点患病率为8.7/10万人,2016年时点患病率已经增长至23.9/10万人[5]。此外,AIH患者性别比例也发生了明显变化。在日本,男女比例由1∶6.9(2004年)增长为1∶4.3(2016年)。

表1 推荐意见的证据等级和推荐强度等级
来自其他研究[6]中AIH患者的男女比例由1∶9~1∶10增长到1∶4~1∶7。最近,我国开展的一项包含1020例AIH患者的单中心回顾性观察研究[7]显示,AIH患者的峰值年龄为55(6~82)岁,在20岁有小的波峰,男女比例为1∶5。
3 诊断与鉴别诊断
AIH的诊断主要是基于临床表现、实验室检查和肝组织学特征性表现,并排除其他肝病病因。
3.1 临床表现 多数AIH患者无明显症状或仅出现乏力等非特异性症状。大部分AIH患者隐匿起病,少部分患者为急性发作,其中部分为慢性AIH的急性加重,甚至发展为急性肝功能衰竭。约1/3的患者初诊即为肝硬化表现。
3.2 实验室检查
血清氨基转移酶水平升高、自身抗体阳性、IgG和/或γ-球蛋白水平升高是 AIH 的重要实验室特征。
3.2.1 血清生物化学指标 AIH的典型血清生物化学指标异常主要表现为肝细胞损伤型改变,血清丙氨酸转氨酶(ALT)和天冬氨酸转氨酶(AST)水平升高,而血清碱性磷酸酶(ALP)和γ-谷氨酰转移酶(GGT)水平基本正常或轻微升高。病情严重或急性发作时血清总胆红素水平可显著升高。
3.2.2 自身抗体与分型 大多数AIH患者血清中存在一种或多种高滴度的自身抗体,但这些自身抗体大多缺乏疾病特异性。AIH可根据自身抗体的不同分为两型:抗核抗体(antinuclear antibodies,ANA)和/或抗平滑肌抗体(anti-smooth muscle antibodies,ASMA)阳性者为1型AIH,约占AIH病例的90%;抗肝肾微粒体抗体-1型(anti-liver kidney microsome-1,抗LKM-1)和/或抗肝细胞溶质抗原-1型(anti-liver cytosol-1,抗LC-1)阳性者为2型AIH。ASMA的主要靶抗原是微丝中的肌动蛋白,又可分为G-肌动蛋白和F-肌动蛋白。高滴度抗F-肌动蛋白诊断AIH的特异度较高。抗LKM-1的靶抗原为细胞色素P450 2D6。在成人AIH患者中,抗 LKM-1对AIH的敏感度较低(1%),而在儿童AIH患者中敏感度较高(13%~38%)。约10%的2型AIH患者中抗LC-1是唯一可检测到的自身抗体,且抗LC-1与AIH的疾病活动度和进展有关。抗可溶性肝抗原抗体(anti-soluble liver antigen,抗SLA)诊断AIH时特异度较高,并具有一定预后预测价值,但我国AIH患者中仅2.5%呈SLA阳性。我国一项单中心临床研究提示约10.2%的AIH患者起病时ANA、ASMA阴性,后续随访期间有患者出现ANA抗体阳性。抗体阴性的AIH患者相较于经典AIH患者,其血清IgG水平更低且起病时可能处在纤维化进展期,但两组患者在起病时组织学炎症程度及半年内生化应答缓解率方面均无统计学差异。及时明确诊断并启动治疗,有助于改善抗体阴性AIH患者的预后[8]。
3.2.3 血清免疫球蛋白 IgG和/或γ-球蛋白升高是AIH特征性的血清免疫学改变之一。血清IgG水平可反映肝内炎症活动,经免疫抑制治疗后可逐渐恢复正常。来自国内的大型队列研究[7]结果表明AIH患者初诊和治疗3个月后较低的血清IgG 水平与生化和组织学缓解相关。
3.3 肝组织学检查
肝组织学检查对AIH诊治的重要性表现为:(1)提供AIH患者确诊依据,特别是在自身抗体阴性患者;(2)有助于与其他肝病(如药物性肝损伤、Wilson病等)鉴别;(3)明确有无合并其他自身免疫性肝病,如原发性胆汁性胆管炎(primary biliary cholangitis,PBC)和原发性硬化性胆管炎(primary sclerosing cholangitis,PSC)重叠存在;(4)评估分级和分期;(5)治疗后复查有助于判断合适的停药时机,如Ishak评分系统中肝炎活动度(hepatitis activity index,HAI)<4分时停药相对安全[9]。因此,建议尽可能对所有拟诊AIH且无肝活检绝对禁忌证的患者行肝组织学检查,可采用的方法包括:经皮肝活检、经颈静脉肝活检以及腹腔镜下肝活检等。AIH组织学以肝细胞损伤为主,病理学特点如下。
3.3.1 门管区表现 (1)界面性肝炎:在组织学上,肝细胞和门管区/纤维间隔交界处称为“界板”,炎症细胞由该区域向小叶内延伸,导致相邻肝细胞呈单个或小簇状坏死、脱落,称为界面性肝炎。界面性肝炎是AIH的组织学特征之一,中重度界面性肝炎支持AIH的诊断,但需排除其他慢性肝病如病毒性肝炎、药物性肝损伤、Wilson病等。(2)淋巴-浆细胞浸润:门管区及其周围浸润的炎性细胞主要为淋巴-浆细胞。浆细胞评分>3分(即浆细胞占炎症细胞≥20%)或小叶内/门管区见浆细胞灶(≥5个浆细胞聚集为1灶)有助于AIH的诊断,但浆细胞缺如不能排除AIH[10]。
3.3.2 小叶内表现 未经治疗的AIH小叶内常出现中等程度炎症。当炎症明显时,可见3区坏死/桥接坏死。肝细胞受炎症细胞攻击后出现水肿、变性、坏死,再生的肝细胞呈假腺样排列,称为“玫瑰花环样”结构。穿入现象是指淋巴细胞进入肝细胞后在其周围形成空晕样结构,发生穿入的细胞主要为CD8+T细胞,可导致肝细胞凋亡[11]。
3.3.3 特殊类型AIH组织学表现 (1)急性AIH。急性AIH可分为两大类:①无慢性肝炎病史,以急性肝损伤为首发症状的AIH;②以慢性肝炎表现的AIH急性发作或恶化甚至发展为肝功能衰竭。肝组织学上,前者可出现中央静脉炎伴周边坏死(3区坏死)、桥接坏死伴小叶内炎症细胞浸润;后者3区坏死相对较少,可有多核肝巨细胞、多灶融合坏死,甚至亚大块或大块坏死[12-13]。(2)AIH相关肝硬化。未经治疗的AIH可进展为肝硬化,这一阶段炎症往往减轻或者耗尽,门管区/纤维间隔轻度非特异性炎症伴有轻度界面性肝炎,诊断需要结合临床。
3.4 诊断标准 国际自身免疫性肝炎小组(International Autoimmune Hepatitis Group,IAIHG)于1993制定了AIH描述性诊断标准和诊断积分系统,并于1999年进行了修订(表2)[14]。1999年更新的积分系统根据患者是否已接受糖皮质激素治疗分为治疗前和治疗后评分。
2008年IAIHG提出了AIH简化诊断积分系统[15](表3)。简化诊断积分系统分为自身抗体、血清IgG水平、肝组织学改变和排除病毒性肝炎等4个部分。我国一项总数为405例慢性肝病患者(其中1型AIH患者127例)的多中心临床研究结果显示[16],简化积分系统确诊AIH的敏感度为90%,特异度为95%,可较好地应用于临床诊断。简化积分系统容易漏诊部分不典型患者,如自身抗体滴度低或阴性和/或血清IgG水平较低甚至正常的患者。因此,对于疑似AIH且采用简化诊断积分不能确诊的患者,建议再以综合诊断积分系统进行综合评估以免漏诊。由于自身抗体检验方法的优化,近期欧洲学者提出基于ELISA的ANA和ASMA(F-actin)检测也是AIH自身抗体评估的潜在可靠替代方法,建议将这些检测方法纳入AIH诊断的简化标准[17]。
3.5 鉴别诊断 ANA和ASMA等自身抗体缺乏疾病特异性,低滴度的自身抗体也可见于其他多种肝内外疾病如病毒性肝炎、代谢相关性脂肪性肝病、Wilson病等肝病以及乳糜泻、系统性红斑狼疮、类风湿性关节炎等自身免疫性疾病。因此,需进行仔细的鉴别诊断(表4)。
推荐意见1:对于拟诊AIH的患者,应检测自身抗体如ANA、ASMA、抗SLA/LP、抗LKM-1和抗LC-1等,并常规检测血清IgG和/或γ-球蛋白水平。(B1)
推荐意见2:应对无禁忌证的拟诊AIH患者行肝组织学检查(可经皮或经颈静脉)。界面性肝炎、淋巴-浆细胞浸润、肝细胞玫瑰花环样改变和淋巴细胞穿入现象等支持AIH诊断。(B1)
推荐意见3:应结合血清氨基转移酶升高、血清自身抗体阳性和IgG升高及特征性肝组织学改变并排除其他病因后,进行AIH综合诊断。(A1)
推荐意见4:AIH简化积分系统可用于我国AIH患者的诊断,AIH综合评分系统可用于非典型、复杂病例的诊断,或用于临床研究。(B1)
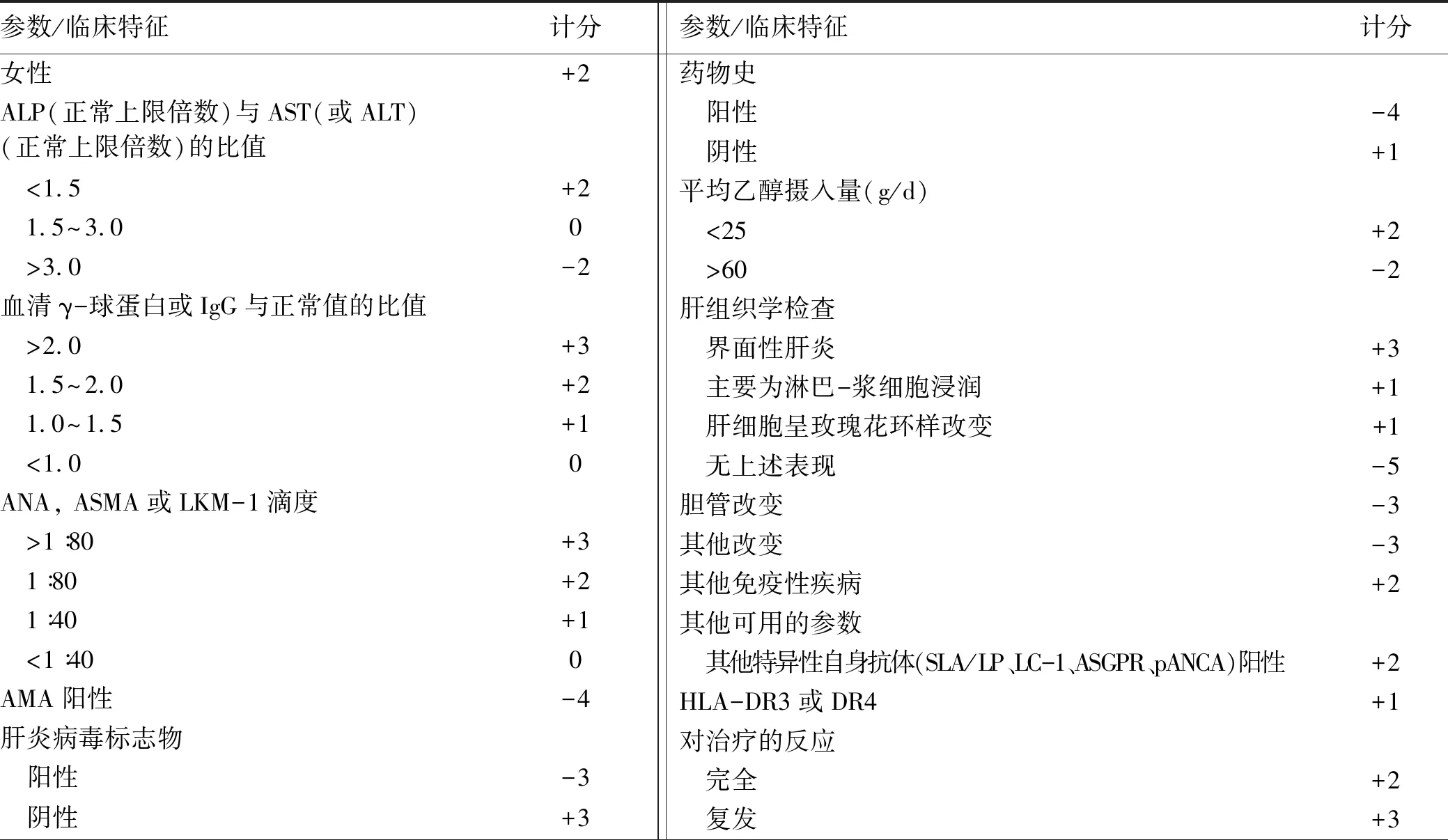
表2 AIH综合诊断积分系统(1999年)

总积分的解释治疗前治疗后 明确的AIH≥16 明确的AIH≥18 可能的AIH10~15 可能的AIH12~17

表3 IAIHG的AIH简化诊断标准
4 治疗
AIH患者如不进行临床干预,可迅速进展为肝硬化或终末期肝病。目前主要采用非特异性免疫抑制:泼尼松(龙)(prednisone/prednisolone)联合硫唑嘌呤(azathioprine,AZA)治疗或者泼尼松(龙)单药治疗作为AIH的标准治疗方案。上述方案能显著改善大多数中重度AIH患者的肝生化指标并延长生存期[18]。但至少有10%~15%的患者对标准治疗方案应答不佳。另有部分患者因不能耐受药物副作用或停药造成复发。AIH的总体治疗目标是获得并维持肝组织学缓解、防止进展为肝硬化和/或肝功能衰竭,进而提高患者的生存期和生活质量,生化缓解定义为血清氨基转移酶(ALT和AST)以及IgG水平均恢复正常。肝组织学缓解定义为肝内炎症消失或轻微(Ishak评分系统HAI<4分或Scheuer分级系统G≤1)。
4.1 治疗指征 所有活动性AIH患者均应接受免疫抑制治疗,并可根据疾病活动度调整治疗方案和药物剂量。(1)建议中度以上炎症活动的AIH患者[血清氨基转移酶水平>3×正常值上限(ULN)、IgG>1.5×ULN和/或中重度界面性肝炎]接受免疫抑制治疗。急性表现(ALT或者AST>10×ULN)或重症AIH患者[伴国际标准化比率(INR)>1.5]应及时启动免疫抑制治疗,以免进展至肝功能衰竭。(2)对于轻微炎症活动(血清氨基转移酶水平<3×ULN、IgG<1.5×ULN和/或轻度界面性肝炎)的老年(>65岁)患者需平衡免疫抑制治疗的益处和风险作个体化处理。暂不启动免疫抑制治疗者须严密观察,如患者出现明显的临床症状,或出现明显炎症活动可进行治疗。

表4 AIH的鉴别诊断
4.2 治疗方案
4.2.1 一线治疗 对于未经治疗的AIH成人患者,若非肝硬化或急性重症者,建议将泼尼松(龙)联合AZA作为初始一线标准治疗方案,即泼尼松(龙)用于诱导缓解,AZA用于维持缓解。该方案可显著减少泼尼松(龙)剂量及其不良反应。泼尼松(龙)可快速诱导症状缓解,而AZA需6~8周才能发挥最佳免疫抑制效果,多用于维持缓解。联合治疗尤其适用于同时存在下述情况,如:绝经后妇女、骨质疏松、脆性糖尿病、肥胖、痤疮、情绪不稳以及高血压患者。泼尼松(龙)初始剂量为0.5~1 mg·kg-1·d-1(通常30~40 mg/d),诱导缓解治疗一般推荐如下用药方案:泼尼松(龙)30 mg/d 1周、20 mg/d 2周、15 mg/d 4周,泼尼松(龙)剂量低于15 mg/d时,建议以2.5 mg/d的幅度渐减至维持剂量(5~10 mg/d);维持治疗阶段甚至可将泼尼松(龙)完全停用,仅以AZA 50 mg/d单药维持。需要强调的是,糖皮质激素的减量应遵循个体化原则,可根据血清ALT、AST和IgG水平改善情况进行适当调整。如患者改善明显可较快减量,而疗效不明显时可在原剂量上维持2~4周。可在使用泼尼松(龙)2~4周后出现显著生化应答后再加用AZA,初始剂量为50 mg/d,可视毒性反应和应答情况渐增至1~2 mg·kg-1·d-1。理想情况下泼尼松(龙)可撤药,仅AZA单药维持。伴发黄疸的AIH患者可先以糖皮质激素改善病情,总胆红素水平恢复至较低水平(<50 μmol/L)时再考虑加用AZA联合治疗。
泼尼松(龙)单药治疗适用于合并血细胞减少、巯基嘌呤甲基转移酶功能缺陷、并发恶性肿瘤的AIH患者。AIH“可能”诊断患者也可以单药泼尼松(龙)进行试验性治疗。活动性AIH相关肝硬化失代偿期患者在预防并发症的基础上可谨慎使用小剂量糖皮质激素(一般剂量为15~20 mg/d)口服,疾病好转后应快速减量至维持量(一般剂量为5.0~7.5 mg/d)。来自我国的一项真实世界研究[19]显示,小剂量糖皮质激素治疗AIH肝硬化失代偿期患者能获得较高应答率(62.5%),接受治疗者的生存率更高。此外,治疗第7天的应答情况(血清总胆红素水平的变化)可预测预后,有助于判断是否继续糖皮质激素治疗或是需要其他治疗。
布地奈德(Budesonide)作为第2代糖皮质激素,特点为肝脏首过清除率约90%,主要部位为肠道和肝脏,所以全身不良反应较少。布地奈德可作为AIH的一线治疗方案,适用于需长期应用糖皮质激素维持治疗的AIH患者以减少副作用。但不宜用于肝硬化患者,布地奈德可通过肝硬化患者门静脉侧支循环直接进入体循环而失去首过效应的优势,同时还可能有增加门静脉血栓形成的风险。来自欧州的多中心临床研究结果表明,布地奈德和AZA联合治疗方案较传统联合治疗方案能更快诱导缓解,而糖皮质激素相关不良反应显著减轻,可作为AIH的一线治疗方案[18,20-22]。布地奈德在急性重症AIH或急性肝功能衰竭中的作用尚不清楚,因此不建议在此类情况下使用(图1)。
4.2.2 二线治疗 对一线治疗应答欠佳或不耐受糖皮质激素或AZA副作用的AIH患者,可选择二线治疗方案,药物包括:吗替麦考酚酯(mycophenolate mofetil,MMF)、他克莫司(tacrolimus,FK506)、环孢素A(cyclosporine A,CsA)、甲氨蝶呤(methotrexate)、6-巯基嘌呤(6-mercaptopurine,6-MP)等[23-24]。MMF是一种与硫嘌呤类药物分子结构和代谢不同的嘌呤拮抗剂,是在标准治疗效果不佳患者中应用最多的替代免疫抑制剂。对于AZA和6-MP均不耐受的患者,可使用MMF作为二线药物,可从250 mg每天2次的剂量开始,逐渐增加至500 mg每天2次口服。此外,胆汁淤积性AIH患者如糖皮质激素疗效欠佳也可考虑加用小剂量MMF治疗,以避免AZA诱导胆汁淤积的不良反应。虽然MMF的骨髓抑制等副作用显著低于AZA,但使用MMF初期也需定期(每2周1次)监测血常规检查。他克莫司在治疗失败、不完全应答和对AZA不耐受患者中具有补救治疗价值。两项关于成人AIH二线治疗的Meta分析显示,75%~94%的患者经他克莫司治疗后血清氨基转移酶改善或正常[25-26]。最常见的副作用是神经系统症状(震颤、头痛)、肾脏并发症(高血压、肾功能不全)和脱发。
4.2.3 三线治疗 对于一、二线治疗无应答的AIH患者,应重新评估原诊断的准确性和患者的服药依从性。三线治疗药物包括西罗莫司、英夫利昔单抗和利妥昔单抗等。小样本量病例中报道过抗TNFα制剂(英夫利昔单抗)在难治患者挽救性治疗中的作用。但也有研究发现抗TNFα药物可致肝损伤,甚至可引起药物诱导的AIH样肝损伤。利妥昔单抗是针对B细胞表面受体CD20的单克隆抗体,在对6例成人AIH患者(3例AZA不耐受和3例糖皮质激素/AZA和MMF无效的患者)的治疗中,所有患者血清转氨酶和IgG水平显著改善,67%的患者获得生化缓解。
4.2.4 肝移植术 AIH患者进展至急性肝功能衰竭或终末期肝病时,应考虑行肝移植术。重症AIH可导致急性或亚急性肝功能衰竭,如短期(1~2周内)的糖皮质激素治疗效果不明显时,需及时与肝移植中心联系,以免失去紧急肝移植术机会。失代偿期肝硬化患者的移植指征与其他病因导致的肝硬化相似,包括反复食管胃底静脉曲张破裂出血、肝性脑病、顽固性腹水、自发性细菌性腹膜炎和肝肾综合征等并发症经内科处理效果不佳,终末期肝病模型(MELD)评分>15分或Child-Pugh评分>10分,或符合肝移植标准的肝细胞癌(hepatocellular carcinoma, HCC)。选择恰当的时间进行肝移植术十分关键,应尽早做好肝移植术准备。AIH肝移植预后通常较好,影响肝移植患者生存的主要因素是AIH复发和移植排斥。复发性AIH(recurrent autoimmune hepatitis,rAIH)的发生率约为23%,确诊的中位时间为肝移植术后26个月[27]。HLA-DR位点不匹配是rAIH的主要危险因素。术前较高的血清IgG水平、移植肝的中重度炎症与AIH复发有关,提示术前未能完全抑制疾病活动是复发的危险因素之一。因此,AIH患者在肝移植术后的免疫抑制方案应兼顾抗排异反应和防止AIH复发。由于长期应用糖皮质激素预防移植后排斥反应、移植物功能丧失或复发来改善AIH成人患者和移植物存活率的证据有限,2019年AASLD建议肝移植术后应考虑逐渐停用糖皮质激素[28]。少数(6%~10%)非AIH患者在肝移植后出现类似AIH的血清学和组织学表现,称为新发AIH(de novo AIH)[29]。建议复查肝活检、血清IgG水平和自身抗体来区分免疫介导性疾病和其他导致同种异体移植功能障碍的原因。AIH复发或移植术后新发AIH的肝移植患者建议在钙调蛋白抑制剂的方案上加用泼尼松(龙)和AZA来联合治疗。
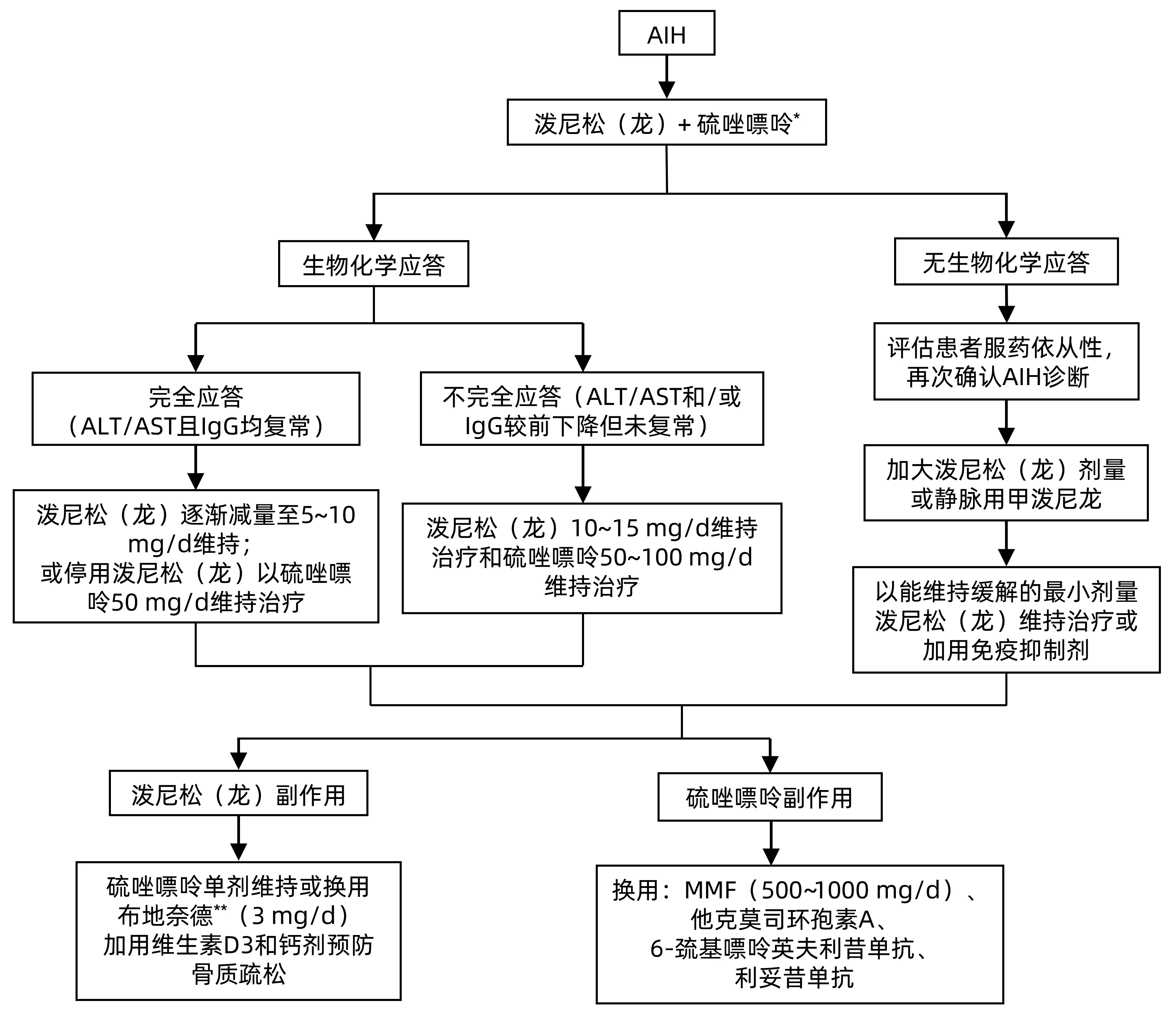
注:*建议有条件时在使用前检测TPMT和NUDT15基因型和/或活性,启动糖皮质激素2周后添加硫唑嘌呤(50~100 mg/d),并注意监测血常规。失代偿期肝硬化患者不建议使用硫唑嘌呤。**对于经泼尼松(龙)治疗后副作用严重者,布地奈德可作为替代药物。但布地奈德在肝硬化患者中失去首过效应的优势,有增加门静脉血栓形成的风险,此外在急性重症AIH或急性肝功能衰竭中治疗作用未知,因此上述情况下不建议使用。图1 AIH的药物治疗
4.3 药物相关不良反应
4.3.1 糖皮质激素的不良反应 长期使用糖皮质激素可出现明显不良反应,其中除了常见的“Cushing体征”以外,糖皮质激素还可加重骨质疏松导致相关骨病,并与2型糖尿病、白内障、高血压病、感染(包括已有的结核发生恶化)、精神疾病的发生有关。应尽量采用联合治疗方案来减少糖皮质激素剂量,并最终过渡至AZA单药维持治疗方案。需长期接受糖皮质激素治疗的AIH患者,建议治疗前做基线骨密度检测并每年监测随访。对于有骨质疏松症危险因素的患者,应在基线时采用双能X线骨密度仪(DEXA)对腰椎和髋部进行骨密度评估。此后每年复查1次。最常见危险因素为长期使用糖皮质激素、绝经后状态、低创伤骨折史和老龄(女性>65岁,男性>70岁)。应在基线时测定患者血清25-羟基维生素D水平,此后每年复查1次。糖皮质激素治疗期间,应补充钙剂(1000~1200 mg/d)和维生素D(>400~800 IU/d),并根据临床实际情况对维生素D不足的患者给予剂量补充。已有的临床经验支持在出现骨质疏松症时,使用双膦酸盐治疗。
4.3.2 AZA的不良反应 AZA最常见的不良反应是骨髓抑制导致的血细胞减少,可能与服用者的红细胞内巯基嘌呤甲基转移酶(thiopurine methyltransferase,TPMT)遗传多态性和活性低有关。另外,Nudix水解酶15(NUDT15)基因变异也会导致活性物质6-硫代鸟嘌呤核苷酸(6-thioguanine nucleotides,6-TGN)水平显著升高而引起骨髓抑制[30]。在有条件的情况下,治疗前检测TPMT和NUDT15基因型和活性可有助于预测接受AZA或6-巯基嘌呤(6-mercaptopurine,6-MP)治疗时出现的严重骨髓抑制毒性。此外,加用AZA者需严密监测血常规变化,特别是用药后的前3个月。如出现血细胞进行性下降,特别是外周血白细胞计数<3.5×109/L或者中性粒细胞绝对值<1.5×109/L时,应紧急停用AZA。AZA其他不良反应包括肝内胆汁淤积、静脉闭塞性疾病、胰腺炎、恶心和呕吐、皮疹等。少于10%的患者在接受AZA(50 mg/d)时会出现上述不良反应,一般均可在减量或停用后改善。
4.4 应答不完全的处理 应答不完全是指患者经标准治疗后,其临床表现、实验室指标(血清AST及ALT、总胆红素、IgG)和肝组织学等改善但未达到缓解标准。治疗失败是指经标准治疗后,患者生化指标或组织学检查仍在恶化。免疫抑制治疗应答不完全或无应答者应首先考虑AIH诊断是否有误和患者服药依从性如何。IAIHG在AIH二线与三线治疗立场声明[31]中指出,应答不完全是指在免疫抑制治疗的前6个月内患者未能实现完全的生化缓解。若临床上对生化应答的解释存在不确定性,则需根据肝组织学表现来评估应答情况。组织学缓解比生化缓解需要更长的时间,因此对应答程度的组织学评估可能需要延迟1年。对于一线治疗药物应答不完全的患者,建议检测AZA代谢物6-TGN的水平。因为AZA本身无内在活性,需要经过体内一系列转化后才能发挥药理作用。对于那些6-TGN水平过低(6-TGN水平<220 pmol/8×108RBC)而6-甲基巯基嘌呤(6-methylmercaptopurine,6-MMP)水平过高的患者,可能是由于患者依从性良好的情况下药物代谢发生改变导致疗效欠佳。在这些患者中,AZA联合别嘌呤醇可能有效,因为别嘌呤醇可阻断6-MMP途径。在不完全应答患者中,排除了其他肝病后,应考虑疾病活动度、并发症和药物副作用,加强标准药物治疗。若加强标准治疗后患者仍未缓解,可考虑三线治疗。建议在开始三线治疗前进行肝脏活检,以评估三线治疗的必要性,排除其他诊断,并在开始这些试验性治疗前获得疾病活动度(分级)和纤维化(分期)的详细信息。
4.5 疗程和停药与复发的处理 免疫抑制治疗一般持续3年以上,停药前患者需维持血清AST、ALT和IgG水平降至正常范围内(即获得生化缓解)2年以上。停药前进行肝活检复查是首选策略,组织学缓解(HAI≤3分)可将复发率降低到28%。肝脏瞬时弹性成像能用于AIH患者纤维化进展的随访,但启动免疫抑制治疗后的最初6个月内肝脏硬度值的变化可能由于炎症好转导致[32-33]。患者在停止治疗后的最初12个月应进行密切监测,之后至少每年进行一次实验室检查。最近,我国一项长期规律随访的705例AIH患者队列显示,经免疫抑制治疗后569 例(80.7%)患者达到完全生化缓解。较低的血清IgG水平、诊断时肝组织纤维化程度轻以及对免疫抑制治疗的快速反应是生化和组织学缓解的可靠预测指标,经3年免疫抑制治疗并前后肝活检患者(160例)中,约70%患者达到肝组织学缓解[7]。
复发是指经药物诱导缓解和停药(包括不遵医嘱自行停药)后出现疾病活动加剧,可定义为血清氨基转移酶水平>3×ULN,伴血清IgG水平不同程度的升高。复发的危险因素包括先前需使用联合治疗方案才能获得生化缓解者、并发自身免疫性疾病和年龄较轻者。停药后复发患者,建议再次以予泼尼松(龙)和AZA联合治疗,逐渐过渡至维持治疗;而AZA不能耐受者可给予小剂量泼尼松(龙)(≤10 mg/d)或与MMF联合长期维持治疗。多次复发的患者更易出现肝硬化,预后不佳。
4.6 疫苗接种 AIH患者感染新型冠状病毒的风险普遍增加,且感染新型冠状病毒后病情重症化及死亡的风险也会增加。尽快接种新型冠状病毒疫苗是一项重要的保护措施。如果病情稳定、肝生化指标正常或基本正常,且无疫苗接种的其他禁忌证,可接种新型冠状病毒疫苗。非急性活动性AIH患者,包括代偿期肝硬化阶段及病情稳定的失代偿期肝硬化阶段(无急性食管胃静脉曲张破裂出血、肝性脑病、自发性细菌性腹膜炎及肝肾综合征等严重并发症)者可以接种新型冠状病毒疫苗,且在接种期间不应该停药。不建议高剂量免疫抑制剂治疗者接种减毒活疫苗,灭活疫苗和重组疫苗相对而言比较安全。免疫抑制患者对疫苗的应答率较低,但仍可起到保护效果[34-35]。
推荐意见5:血清氨基转移酶和IgG水平升高和/或肝组织学炎症活动的AIH患者应启动泼尼松(龙)联合AZA治疗方案或泼尼松(龙)单药治疗方案。(A1)
推荐意见6:泼尼松(龙)初始剂量为0.5~1.0 mg·kg-1·d-1(通常30~40 mg/d),并逐渐减量以诱导生化缓解。联合治疗时可在泼尼松(龙)基础上再加用AZA 1 mg·kg-1·d-1(通常50 mg/d)。建议有条件时在加用AZA前监测TPMT和NUDT15基因型。(B1)
推荐意见7:在脆性糖尿病、高血压病、严重骨质疏松等不能耐受泼尼松龙的非肝硬化患者可考虑使用布地奈德。对AZA不耐受或无应答的AIH患者,建议换用二线免疫抑制剂如MMF(常用剂量为500~1000 mg/d)或他克莫司等。(B1)
推荐意见8:AIH治疗目标是获得并维持生化缓解(血清氨基转移酶和IgG水平复常)和肝组织学缓解(Ishak系统HAI评分<4分或Scheuer分级系统G≤1),以防止疾病进展。推荐维持免疫抑制治疗疗程在3年或获得生化缓解后2年以上。(B1)
推荐意见9:建议在停药前再次进行肝组织学检查,获得肝组织学缓解者方可考虑停药。对于治疗过程中反跳或停药后复发者,可采用联合治疗方案进行治疗。(C1)
推荐意见10:AIH相关肝硬化早期失代偿期患者(无肝性脑病、顽固性腹水或细菌性腹膜炎等)可谨慎使用小剂量糖皮质激素(起始剂量为15~20 mg/d)口服,疾病好转后应快速减量至维持量(一般剂量为5.0~7.5 mg/d),须严密监测感染的发生。(B1)
推荐意见11:肝硬化失代偿期AIH患者如出现肝硬化并发症无法改善或出现慢加急性肝功能衰竭时建议进行肝移植术。肝移植术后仍需注意AIH复发问题。(B1)
推荐意见12:建议所有接受糖皮质激素治疗的AIH患者在基线时和每年进行骨密度检测,并适当补充维生素D和钙剂,骨质疏松严重者可使用双膦酸盐类药物治疗。(B1)
5 AIH特殊类型的处理
5.1 急性重症AIH和急性肝衰竭 急性重症AIH是指起病30 d内,出现黄疸及INR延长(>1.5,且<2.0),无肝性脑病表现且无既往慢性肝病基础的AIH患者。目前对急性重症AIH的黄疸水平定义尚有争论,文献报道的总胆红素水平界定在45 μmol/L到升高5×ULN[36-37]。AIH相关急性肝衰竭是指在黄疸、出凝血异常(INR ≥1.5)的基础上,于起病26周内出现肝性脑病且否认既往慢性肝病基础。上述诊断需排除合并肝炎病毒感染、毒物,或者药物诱导的肝损伤等诱发因素。急性重症AIH患者有29%~39%为ANA阴性或弱滴度阳性,而25%~39%的患者血清IgG在正常范围[38]。急性重症AIH患者可在排除感染或败血症的基础上进行糖皮质激素(甲泼尼龙 40~80 mg/d)治疗,并同期进行肝移植术前评估,注意监测和预防感染特别是肺部感染的发生。急性重症AIH患者在糖皮质激素治疗1~2周内实验室检查无改善或临床症状恶化者,应考虑停用糖皮质激素治疗,并进行肝移植术。AIH相关急性肝功能衰竭患者应直接进行肝移植评估。
推荐意见13:急性重症AIH患者尽早使用甲泼尼松(龙)(40~60 mg/d)试验性治疗,糖皮质激素治疗1~2周内实验室检查无改善或临床症状恶化者,建议进行肝移植评估。AIH相关急性肝衰竭患者建议直接进行肝移植评估。(C1)
5.2 药物性自身免疫性肝损伤 米诺环素、呋喃妥因、英夫利昔单抗是目前最常报道的引起AIH样肝损伤的药物。免疫检查点抑制剂在肿瘤患者中的应用也可引起免疫相关肝损伤,经糖皮质激素治疗后通常得以缓解,但这类患者往往缺乏AIH实验室及组织学特征,在诊断上需避免与AIH混淆[39-40]。对药物诱导的AIH样肝损伤患者,必须停用可能致病的药物并持续随访。当症状或疾病活动严重或症状和肝生化指标在停药后未能改善甚至恶化时,应启动糖皮质激素治疗。糖皮质激素撤药过程肝生化指标持续好转支持药物诱导肝损伤的诊断。反之,若肝生化指标再次升高则提示AIH,并且需长期免疫抑制治疗。
推荐意见14:肝组织学检查对鉴别药物性肝损伤和AIH具有重要作用。应立即停用可疑药物,病情较重者可短期(3~6个月)使用泼尼松(龙)治疗。若停用糖皮质激素后患者肝生化指标再次升高则支持AIH诊断,需进行标准化治疗。(C1)
5.3 AIH合并病毒性肝病 目前常规推荐在进行免疫抑制治疗前筛查患者的血清HBsAg及抗-HBc抗体和HBV DNA[41]。HBV DNA阳性者直接抗病毒治疗,如HBV DNA转阴后肝功能仍然异常并伴有血清免疫学异常者可考虑行肝组织学检查,若明确AIH诊断可考虑在抗病毒治疗的基础上加用免疫抑制剂。对于HBV DNA阴性而HBsAg阳性的AIH患者在应用免疫抑制剂治疗期间及治疗后半年内,推荐服用恩替卡韦或替诺福韦预防性抗病毒治疗。对于HBV DNA阴性、HBsAg阴性但抗-HBc阳性的低风险患者,建议密切监测血清学指标(血清HBsAg、HBV DNA),必要时启动抗病毒治疗。随着糖皮质激素使用的剂量及维持时间增加,HBsAg阴性但抗-HBc阳性患者发生反向血清学转化(血清HBsAg、HBV DNA出现阳性)的风险增加,泼尼松(龙)中等剂量(10~20 mg/d)到高剂量(>20 mg/d)使用超过4周将提高反向血清学转化风险1%~10%[41]。推荐每1~3个月对HBsAg阴性但抗-HBc阳性的AIH患者进行血清学检测(HBsAg、HBV DNA)。而高剂量糖皮质激素治疗或应用B细胞敲除剂、细胞因子拮抗剂、钙调蛋白抑制剂以及其他免疫抑制剂治疗,可能提高反向血清学转化风险,最好避免在HBsAg阳性或者HBsAg阴性但抗-HBc阳性患者中使用,如无法避免上述治疗,则应启动预防性抗病毒治疗。我国学者也报道了一组慢性乙型肝炎合并AIH的病例,在抗病毒治疗的基础上进行免疫抑制治疗取得了较好疗效。因此,慢性病毒性肝病(HBV或HCV感染)在病毒成功治疗后肝生化或肝组织学仍有炎症活动需考虑排除AIH可能[42]。
推荐意见15:在进行免疫抑制治疗前筛查患者的HBsAg和抗-HBc抗体以及血清HBV DNA,以评估HBV再激活风险以及启动抗病毒治疗的必要性。慢性乙型肝炎患者在病毒得到完全抑制后仍存在肝炎活动者需注意排除AIH可能。(C1)
5.4 妊娠期AIH AIH患者妊娠期及产后12个月内发生各种妊娠并发症的概率为38%。建议AIH患者在妊娠期或备孕期坚持治疗,以降低发生复燃及肝脏失代偿发生率。AIH复燃的风险在产后提高3倍左右,妊娠期复燃风险较低可能与胎盘植入物等因素有关。肝硬化孕妇随着妊娠继续,其血容量增加可能导致食管胃底静脉曲张破裂出血风险加剧。考虑到β受体阻滞剂及特利加压素对孕妇的不良反应,建议此类人群在孕前进行预防性曲张静脉套扎术。目前没有关于因使用AZA治疗AIH而引起孕妇及胎儿不良事件的报道,早先对AZA致畸的依据来自于使用超过治疗量的动物实验研究。禁止有妊娠意愿的AIH患者服用MMF,因其可能与妊娠早期流产、出生缺陷(主要是耳、心脏、唇腭裂等)有关。
推荐意见16:在AIH患者妊娠过程中,可予小剂量泼尼松(龙)(5~10 mg/d)和(或)AZA(25~50 mg/d)维持治疗,而在妊娠期间应避免使用MMF。分娩后6个月内需注意预防AIH复燃。(C1)
5.5 儿童AIH 儿童AIH年发病率为0.23/10万~0.4/10万,高峰年龄在10岁左右。儿童自身抗体的滴度比成人低,ANA和ASMA≥1∶20,或抗LKM1≥1∶10即有临床意义。13%~38%的AIH儿童可检测到抗LKM1。抗LC1主要发生在患有严重肝病AIH-2型患儿中。2018年ESPGHAN提出儿童及青少年自身免疫性肝病诊断评分标准[43],增加了外周抗核中性粒细胞抗体(pANNA)、抗LC-1和胆管造影的评分项目和权重,以提高AIH诊断的敏感性并排除合并自身免疫性硬化性胆管炎。儿童AIH的治疗缓解标准较成人严格:当转氨酶和IgG水平正常,AIH相关抗体阴性或低滴度时,认为病情完全缓解。欧美推荐的泼尼松(龙)起始剂量2 mg·kg-1·d-1(我国推荐的起始剂量为1 mg·kg-1·d-1,最大用量不超过成人剂量),在4~8周随着转氨酶水平的下降而逐渐减量,维持剂量为2.5~5.0 mg/d。在治疗的前6~8周,应每周查肝生化指标,并相应调整药物剂量。大多数AIH需要泼尼松(龙)联合AZA治疗。应用糖皮质激素治疗2周后或出现严重糖皮质激素副作用及单药治疗转氨酶水平停止下降时加用AZA,欧美推荐起始剂量为0.5 mg·kg-1·d-1,可逐步加至2 mg·kg-1·d-1;我国推荐剂量为0.5~1.0 mg·kg-1·d-1,最大用量不超过成人剂量。随着AZA剂量调增,泼尼松(龙)的剂量逐渐降到最低甚至完全停药。布地奈德联合AZA可以考虑用于症状轻微或者担心激素副作用而影响用药依从性AIH儿童。布地奈德不适宜在肝硬化或急性重度AIH。环孢素的起始剂量为4 mg·kg-1·d-1,分3次使用,必要时每2~3天增加1次,以达到全血浓度(250±50)ng/mL持续3个月。如果在第1个月出现临床和生化缓解,在接下来的3个月将环孢素浓度降低至(200±50)ng/mL。长期随访环孢素对儿童AIH的生化缓解效果良好[44]。儿童 AIH 患者对他克莫司长期耐受良好,在对标准治疗不耐受或失败的患者中大部分有效[45]。他克莫司的目标浓度为2.5~5.0 ng/mL。
推荐意见17:儿童AIH患者确诊后即应启动免疫抑制治疗,推荐泼尼松(龙)1 mg·kg-1·d-1(最大剂量不超过40 mg/d)和AZA 0.5~1.0 mg·kg-1·d-1(最大剂量不超过50 mg/d)联合治疗方案或泼尼松(龙)单药治疗方案。(C1)
6 预后
AIH患者获得生化缓解后预后较好,生存期接近同龄普通人群。预后不佳的危险因素主要包括诊断时已有肝硬化和治疗后未能获得生化缓解。我国研究显示,合并其他系统自身免疫性疾病、肝内胆管损伤和诊断时MELD分数较高者与治疗应答和预后不佳有关[46]。HCC发生在1%~9%的AIH相关肝硬化患者,年发病率为1.1%~1.9%。HCC危险因素是肝硬化≥10年、门静脉高压、持续性炎症、反复复发和免疫抑制治疗≥3年。一项系统评价及荟萃分析显示,AIH患者中HCC合并发生率为3.06/1000人年,而AIH相关肝硬化患者中HCC的合并发生率为10.07/1000人年[47]。因此,临床医师在AIH肝硬化患者中需要密切监测HCC的发生。
推荐意见18:AIH相关肝硬化患者应每6个月进行一次肝脏超声检查和血清甲胎蛋白水平测定,必要时行上腹部增强磁共振或增强CT检查。(C1)
执笔人:马雄、王绮夏、肖潇、苗琪、连敏、唐茹琦、尤红、陆伦根、韩英、南月敏、徐小元、段钟平、魏来、贾继东、庄辉
指南制定专家(以姓氏拼音排序):蔡晓波(上海交通大学附属第一人民医院消化内科)、陈莎(首都医科大学附属北京友谊医院肝病中心)、陈煜(首都医科大学附属北京佑安医院肝病中心)、陈红松(北京大学人民医院肝病研究所)、崔丽娜(空军军医大学第一附属医院消化内科)、董加强(空军军医大学第一附属医院消化内科)、窦晓光(中国医科大学附属盛京医院感染科)、段维佳(首都医科大学附属北京友谊医院肝病中心)、段钟平(首都医科大学附属佑安医院肝病中心)、郭长存(空军军医大学第一附属医院消化内科)、郭冠亚(空军军医大学第一附属医院消化内科)、韩涛(天津市第三中心医院肝内科)、韩英(空军军医大学第一附属医院消化内科)、侯金林(南方医科大学南方医院感染内科)、胡鹏(重庆医科大学附属第二医院感染科)、宦怡(空军军医大学第一附属医院放射影像科)、贾继东(首都医科大学附属北京友谊医院肝病中心)、孔媛媛(首都医科大学附属北京友谊医院国家消化系统疾病临床医学研究中心方法学平台)、李杰(北京大学医学部基础医学院病原生物学系)、李军(江苏省人民医院感染病科)、李淑香(首都医科大学附属北京友谊医院肝病中心)、李增山(空军军医大学第一附属医院病理科)、令狐恩强(解放军总医院第一医学中心消化内科)、刘家云(空军军医大学第一附属医院检验科)、刘景丰(福建医科大学孟超肝胆医院肝胆外科)、刘燕敏(首都医科大学附属北京佑安医院肝病科)、刘迎娣(解放军总医院第一医学中心消化内科)、陆伦根(上海交通大学附属第一人民医院消化内科)、罗新华(贵州省人民医院感染科)、吕婷婷(首都医科大学附属北京友谊医院肝病中心)、马雄(上海交通大学医学院附属仁济医院消化内科)、苗琪(上海交通大学医学院附属仁济医院消化内科)、南月敏(河北医科大学第三医院中西医结合肝病科)、曲颖(上海交通大学附属第一人民医院消化内科)、任红(重庆医科大学第二医院传染科)、任万华(山东省立医院感染性疾病科)、尚佳(河南省人民医院感染性疾病科)、尚玉龙(空军军医大学第一附属医院消化内科)、时永全(空军军医大学第一附属医院消化内科)、唐承薇(四川大学华西医院消化内科)、王建设(复旦大学附属儿科医院感染科)、王婧雯(空军军医大学第一附属医院药剂科)、王绮夏(上海交通大学医学院附属仁济医院消化内科)、魏来(北京大学人民医院肝病科)、吴浩(四川大学华西医院消化内科)、徐小元(北京大学第一医院感染疾病科)、阎明(山东大学齐鲁医院消化内科)、杨东亮(华中科技大学同济医学院附属协和医院感染科)、杨永峰(南京市第二医院肝病科)、杨诏旭(空军军医大学第一附属医院肝胆外科)、尤红(首都医科大学附属北京友谊医院肝病中心)、张欣欣(上海交通大学医学院附属瑞金医院感染科)、张跃新(新疆医科大学第一附属医院感染科)、赵景民(解放军总医院第五医学中心病理科)、赵守松(蚌埠医学院第一附属医院感染病科)、赵新颜(首都医科大学附属北京友谊医院肝病中心)、郑林华(空军军医大学第一附属医院消化内科)、周新民(空军军医大学第一附属医院消化内科)、庄辉(北京大学医学部基础医学院病原生物学系)
志谢(以姓氏拼音排序):安纪红(内蒙古自治区人民医院感染科)、邓国宏(陆军军医大学第一附属医院传染科)、黄燕(中南大学湘雅医院传染科)、黄缘(北京清华长庚医院肝胆内科)、李荣宽(大连医科大学附属二院感染科)、李树臣(哈尔滨医科大学第二附属医院传染科)、陆海英(北京大学第一医院传染科)、石荔(西藏自治区人民医院感染科)、苏明华(广西医科大学第一附属医院感染科)、温志立(南昌大学第二附属医院消化内科)、吴彪(海南省人民医院感染科)、徐京杭(北京大学第一医院肝病科)、杨丽(四川大学华西医院消化内科)、杨积明(天津市第二人民医院感染科)、杨晋辉(昆明医科大学附属二院消化内科)、张缭云(山西医科大学第一医院传染科)、周璐(天津医科大学总医院消化内科)、周永健(广州市第一人民医院消化内科)、祖红梅(青海省第四人民医院传染科)参加本指南制定的讨论,并提出了富有建设性的意见和建议。
利益冲突声明:所有作者均声明不存在利益冲突。

参考文献见二维码
