猫ω干扰素和γ干扰素的可溶性原核表达及纯化
2022-02-11任丽君杨孝朴包世俊武小椿马永华魏衍全
任丽君,杨孝朴,包世俊,武小椿,马永华,魏衍全
(甘肃农业大学动物医学院,甘肃兰州 730070)
干扰素(interferon,IFN)是由机体免疫细胞产生的一种具有抗病毒、抗肿瘤和免疫调节等多种生物学活性的糖蛋白[1-2]。根据干扰素的来源、生物学性质及活性,将干扰素分Ⅰ型和Ⅱ型[3-4]。Ⅰ型干扰素主要起抗病毒和抗肿瘤作用[5],包括 IFN-α、IFN-β、IFN-ω、IFN-ε、IFN-κ、IFN-τ、IFN-δ和IFN-ζ,Ⅱ型干扰素仅有IFN-γ亚型,由抗原刺激细胞产生后在抗胞内病原体的宿主防御中起关键作用[6-9]。1992年,日本东丽株式会社的Nakamura等首次分离到了猫干扰素基因,将其归类为ω型干扰素,有研究表明IFN-ω对于猫白血病毒(FLV)和猫免疫缺陷病毒(FIV)共感染的猫以及细小病毒具有明显治疗效果,之后在此基础上证明了IFN-ω相较于IFN-γ对FIV的复制有抑制作用且存在剂量依赖性[10-11]。由于猫ω干扰素(feline interferon,FeIFN-ω)的抗病毒能力相当广泛且具有显著效果[12],因此研究FeIFN-ω的抗病毒机制在治疗有关猫病毒病的实践中具有重要意义。IFN-γ作为一种新型干扰素,在抗肿瘤方面发挥较强的作用[13],1995年鸡IFN-γ基因被首次成功克隆,随后成功表达出重组鹅、家兔、猪、牛等动物的IFN-γ并将其用于临床治疗[14-15],但有关猫的IFN-γ研究却少被报道。大量研究显示Ⅰ型与Ⅱ型干扰素均具有抗病毒活性,且IFN-γ与IFN-α、IFN-β和IFN-ω之间存在相互协同作用,能一同促进肿瘤细胞的凋亡[16-17]。
近年来,人们生活水平迅速提高,带动了宠物养殖业的蓬勃发展,与猫有关的疾病特别是病毒性疾病逐年增多。本研究首先对猫ω干扰素(FeIFN-ω)和猫γ干扰素(feline interferon-gamma,FeIFN-γ)的基因完成克隆,然后插入原核表达载体pET28a-SUMO构建重组质粒并摸索最佳诱导表达条件,最终以可溶性形式表达并纯化出2种融合蛋白。本研究利用大肠埃希氏菌建立了FeIFN-ω和FeIFN-γ高效的原核表达系统,为后期研究干扰素抗病毒作用机制、开发抗病毒药物奠定了基础。
1 材料与方法
1.1 材料
1.1.1 菌株、质粒和主要试剂 大肠埃希氏菌感受态细胞DH5α、BL21,北京擎科生物科技有限公司产品;T4 DNA连接酶、IPTG(异丙基硫代-β-D-半乳糖苷)、卡那霉素,TaKaRa公司产品;限制性内切酶BamH Ⅰ、Hind Ⅲ,New England BioLabs公司产品;PMSF(苯甲基磺酰氟)、SUMO蛋白酶,北京索莱宝科技有限公司产品;Ni-NTA纯化柱、蛋白浓缩柱、截留柱,Merck公司产品。
1.1.2 仪器与设备 高速台式空冷型离心机,上海博翎仪器设备有限公司产品;制冰机,常熟市雪科电器有限公司产品;全波长酶标仪,上海闪谱生物科技有限公司产品;梯度基因扩增仪,上海奥陆生物科技有限公司产品;紫外风光光度计,美国GE公司产品;电热恒温培养箱,上海跃进医疗器械有限公司产品;恒温振荡器,上海珂淮仪器有限公司产品;超低温保存箱、生物安全柜,青岛海尔股份有限公司产品;超声波细胞粉碎机,宁波新芝生物科技股份有限公司产品。
1.2 方法
1.2.1 FeIFN-ω和FeIFN-γ蛋白的信号肽序列和理化性质分析 通过SignalP-4.0 Server(网址:http://www.cbs.dtu.dk/services/SignalP/)和Expasy(网址:https://web.expasy.org/protparam/)在线服务器分别预测分析2种蛋白的信号肽段和理化性质。
1.2.2 原核表达质粒pET28a-SUMO-FeIFN和pET28a-SUMO-FeIFN-γ的构建 根据GenBank收录的FeIFN-ω(GenBank No.NM-001089309.1)和FeIFN-γ(GenBank No.NM-001009873.1)的序列,舍弃掉信号肽后设计PCR引物。FeIFN-ω引物序列,F:5'-GAAGGATCCTGTGCCCTGCCTGGGAGCCACG-3',R:5'-TCCAAGCTTCTACGCAGTGCACATGCGGAT-3'。FeIFN-γ引物序列,F:5'-TTGGTGGATCCTATTACTGTCAGGCCATGTTTT-3',R:5'-TCCAAGCTTTCAAGATGACGCCAGGTCTCC-3',并分别通过引物引入BamH Ⅰ和Hind Ⅲ酶切位点,PCR反应条件:94 ℃预变性4 min;94 ℃ 25 s,56 ℃ 25 s,72 ℃ 35 s,共32个循环;72 ℃ 10 min。接着,将PCR扩增后的FeIFN-ω和FeIFN-γ的产物经双酶切(BamH Ⅰ/Hind Ⅲ)后回收目的基因片段,同时酶切、回收pET28a-SUMO载体片段,用T4 DNA连接酶连接后,转入DH5α感受态细胞,提取质粒经PCR和双酶切(BamH Ⅰ/Hind Ⅲ)验证后送于测序,测序正确后分别命名为pET28a-SUMO-FeIFN-ω和pET28a-SUMO-FeIFN-γ。
1.2.3 重组质粒的诱导表达与可溶性分析 将重组质粒pET28a-SUMO-FeIFN-ω和pET28a-SUMO-FeIFN-γ分别转入BL21感受态细胞,用高温消毒的涂菌棒将转化后产物涂布于含有卡那霉素(Kanamycin,Kan+)抗性的LB平板,放置37 ℃恒温培养箱12 h~16 h。之后挑取克隆菌落,接种于3 mL含Kan+的LB培养液中,用摇床以220 r/min振荡过夜培养。次日以1∶100转接入100 mL含Kan+的LB培养液中,于37 ℃、220 r/min摇床振荡培养2 h,使菌液对数生长期OD 600 nm值达到0.6~0.8,取1 mL未经诱导的菌液作为对照,接着往剩余菌液中加入IPTG,终浓度为1 mmol/L,在16 ℃、220 r/min摇床培养10 h后以8 000 r/min离心10 min收集菌体,弃去上清后的菌体沉淀加10 mL结合缓冲液(50 mmol/L NaHPO4,300 mmol/L NaCl,10 mmol/L咪唑,pH 8.0),使用移液器反复吹打,使菌体重悬,结束后加入PMSF。将重悬后的菌液超声破碎,全程置于冰盒上工作,超声3 s,停顿4 s,功率220 W,以菌液变得清澈透亮为准,超声结束后将菌液以10 000 r/min离心10 min左右。收集上清、沉淀制备样品,用SDS-PAGE电泳检测。
1.2.4 SUMO-FeIFN-ω和SUMO-FeIFN-γ融合蛋白诱导表达条件的筛选 在培养管中以1∶100加入菌液和含Kan+的LB液体培养液中,于16 ℃、220 r/min摇床振荡培养,当菌液OD 600 nm值到0.6~0.8时即可。将各培养管分别按IPTG浓度梯度(0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6 mmol/L),诱导温度(37、30、22、16 ℃),时间梯度(3、6、9、12、15、18、21、24 h)进行表达条件的筛选,用SDS-PAGE电泳检测。
1.2.5 SUMO-FeIFN-ω和SUMO-FeIFN-γ融合蛋白的表达和纯化 在确定最佳条件后扩大培养菌液。将诱导、超声后的上清用0.45 μm的微孔滤膜过滤后进行纯化。首先将Ni亲和层析柱用蒸馏水清洗,并用结合缓冲液平衡多次,接着将滤液加入层析柱后置于振荡器结合,在室温结合2 h,以0.5 mL/min~1 mL/min的流速收集流穿液;将层析柱的液体用洗涤缓冲液(50 mmol/L NaHPO4,300 mmol/L NaCl,20 mmol/L咪唑,pH 8.0)以1 mL/min的流速清洗Ni柱,大约8倍~10倍柱体积的用量去除杂蛋白;最后用5倍~10倍柱体积的洗脱缓冲液(50 mmol/L NaHPO4,300 mmol/L NaCl,250 mmol/L咪唑,pH 8.0)以0.5 mL/min~1 mL/min的流速洗脱层析柱上的蛋白,收集的样品均要置于冰上,最后用SDS-PAGE电泳检测。
1.2.6 SUMO-FeIFN-ω和SUMO-FeIFN-γ融合蛋白的酶切和纯化 将SUMO蛋白酶以1∶10比例加入融合蛋白液,4 ℃条件下酶切,分别收集不同时间段(3、6、9、12 h)的酶切产物。使用Millipore公司生产的30 ku截留柱和10 ku截留柱对2种酶切后的蛋白进行脱盐、浓缩和纯化。根据试剂盒说明,首先将酶切后的蛋白和交换buffer(50 mmol/L NaHPO4,300 mmol/L NaCl,pH 8.0,经0.22 μm超滤膜超滤)混匀,在30 ku截留柱中加入3 mL蛋白,使用水平离心机以4 ℃、3 000 r/min离心10 min,再将3 mL交换buffer加入截留柱,浓缩到200 μL~500 μL,重复多次后收集每一次的流穿液,然后将流穿液依次加入到10 ku的截留柱中,每次3 mL,直至将上述流穿液全部加完,最后截留剩余体积大约为500 μL,即为去掉SUMO标签的目的蛋白。用SDS-PAGE电泳检测,Bradford测定法测定目的蛋白浓度。
2 结果
2.1 FeIFN-ω和FeIFN-γ蛋白信号肽预测分析
通过SignalP-4.0 Server在线服务器分析FeIFN-ω和FeIFN-γ两种蛋白的信号肽(图1)。结果显示,FeIFN-ω蛋白的信号肽序列是前23位氨基酸,属于分泌性蛋白,第23位氨基酸和第24位氨基酸可能为信号肽的切割位点;FeIFN-γ蛋白的信号肽序列是前20位氨基酸,属于分泌性蛋白,第20位氨基酸和第21位氨基酸可能为信号肽的切割位点。
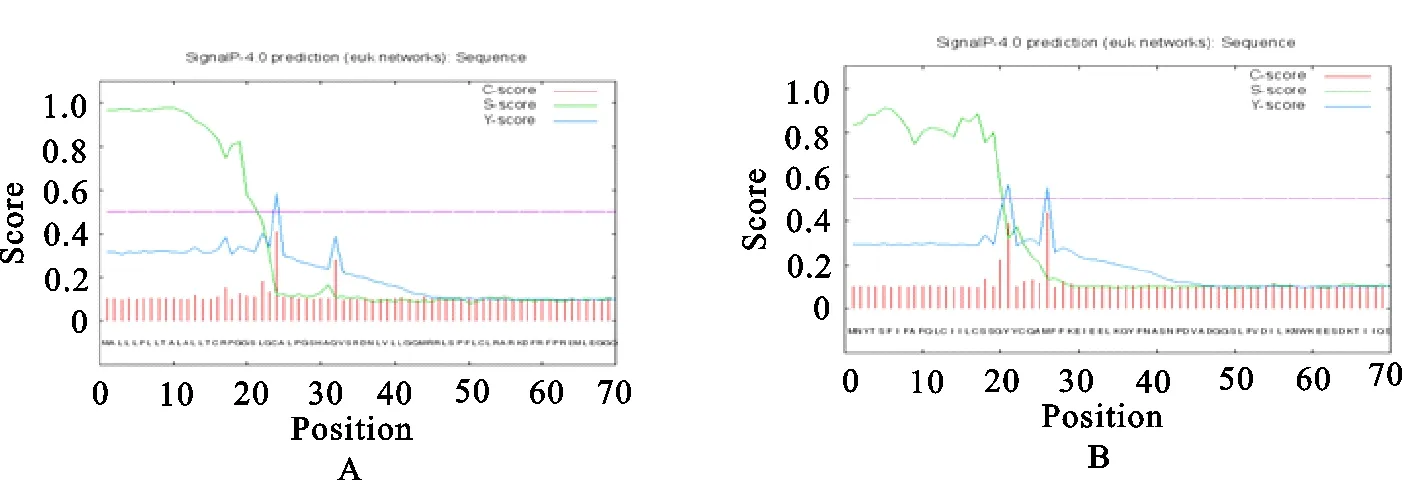
A.FeIFN-ω;B.FeIFN-γ
2.2 FeIFN-ω和FeIFN-γ蛋白理化性质预测分析
用Protparam在线服务器分析FeIFN-ω和FeIFN-γ两种蛋白的理化性质。结果表明,FeIFN-ω蛋白含有196个氨基酸,分子质量为21.4 ku(去除信号肽为18.2 ku),等电点为6.96,总体亲水性平均值为-0.007;FeIFN-γ蛋白含有167个氨基酸,分子质量为19.6 ku(去除信号肽为17.3 ku),等电点为9.1,总体亲水性平均值为-0.483。
2.3 PCR扩增结果
用10 g/L琼脂糖凝胶电泳检测FeIFN-ω基因和FeIFN-γ基因的PCR扩增产物。结果显示,获得的特异性目标条带大小分别约为522 bp和444 bp(图2),与预期结果相符。

A.FeIFN-ω;B.FeIFN-γ;M.DNA 标准DL 5 000;1.阴性对照;2.样品
2.4 重组质粒pET28a-SUMO-FeIFN-ω和pET28a-SUMO-FeIFN-γ的双酶切鉴定
经BamH Ⅰ/Hind Ⅲ双酶切2 h后,用10 g/L琼脂糖凝胶电泳检测。结果显示,重组质粒pET28a-SUMO-FeIFN-ω在大约5 633 bp和522bp处出现2个条带;重组质粒pET28a-SUMO-FeIFN-γ在大约5 633 bp和444 bp处出现2个条带(图3),与预期结果相符。
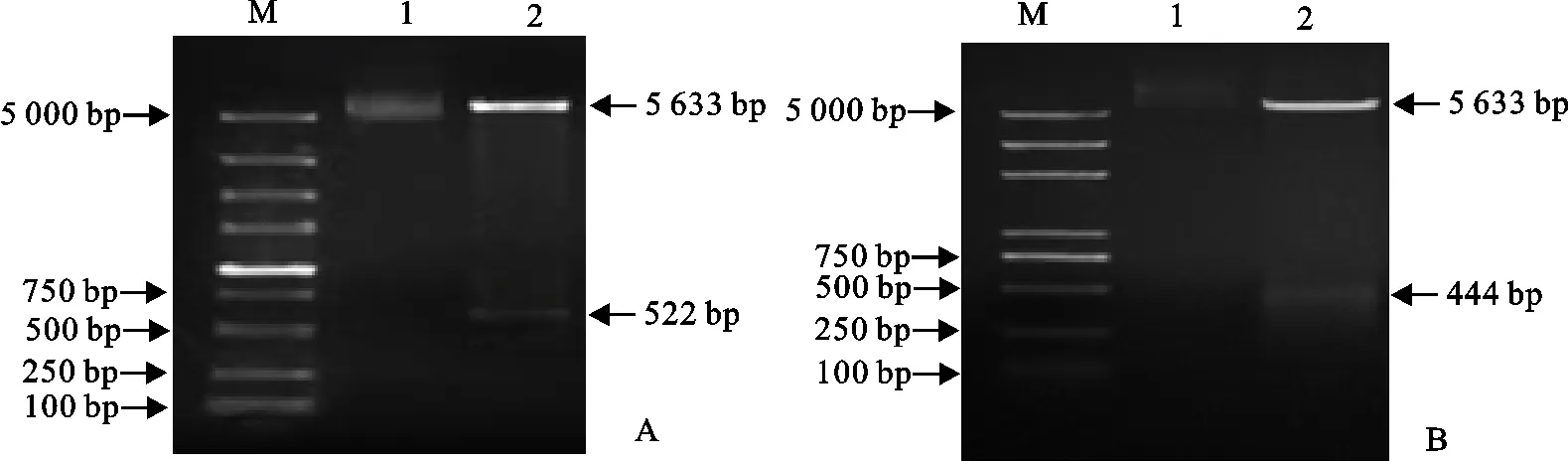
A.pET28a-SUMO-FeIFN-ω;B.pET28a-SUMO-FeIFN-γ;M.DNA 标准DL 5 000;1.重组质粒;2.重组质粒双酶切产物A.pET28a-SUMO-FeIFN-ω;B.pET28a-SUMO-FeIFN-γ;M.DNA Marker DL 5 000;1.Recombinant plasmid;2.Recombinant plasmid digested by BamH Ⅰ/Hind Ⅲ
2.5 重组质粒pET28a-SUMO-FeIFN-ω和pET28a-SUMO-FeIFN-γ的诱导表达与可溶性分析结果
将构建好的pET28a-SUMO-FeIFN-ω和pET28a-SUMO-FeIFN-γ重组质粒转入BL21感受态细胞中诱导表达,将菌体超声裂解,超声时长大约20 min时菌液变得清澈透亮,分别取蛋白上清和沉淀制样,用SDS-PAGE电泳检测。结果显示,重组菌经诱导后出现了明显的表达条带(图4),大小约为35 ku和34 ku,且上清中的条带明显大于沉淀,说明融合蛋白以可溶性形式在大肠埃希氏菌中得到了表达。
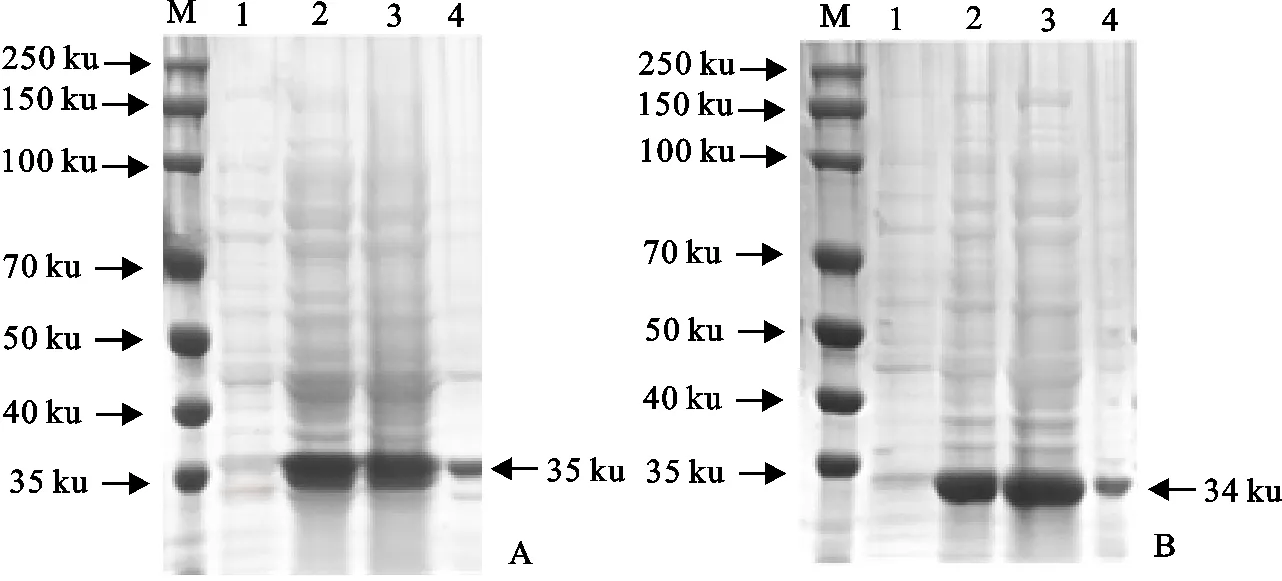
A.pET28a-SUMO-FeIFN-ω;B.pET28a-SUMO-FeIFN-γ;M.蛋白分子质量标准;1.重组菌诱导前产物;2.重组菌诱导后产物;3.重组菌诱导产物上清;4.重组菌诱导产物沉淀A.pET28a-SUMO-FeIFN-ω;B.pET28a-SUMO-FeIFN-γ;M.Protein molecular weight Marker;1.Recombinant bacteria pre-induction products;2.Recombinant bacteria induced products;3.Supernatant of the recombinant bacteria induced product;4.Precipitate of the recombinant bacteria induced products
2.6 SUMO-FeIFN-ω和SUMO-FeIFN-γ融合蛋白的诱导表达条件优化结果
为了优化融合蛋白表达条件,设置不同的诱导剂浓度、诱导时间及诱导温度的对照组,分别诱导之后收集菌体并制样,用SDS-PAGE电泳检测。结果显示(图5),在IPTG终浓度分别为0.6 mmol/L、0.8 mmol/L时,2种融合蛋白即可获得较高表达量;使用最佳浓度的IPTG时,在16 ℃时诱导2种融合蛋白的表达量明显高于其他温度时的表达水平;同样在16 ℃诱导条件下,2种融合蛋白表达量分别在6 h和9 h 时达到最高,之后随着时间的递增趋于稳定,再无明显增多。所以确定2种融合蛋白最佳表达条件分别为:SUMO-FeIFN-ω融合蛋白加入IPTG终浓度为0.6 mmol/L,16 ℃诱导6 h时表达量最高;SUMO-FeIFN-γ融合蛋白加入IPTG终浓度为0.8 mmol/L,16 ℃诱导9 h时表达量最高。

M.蛋白分子质量标准;A~C.pET28a-SUMO-FeIFN-ω ;A1~A9.以0、0.2、0.4、0.6、0.8、1.0、1.2、1.4 mmol/L的IPTG浓度诱导的重组菌产物;B1~B4.37 ℃、30 ℃、22 ℃、16 ℃诱导的重组菌产物;C1~C9.重组菌诱导0、3、6、9、12、15、18、21、24 h的产物;D~F.pET28a-SUMO-FeIFN-γ; D1~D9.以0、0.2、0.4、0.6 mmol/L、0.8、1.0、1.2、1.4、1.6 mmol/L的IPTG浓度诱导的重组菌产物;E1~E4.37 ℃、30 ℃、22 ℃、16 ℃诱导的重组菌产物;F1~F9.重组菌诱导0、3、6、9、12、15、18、21、24 h的产物
2.7 SUMO-FeIFN-ω和SUMO-FeIFN-γ融合蛋白的纯化结果
以摸索的最佳条件大量表达2种融合蛋白,将诱导表达后的菌体离心、重悬、冰浴超声破碎,之后收集上清液,通过1.2.5的步骤纯化蛋白,经SDS-PAGE检测表明,洗脱得到的2种融合蛋白分别在35 ku和34 ku处出现清晰的单一条带(图6)。
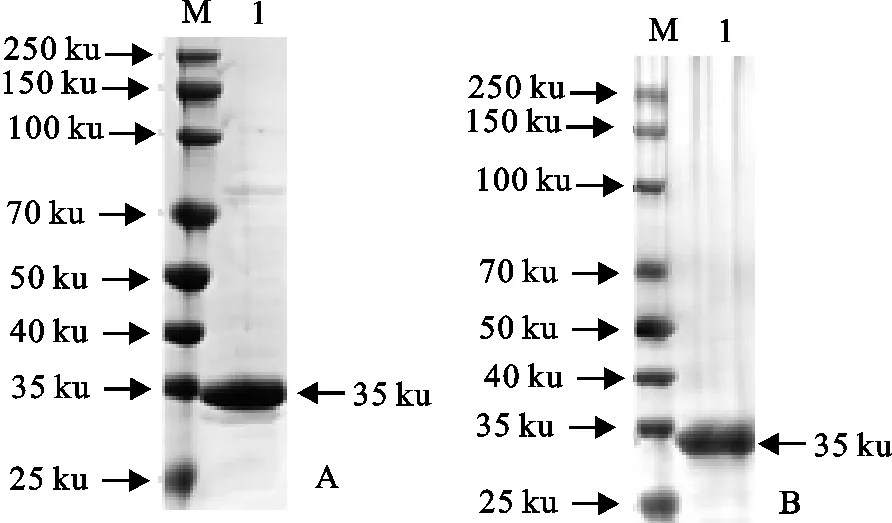
A.SUMO-FeIFN-ω;B.SUMO-FeIFN-γ;M.蛋白分子质量标准;1.样品A.SUMO-FeIFN-ω;B.SUMO-FeIFN-γ;M.Protein molecular weight Marker;1.Sample
2.8 SUMO-FeIFN-ω和SUMO-FeIFN-γ融合蛋白的酶切分析和纯化结果
用SUMO蛋白酶切割纯化后的2种融合蛋白,结果表明在4 ℃条件下酶切6 h后,去标签蛋白的量随着时间延长无显著增多(图7),所以选择酶切6 h即可。酶切后通过1.2.6的步骤纯化出的蛋白即为去除SUMO标签的FeIFN-ω和FeIFN-γ蛋白,用SDS-PAGE检测表明获得了纯度较高且无杂蛋白的目的蛋白,去除SUMO标签后蛋白条带大小分别约为18 ku和17 ku,与预期结果相符。利用Bradford测定法以BSA作为标准蛋白质测得FeIFN-ω和FeIFN-γ蛋白含量分别为0.79 mg/mL和0.85 mg/mL。

M.蛋白分子质量标准;A1~A6.SUMO蛋白酶;酶切SUMO-FeIFN-ω融合蛋白3、6、9、12、0 h;B1~B6.SUMO蛋白酶;酶切SUMO-FeIFN-γ融合蛋白3、6、9、12、0 h;C1~C5.SUMO-FeIFN-ω融合蛋白浓缩后截留液(30 ku截留柱);酶切SUMO-FeIFN-ω融合蛋白6 h;SUMO-FeIFN-ω融合蛋白截留液(30 ku截留柱);SUMO-FeIFN-ω融合蛋白流穿液(30 ku截留柱);FeIFN-ω蛋白截留液(10 ku截留柱);D1~D5.SUMO-FeIFN-γ融合蛋白浓缩后截留液(30 ku截留柱);酶切SUMO-FeIFN-γ融合蛋白6 h;SUMO-FeIFN-γ融合蛋白截留液(30 ku截留柱);SUMO-FeIFN-γ融合蛋白流穿液(30 ku截留柱);FeIFN-γ蛋白截留液(10 ku截留柱)
3 讨论
干扰素作为机体重要的防疫系统成员能够对抗病毒感染,防止病毒在体内快速扩散,而体外表达的干扰素与天然干扰素具有高度相似的生物学活性[16,18]。所以体外表达的猫干扰素有望增强宠物猫的免疫力,降低患病率和病死率。干扰素ω首先在人类中被发现,现已鉴定出在猫、兔、牛和猪的基因组中均存在着有功能的IFN-ω[15]。1985年,IFN-ω基因已经被发现而且认为该家族至少有4个成员,2007年杨利敏等研究猫干扰素ω并对其可溶性表达进行初步研究[19-20]。但这些已报道的文献中,猫干扰素ω在大肠埃希氏菌中主要以不可溶的包涵体形式表达。IFN-γ作为新的基因产品,其优点是毒性小、抗原性弱并可多次利用,在抗肿瘤细胞增殖和免疫调节方面发挥主要作用,而将IFN-γ作为佐剂给动物免疫时,可以增强机体的抵抗能力,表明IFN-γ在作为治疗制剂或疫苗佐剂使用时,能够取得良好效果,也有研究发现IFN-γ能够诱导Ⅰ型干扰素的表达[15,21]。目前IFN-γ已广泛应用于治疗牛、羊、猪的疾病,而有关猫IFN-γ的研究和应用鲜见报道。
蛋白质的结构与功能密切相关。对信号肽的预测可为表达前的引物设计和载体构建提供有价值信息[22],分泌蛋白可能具备正常功能的前提是在其前体合成时需要去除信号肽段。本研究克隆不包含信号肽的成熟蛋白基因序列,构建了原核表达质粒,并转化BL21感受态细胞进行表达和纯化。大肠埃希氏菌表达系统具有表达水平高、操作简便、容易培养和控制等优点,但表达过程中目的蛋白容易形成包涵体,而非天然构象的功能蛋白需要重新折叠复性才能获得其原有的生物活性,所以有必要表达能够直接折叠正确的可溶性蛋白。本研究中使用了带有SUMO助溶标签的pET28a-SUMO表达载体,从而实现了两种目的蛋白的可溶性表达。该表达载体是将pET28a进行改造使其在N端His标签后融合一个SUMO标签,可以提高外源蛋白的可溶性表达水平,促进其正确折叠且具备生物学活性[23],使纯化步骤更为简便。
对动物干扰素进行原核表达时发现,除了基因本身的序列影响表达量外,诱导表达条件(如诱导时间、诱导温度和诱导剂浓度等)同样重要[24],所以要将表达条件作为关键部分进行优化和分析。诱导剂IPTG有细胞毒性,高浓度的IPTG可能会诱导融合蛋白快速、大量表达而形成包涵体[25]。本研究表明与未加入IPTG诱导剂相比,使用IPTG诱导剂的表达量明显增多,但当IPTG的终浓度分别为0.6 mmol/L、0.8 mmol/L时,2种融合蛋白的表达水平达到最高,之后便趋于稳定;低温能够减慢蛋白合成的速率,改变多肽折叠的动力学,增加蛋白的正确折叠[26]。本研究表明相同诱导条件下,16 ℃诱导时2种融合蛋白表达量最高,这与文献报道的降低温度可获得融合蛋白的可溶性表达一致[27];低温下大肠埃希氏菌生长缓慢,一般选择通过延长诱导表达时间来增加蛋白表达量,但随着营养物质的消耗,菌体的生长会趋于停滞,蛋白的表达不会再明显增加[26]。本研究表明在16 ℃诱导下,2种融合蛋白表达量分别在6 h和9 h时达到最高,之后随着时间的递增变化并不显著。所以确定最终能够获得2种融合蛋白高表达量的条件为:SUMO-FeIFN-ω融合蛋白使用IPTG的终浓度为0.6 mmol/L,16 ℃诱导6 h;SUMO-FeIFN-γ 融合蛋白使用IPTG的终浓度为0.8 mmol/L,16 ℃诱导9 h。进一步说明通过降低诱导温度和控制IPTG浓度、选择合适的载体和表达宿主菌、优化融合标签等方法可提高融合蛋白的可溶性表达[28]。本研究实现了2种融合蛋白的可溶性表达,经镍柱纯化后用SUMO蛋白酶在4 ℃条件下酶切6 h去除SUMO标签,再经过2次截留柱纯化后得到不含标签的FeIFN-ω和FeIFN-γ,为后期抗病毒药物的开发奠定了基础。
