Versican与胃癌上皮-间质转化相关蛋白的表达及意义
2022-02-10杨迷玲杨金花徐宪伟姜海波郝义彬
杨迷玲 杨金花 王 娜 徐宪伟 姜海波 郝义彬
胃癌是消化道常见的恶性肿瘤之一,严重影响人类健康[1]。胃癌的发生、发展是多因素参与的过程,遗传和环境因素是其发病机制的重要因素[2]。上皮-间质转化(epithelial-mesenchymal transition, EMT)在包括胃癌在内的上皮性恶性肿瘤的侵袭、转移过程中起着重要作用。EMT是一个动态的过程,在细胞信号因子的刺激下上皮细胞转化为间充质细胞,细胞形态的改变使细胞的侵袭和转移能力增强。有研究报道,Versican高表达与胃癌患者的生存相关,但是和胃癌患者的生存有两种观点, Versican与胃癌上皮-间质转化的关系尚未见报道[3,4]。因此,本研究运用免疫组化和qRT-PCR检测胃癌组织中Versican与上皮-间质转化相关蛋白E-钙黏蛋白(E-cadherin)和N-钙黏蛋白(N-cadherin)的表达,分析它们之间的相关性及与临床病理特征的关系,并进一步分析Versican蛋白表达对胃癌患者生存期的影响。
材料与方法
1.临床资料:选取郑州人民医院病理科2012年1月~2016年12月病理诊断为胃癌的石蜡标本167例,其中男性123例,女性44例,患者年龄25~88岁。按照WHO分类标准,高-中分化者76例,低-未分化者91例;临床分期Ⅰ~Ⅱ期86例,Ⅲ~Ⅳ期81例;有淋巴结转移者94例,无淋巴结转移者73例;按1965年Lauren分型,肠型90例,弥漫型77例。同时收集相应的癌旁正常胃黏膜组织(距肿瘤切缘>5cm)作为对照组。有完整5年随访资料的患者120例,患者无病生存期从手术之日开始计算,终止日期为肿瘤复发日期或末次随访日期。选取其中30例新鲜胃癌组织和相应的癌旁胃黏膜组织于-196℃液氮保存,用于qRT-PCR检测。所有病例术前均未进行放疗和化疗。本研究所有标本的使用均经患者知情同意,并通过郑州人民医院医学伦理学委员会审批(伦理审批号:2018L02009)。
2.主要试剂:浓缩型兔抗人多克隆抗体Versican(克隆号:ab19345)购自英国Abcam公司;鼠抗人单克隆抗体E-cadherin和N-cadherin及ElivisionTM染色试剂盒均购自福州迈新公司;qRT-PCR检测试剂盒购自美国Invitrogen公司;引物由ABI公司的Primer Express Software v2.0设计。
3.免疫组织化学:组织标本由10%甲醛溶液固定,取材,脱水,石蜡包埋,4μm厚连续切片、烤片、脱蜡并水化,采用枸橼酸盐缓冲液高温高压修复,然后用免疫组织化学EliVision法染色。免疫组化操作步骤严格按照试剂盒说明书进行。DAB显色,苏木精复染,盐酸乙醇分化,氨水返蓝,脱水,透明,封片。以PBS代替一抗作为阴性对照,已知阳性切片作为阳性对照。
4.免疫组化结果判定:所有指标的结果均由两位有经验的病理科医生经双盲法独立评估。Versican的阳性着色为癌细胞周围的癌相关纤维母细胞胞质呈棕黄色。参照文献[5]的判定标准,据染色强度进行半定量判定分为3个等级:弱阳性为1级;中等阳性为2级;强阳性为3级。根据间质阳性细胞的百分比判定:0~100%,然后根据平均百分比(30%)及染色强度综合判定:间质阳性细胞数<30%且染色强度为强阳性判定为低表达,间质阳性细胞数≥30%且染色强度为强阳性判定高表达。E-cadherin主要表达于细胞膜,>50%的细胞呈棕黄色颗粒定义为阳性; N-cadherin表达于细胞膜,>10%的细胞呈棕黄色颗粒定义为阳性。
5.qRT-PCR检测:总RNA提取,反转录,荧光定量PCR扩增,分析数据。实时荧光定量PCR在PCR仪上96孔板中进行,重复做3次平行实验。反应中的Ct值数据的采用校正的阈值设定,以β-actin作为内参基因,采用2-ΔΔCt法进行相对定量。β-actin正向引物:5′-CATGTACGTTGCTATCCAGGC-3′,反向引物:5′-CTCCTTAATGTCACGCACGAT-3′;Versican正向引物:5′-CAAGCTGCTGGCAAGTGATG-3′,反向引物:5′-GCCGCCCTGTAGTGAAACAC-3′;E-cadherin正向引物:5′-AAAGAGCCCTTACTGCCCCC-3′,反向引物:5′-TGTGCAGCTGGCTCAAGTCA-3′;N-cadherin正向引物:5′-CTGCAGCAGCCTGACACTGT-3′,反向引物:5′-CAGATCGGACCGGATACTGG-3′。
结 果
1.Versican、E-cadherin和N-cadherin蛋白在癌旁胃黏膜和胃癌中的表达:Versican在癌旁正常胃黏膜中的阳性率为19.76%(33/167),显著低于在胃癌组织中的阳性率为72.46%(121/167,χ2=61.084,P=0.000)。Versican主要表达于胃癌细胞周围的癌相关纤维母细胞的胞质。E-cadherin在胃癌及癌旁胃黏膜组织中主要定位于细胞膜,呈棕黄色颗粒状,胃癌中E-cadherin的阳性表达率明显低于癌旁胃黏膜,差异有统计学意义(χ2=10.066,P=0.002)。N-cadherin在胃癌及癌旁胃黏膜组织中主要表达于细胞膜,棕黄色颗粒状,胃癌中N-cadherin的阳性率明显高于癌旁胃黏膜组织,差异有统计学意义(χ2=4.365,P=0.037,图1、表1)。
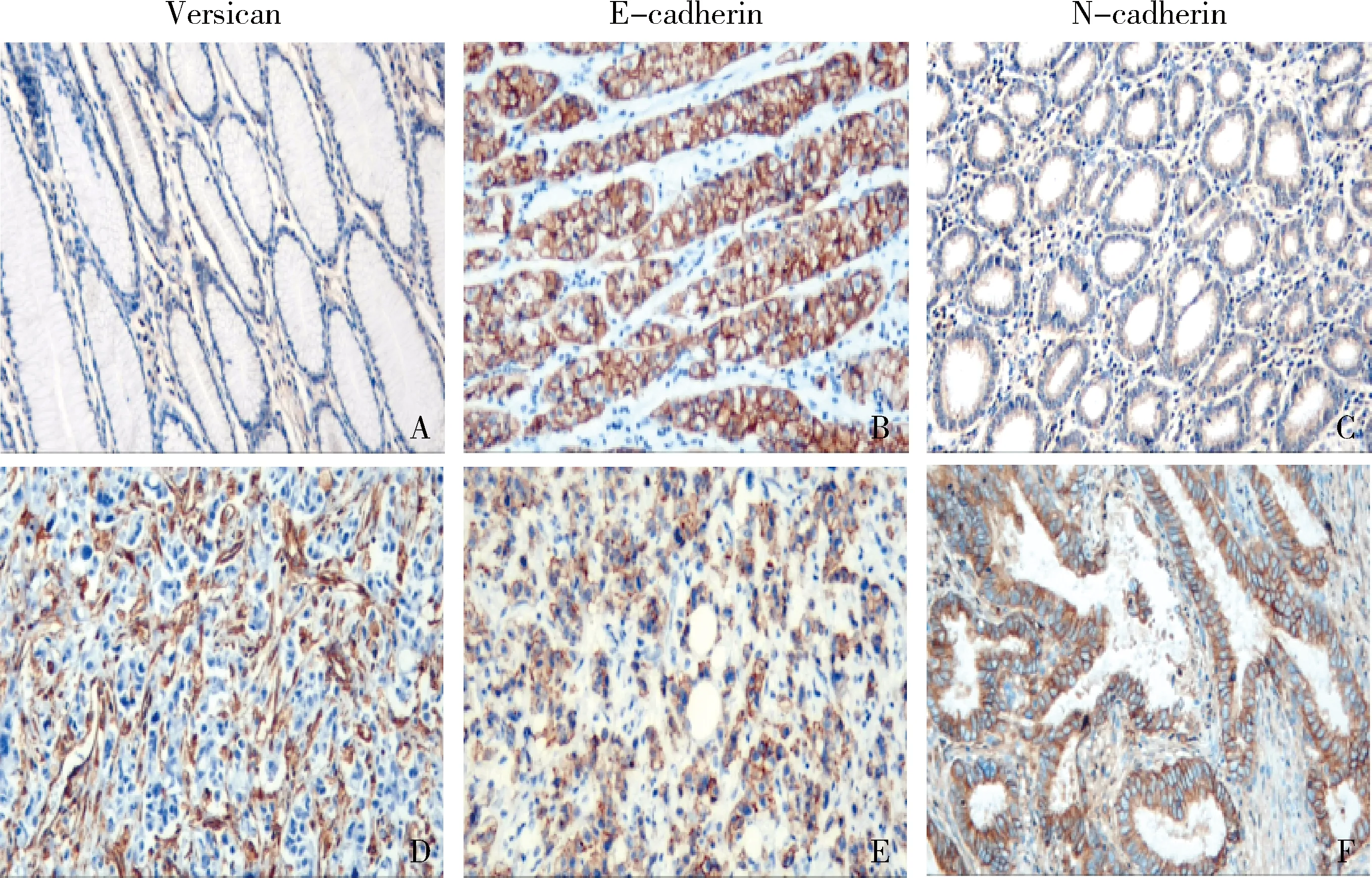
图1 Versican、E-cadherin和N-cadherin在胃癌和癌旁组织中的表达(免疫组化染色,×100)A~C.癌旁组织; D~F.胃癌组织

表1 胃癌和癌旁胃黏膜组织中Versican、E-cadherin和N-cadherin蛋白的表达[n(%)]
2.Versican、E-cadherin和N-cadherin mRNA在癌旁胃黏膜和胃癌中的表达:胃癌中Versican和N-cadherin mRNA的表达水平显著高于癌旁胃黏膜(P<0.001),E-cadherin mRNA的表达水平显著低于癌旁胃黏膜(P<0.001,图2)。

图2 胃癌组织及癌旁组织中Versican、E-cadherin和N-cadherin mRNA的相对表达水平
3.Versican、E-cadherin和N-cadherin蛋白的表达与胃癌各临床病理参数的关系:Versican蛋白在低-未分化胃癌中的表达显著高于高-中分化胃癌,临床分期Ⅲ~Ⅳ期,浸润深度达浆膜及淋巴结出现转移时Versican的表达增加(P均<0.05)。E-cadherin蛋白的表达与胃癌的Lauren分型、分化程度、浸润深度、临床分期和淋巴结转移显著相关(P<0.05),即随着胃癌浸润深度的加深、临床分期的进展及淋巴结出现转移时,E-cadherin蛋白的表达逐渐减少,在低-未分化组的表达率低于高-中分化组,在弥漫型胃癌中的表达率低于肠型胃癌。N-cadherin在胃癌组织中与胃癌的Lauren分型、浸润深度、临床分期和淋巴结转移显著相关(P<0.05),当胃癌浸润深度达浆膜,临床分期达Ⅲ、Ⅳ期及淋巴结出现转移时,N-cadherin蛋白的表达逐渐增加,详见表2。

表2 Versican、E-cadherin和N-cadherin的表达与167例胃癌各临床病理参数的关系(n)
4.胃癌组织中Versican与E-cadherin和N-cadherin之间的相关性分析:Spearman等级相关性分析结果显示,Versican的表达与E-cadherin的表达呈负相关(r=-0.638,P=0.000),Versican的表达与N-cadherin的表达呈正相关(r=0.313,P=0.000,表3)。

表3 胃癌中Versican与E-cadherin和N-cadherin的Spearman相关性分析(n)
5.胃癌组织中Versican蛋白的表达与患者生存期的关系:有5年完整随访资料的120例胃癌患者的无病生存率为54.2%(65/120)。Versican蛋白高表达者的无病生存率49.2%(32/65)低于Versican低表达者60.0%(33/55),差异有统计学意义(Log-rank=8.805,P=0.003,图3)。COX比例风险模型分析结果显示,Versican高表达(Wald=8.552,P=0.003)是影响胃癌患者预后的独立危险因素(表4)。
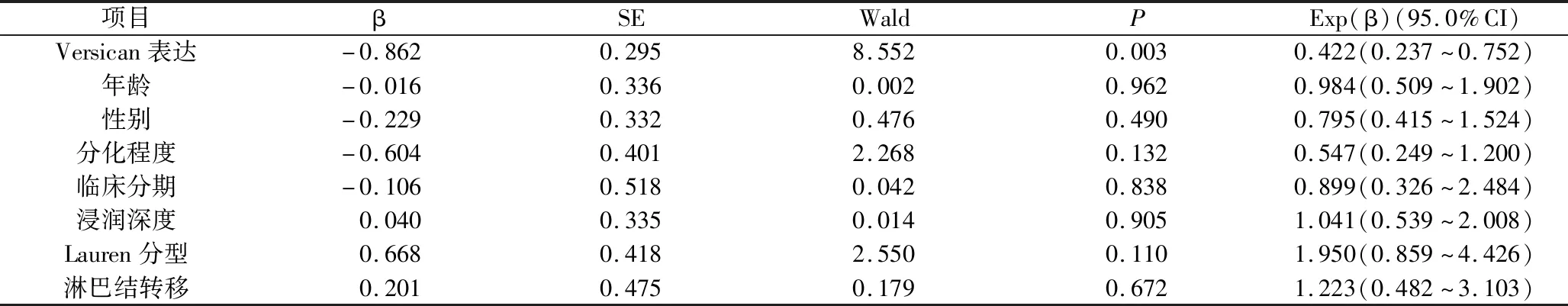
表4 胃癌患者多因素生存分析(n=120)

图3 胃癌组织中Versican蛋白表达与患者预后的Kaplan-Meier生存曲线
讨 论
肿瘤的发生、发展是肿瘤细胞和肿瘤微环境相互作用的过程,肿瘤的微环境包括各种细胞群、细胞外基质、激素、生长因子等。在肿瘤微环境中,细胞外基质具有重要的生物学功能。多功能蛋白聚糖(Versican)属于蛋白聚糖家族,是一种硫酸软骨素蛋白多糖(CSPG),是细胞外基质的主要成分,是肿瘤微环境的必要成分,Versican由3个不同的区域组成,有5个亚单位,不同的亚单位有不同的功能[6]。Versican在胚胎发育和疾病发展中起重要作用,在细胞的黏附、增殖、迁移和血管生成中发挥调节作用[7~9]。Versican在肿瘤的进展中起重要作用,在多种恶性肿瘤中异常表达,包括上皮源性肿瘤和间叶源性肿瘤[10~14]。
有人通过基因检测研究认为,与正常胃黏膜比较,Versican在胃癌中高表达,高表达的Versican与胃癌患者的不良预后有关[3]。本研究分别采用RT-PCR法和免疫组织化学法在基因水平和蛋白水平上均证实了Versican在胃癌组织中表达升高,与上述研究结果一致。免疫组化结果显示,Versican蛋白在胃癌的间质纤维母细胞中高表达,且其表达水平在分化程度越低、临床分期越晚、淋巴结出现转移时越高,说明Versican与胃癌的进展和淋巴结转移有关。在膀胱癌和葡萄膜黑色素瘤中Versican mRNA高表达,并且Versican mRNA高表达者患者预后不良[11,12]。在食管鳞癌间质纤维母细胞中高表达的Versican与患者的无病生存率有关,是食管癌患者预后的独立危险因素[13]。本研究运用Kaplan-Meier分析显示,Versican高表达者患者的无病生存率低于低表达者,COX风险比例模型分析显示Versican高表达是影响胃癌患者预后的独立危险因素。
转移是影响胃癌患者预后的关键因素,胃癌的侵袭、转移与胃癌细胞发生EMT有关。EMT是上皮细胞在特定的生理和病理条件下转化为间质细胞的现象。在这个过程中上皮细胞标志物E-cadherin表达下调,上皮细胞的特性和行为受到抑制,同时间质标志物N-cadherin表达上调,获得间质细胞的特点,细胞变成梭形,运动能力增强,因此,EMT是肿瘤细胞发生侵袭、转移的主要机制之一[15,16]。本研究结果显示,胃癌组织中Versican和N-cadherin的阳性率显著高于正常胃黏膜,而E-cadherin的阳性率则显著低于正常胃黏膜,并且均与分化程度、临床分期和淋巴结转移相关,表明Versican、E-cadherin和N-cadherin共同参与了胃癌的发生、发展。
研究发现,Versican在乳腺癌、肝细胞癌和白血病中表达均升高,并且可以促进肿瘤细胞上皮-间质转化进而促进肿瘤浸润转移[17~19]。本研究通过相关分析发现Versican与E-cadherin表达呈负相关,与N-cadherin表达呈正相关,表明胃癌中高表达的Versican可能通过使胃癌细胞形态发生变化,失去上皮细胞的形态,获得间质细胞表型,即E-cadherin表达减少,N-cadherin表达增高,细胞的黏附能力降低,运动能力增强,进而促进上皮-间质转化的发生。本研究显示,胃癌中Versican高表达者,临床上患者处于进展期,更易发生淋巴结转移,并且5年无病生存率较低。但也有研究认为胃癌上皮细胞中Versican高表达者患者预后较好[20]。这与本研究结果不一致,可能是因为观察目标不同,本研究观察的是胃癌细胞周围的间质纤维母细胞中的Versican,胃癌细胞发生上皮-间质转化后,上皮成分减少,间质成分增多,间质中的Versican表达也增多,进一步促进肿瘤细胞上皮-间质转化,形成恶性循环。
综上所述,胃癌组织中Versican和N-cadherin的表达均增高,而E-cadherin的表达则减少,并且Versican与N-cadherin呈正相关,与E-cadherin呈负相关,Versican是胃癌患者预后的独立危险因素,这提示Versican可能是通过调节胃癌细胞上皮-间质转化来促进胃癌发生浸润、转移的,Versican有望成为判断胃癌预后的标志物,其具体机制需开展后续实验予以进一步证实。
