过表达FOXO1脂肪干细胞调控自噬对高糖诱导足细胞损伤修复的机制研究
2022-02-10陶海英孔祥静
陶海英 孔祥静 马 翠
糖尿病肾病(diabetic nephropathy,DN)是糖尿病的并发症,也是糖尿病患者死亡的主要原因之一[1]。在发展中国家,尤其在中国DN的发生率正在逐年增加[2]。然而,DN患者的临床特征是持续性白蛋白尿、肾小球基膜厚度增加和细胞外基质聚集,进而导致抑制细胞自噬和足细胞损伤等,最终发展成DN[3]。目前,DN患者的治疗方式主要通过针对高血糖和血压的管理,但治疗效果十分有限[4]。FOXO1是一种转录因子,且FOXO1可通过诱导自噬体形成参与调控细胞分化[5]。笔者所在课题组前期研究表明,FOXO1对DN具有保护作用,但其具体的作用机制尚不清楚。本研究从C57BL/6小鼠中分离出脂肪干细胞(adipose-derived stem cells,ADSCs),构建了过表达FOXO1的ADSCs细胞。进一步探究过表达FOXO1的ADSCs细胞在DN中的作用,为DN患者寻找新的治疗方向。
材料与方法
1.材料:C57BL/6小鼠来自于杭州医学院;小鼠肾足细胞(MP5细胞)购自中国科学院细胞库(上海);RPMI1640、DMEM培养基、胎牛血清、胶原酶和胰蛋白酶购自美国Gibco公司;慢病毒过表达FOXO1载体和空白对照载体由上海吉玛生物公司构建;FOXO1、CD29、CD90、CD34、CD45、Bax、Bcl-2、p62、LC3、β-actin和山羊抗兔IgG购自美国Cell Signaling Technology公司;Annexin Ⅴ-FITC/PI凋亡检测试剂盒、地塞米松、β-甘油磷酸钠、抗坏血酸、胰岛素、吲哚美辛、异丁基1甲基黄嘌呤、Triton x-100和多聚甲醛等购自北京Solarbio公司。
2.细胞分离和培养:收集C57BL/6小鼠腹股沟皮下脂肪组织,利用胶原酶消化法分离ADSCs。首先,脂肪组织切碎PBS洗涤2次,1200r/min离心10min。除去上清液将胶原酶加入沉淀中,在40min后加入完全培养基。然后,过滤细胞并用1500r/min离心8min,随后用1640培养基重悬,最后得到ADSCs细胞。ADSCs 和 MPC5细胞体外间接共培养:取第3代ADSCs(1×105个/毫升)和 MPC5细胞(1×105个/毫升)按1∶1接种于Transwell系统的上室与培养板中间接共培养。过表达FOXO1载体和空白载体慢病毒感染ADSCs 48h后,得到ADSCs(FOXO1+)(过表达FOXO1的ADSCs 细胞)和ADSCs(转染空白对照载体的ADSCs细胞)。
3.细胞分组:实验分为对照组、高糖组、高糖+ADSCs组、高糖+ADSCs(FOXO1+)组和高糖+ADSCs(FOXO1+)+自噬抑制剂3-MA组。对照组为5.5mmol/L D-葡萄糖培养的MPC5细胞;高糖组为30mmol/L D-葡萄糖培养的MPC5细胞;高溏+ADSCs组为转染空白对照载体的ADSCs与MPC5在30mmol/L D-葡萄糖环境下间接共培养;高糖+ADSCs(FOXO1+)组为过表达FOXO1的ADSCs与MPC5在30mmol/L D-葡萄糖环境下间接共培养;高糖+ADSCs(FOXO1+)+自噬抑制剂3-MA组为过表达FOXO1的ADSCs与MPC5在30mmol/L D-葡萄糖环境下间接共培养,同时用自噬抑制剂3-MA处理。
4.ADSCs的成骨和成脂分化及鉴定:ADSCs成骨分化能力,将ADSCs传代3次后接种于6孔板培养24h后,用成骨培养基(含10%胎牛血清、1μmol/L地塞米松、1μmol/L β-甘油磷酸钠和50μg/ml抗坏血酸)诱导ADSCs 14天。将诱导ADSCs用PBS洗涤3次,4%多聚甲醛固定15min。然后,用0.2%茜素红染色20min,洗涤后光学显微镜下观察染色结果并拍照。ADSCs成脂分化能力:将ADSCs在成脂培养基(含10%胎牛血清、1μmol/L地塞米松、60μmol/L吲哚美辛、0.5μmol/L 3-异丁基-1-甲基黄嘌呤和10μg/ml胰岛素)中培养7天;然后,ADSCs经PBS清洗,多聚甲醛固定5min,丙二醇中染色5min和油红O染色15min。最后,ADSCs用油红染色30s后显微镜观察并拍摄图片。
5.流式细胞术检测细胞凋亡:第3代ADSCs经胰蛋白酶消化离心5min,取上清液用PBS重悬细胞,与一抗CD29、CD90、CD34和CD45孵育30min后,用10%正常山羊血清重悬细胞,并用流式细胞仪进行分析。按Annexin Ⅴ-FITC/PI检测试剂盒实验方法,取MPC5细胞加入5μl Annexin Ⅴ-/FITC避光反应20min后,再加入10μl PI避光孵育10min,采用流式细胞仪检测染色MPC5细胞凋亡情况。
6.CCK-8法检测细胞活力:按照CCK-8试剂盒说明来检测各组MPC5细胞增殖情况,将MPC5细胞(5×103个/孔)接种于96孔板中,培养结束后加入CCK-8溶液培养4h后通过酶标仪检测450nm处的A值。细胞活性(%)=(实验组A值/对照组A值)×100%。
7.免疫荧光:各组MPC5细胞用-20℃预冷的甲醇溶液固定30min,后用PBS洗涤3次。细胞用0.1% Triton X-100处理15min,用5% BSA封闭1h。MPC5细胞和与一抗LC3(1∶200)在4℃孵育过夜。后与二抗山羊抗兔IgG孵育1h后DAPI染色5min,最后采用共聚焦激光扫描显微镜(日本Olympus公司,FV1200)观察并拍照。
8.Western blot法检测:各组细胞采用裂解液提取总蛋白质,通过BCA试剂盒测定蛋白浓度,经电泳后转移至PDVF膜中,用5%脱脂牛奶封闭1h后并与一抗(FOXO1:1∶1000,Bax:1∶1000,Bcl-2:1∶1000,p62:1∶1000,LC3:1∶500,β-actin:1∶1000)在4℃过夜,后与二抗山羊抗兔IgG(1∶2000)反应1h,随后通过ECL显色来获取显色蛋白条带。
结 果
1.ADSCs鉴定:ADSCs分离自C57BL/6小鼠的皮下脂肪组织。ADSCs传代3次后采用ADSCs的阳性标志物CD29、CD90以及阴性标志物CD34、CD45进行流式染色检测,来评估ADSCs纯度。流式细胞术检测结果显示,CD29(98.1%)和CD90(97.6%)在ADSCs中均高表达,而CD34(1.9%)和CD45(1.1%)表达极低,此结果表明该ADSCs具有间充质干细胞的特性(图1A)。另外,为了证实ADSCs的分化能力,将ADSCs在成骨培养基中进行培养,茜素红染色结果表明成骨培养基显著诱导了茜素红染色阳性细胞的数量(图1B)。同时,油红O染色结果显示,ADSCs具有较高的成脂潜力(图1C)。以上结果证实ADSCs分离成功。
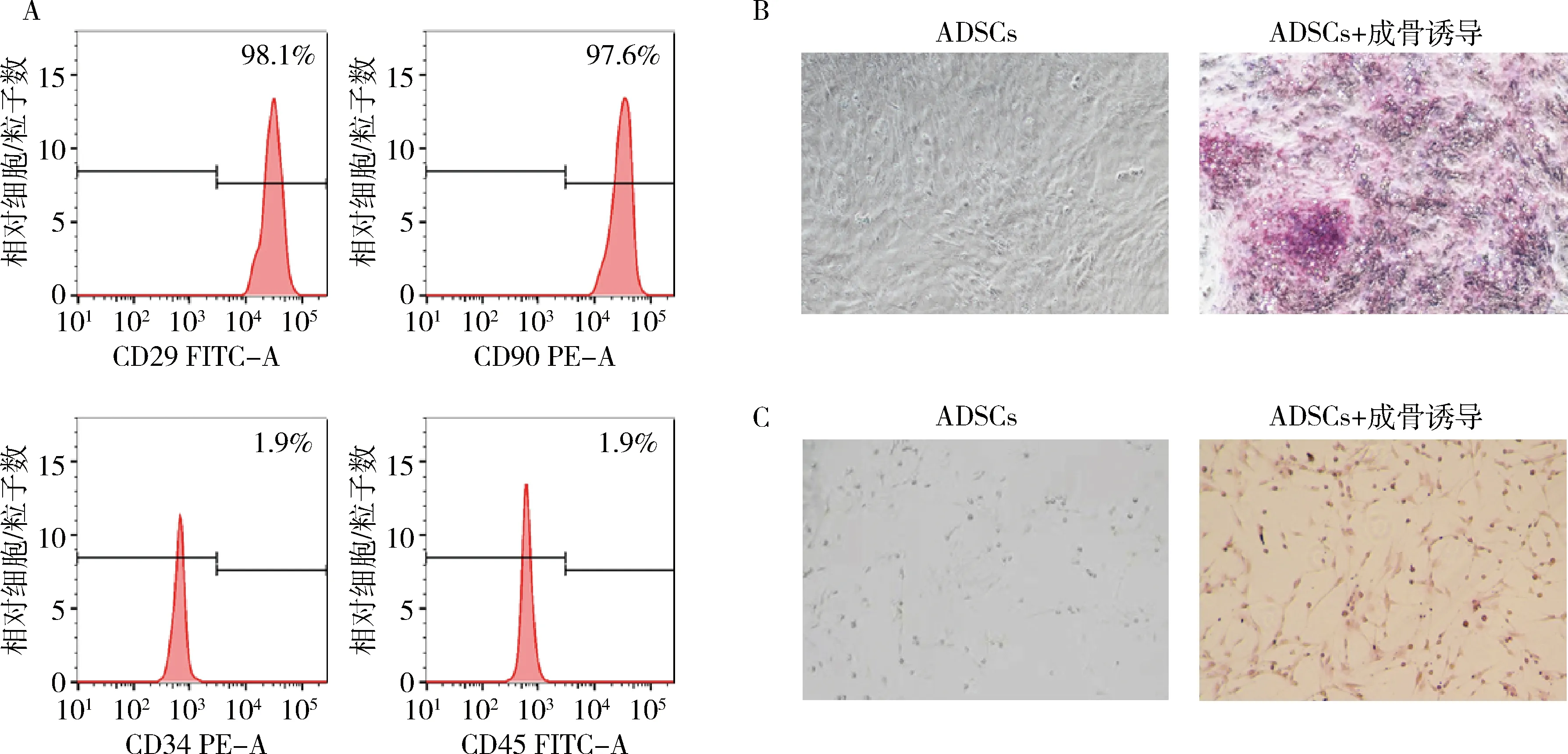
图1 ADSCs鉴定A.流式细胞术检测ADSCs中CD29、CD90、CD34和CD45的表达;B.ADSCs细胞的茜素红染色图(×100);C.ADSCs细胞的油红O染色图(×100)
2.FOXO1蛋白表达:研究表明,FOXO1可以调节脂肪细胞的分化[6]。笔者重点研究了FOXO1在高糖环境中诱导足细胞MPC5的调控机制,Western blot法检测结果显示,与对照组比较,FOXO1在高糖组MPC5中表达下调(图2B)。此外,笔者构建了过表达FOXO1的ADSCs细胞。Western blot法检测结果表明,与ADSCs比较,FOXO1在ADSCs(FOXO1+)细胞中高表达(图2A),这表明本实验成功构建了过表达FOXO1的ADSCs细胞[ADSCs(FOXO1+)]。
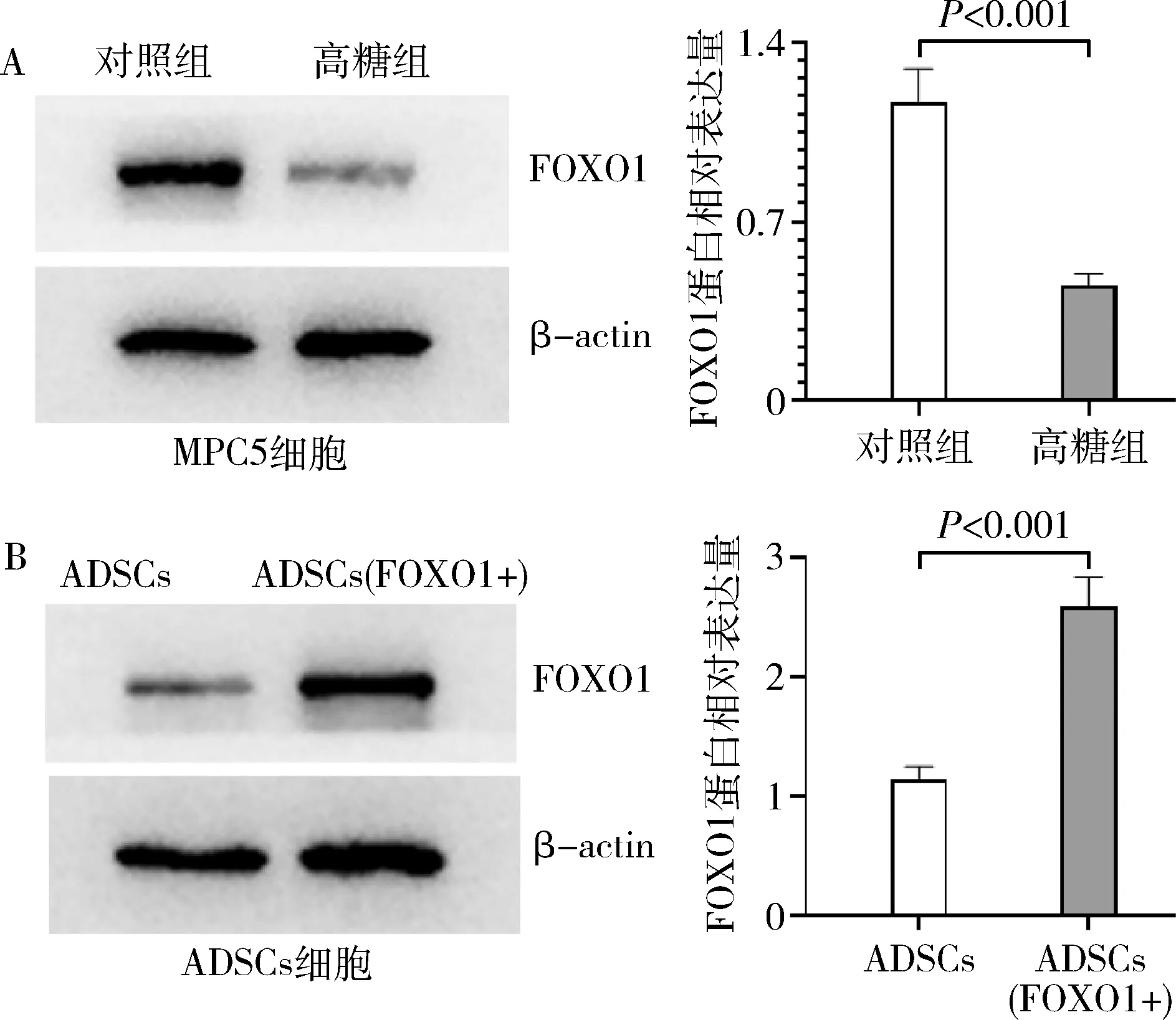
图2 FOXO1蛋白表达分析A.Western blot法检测MPC5中FOXO1的表达;B.Western blot法检测ADSCs中FOXO1的表达
3.ADSCs(FOXO1+)可有效抑制高糖诱导的MPC5细胞凋亡:高糖环境能够诱导足细胞凋亡,导致糖尿病肾病中足细胞损伤。因此,通过CCK-8和流式细胞术检测发现,与对照组比较,高糖组MPC5细胞活力显著降低,MPC5细胞凋亡显著上升,这验证了高糖能够诱导足细胞凋亡(图3中A和B)。另外,高糖处理的MPC5细胞与ADSCs间接共培养后,检测发现MPC5细胞凋亡率下降,而细胞活力增加;高糖处理的MPC5细胞与ADSCs(FOXO1+)细胞间接共培养后,发现细胞凋亡进一步降低,这表明ADSCs(FOXO1+)细胞抑制高糖诱导的MPC5细胞凋亡(图3C)。
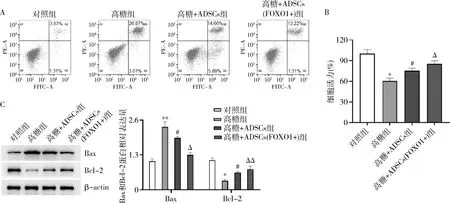
图3 ADSCs(FOXO1+)抑制高糖诱导的MPC5细胞凋亡A.流式细胞术检测MPC5细胞凋亡;B.CCK-8检测MPC5细胞活力,与对照组比较,*P<0.001;与高糖组比较,#P<0.01;与高糖+ADSCs组比较,ΔP<0.05;C.Western blot法检测凋亡相关蛋白Bax和Bcl-2的表达,与对照组比较,*P<0.05,**P<0.001;与高糖组比较,#P<0.05;与高糖+ADSCs组比较,ΔP<0.05,ΔΔP<0.01
4.ADSCs(FOXO1+)促进MPC5细胞自噬:FOXO1在细胞自噬诱导中发挥作用[7]。免疫荧光检测发现,与对照组比较,高糖组MPC5细胞的自噬相关蛋白LC3显著降低(图4A)。此外,将高糖处理的MPC5细胞与ADSCs间接共培养后,MPC5细胞的自噬水平增加;同时,高糖处理的MPC5细胞与ADSCs(FOXO1+)细胞间接共培养后,MPC5细胞的自噬相关蛋白LC3-Ⅱ表达进一步增加;以上结果表明ADSCs(FOXO1+)细胞可促进高糖抑制的MPC5细胞自噬(图4B)。
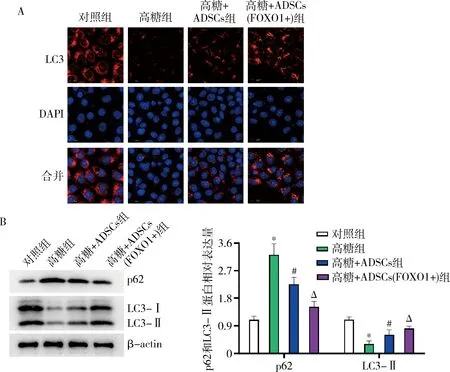
图4 ADSCs(FOXO1+)促进MPC5细胞自噬A.免疫荧光检测MPC5细胞的自噬相关蛋白LC3的表达;B.Western blot法检测自噬相关蛋白p62和LC3-Ⅱ的表达,与对照组比较,*P<0.001;与高糖组比较,#P<0.05;与高糖+ADSCs组比较,ΔP<0.05
5.ADSCs(FOXO1+)通过促进细胞自噬有效抑制高糖诱导的MPC5细胞凋亡:FOXO1过表达能够显著促进高糖抑制的MPC5细胞自噬和凋亡。本研究通过在细胞培养基中添加自噬抑制剂3-MA(5mmol/L)来抑制MPC5细胞自噬。免疫荧光检测显示,与高糖+ ADSCs(FOXO1+)组比较,高糖+ ADSCs (FOXO1+)+自噬抑制剂3-MA组的MPC5细胞的自噬相关蛋白LC3显著降低(图5A)。进一步流式细胞术检测发现,与高糖组比较,高糖+ADSCs(FOXO1+)组的细胞凋亡明显降低,但同时添加3-MA抑制细胞自噬后,发现ADSCs(FOXO1+)对高糖诱导的MPC5细胞凋亡的保护作用被逆转,这表明ADSCs(FOXO1+)细胞抑制高糖诱导的MPC5细胞凋亡依赖于细胞自噬(图5B)。CCK-8检测发现,与高糖+ADSCs(FOXO1+)组比较,高糖+ADSCs(FOXO1+)+自噬抑制剂3-MA组的MPC5细胞活力有所下降,提示ADSCs(FOXO1+)影响MPC5的细胞活力依赖于细胞自噬(图5C)。与此同时,Western blot法检测验证了抑制MPC5细胞自噬能够促进MPC5细胞凋亡(图5D)。
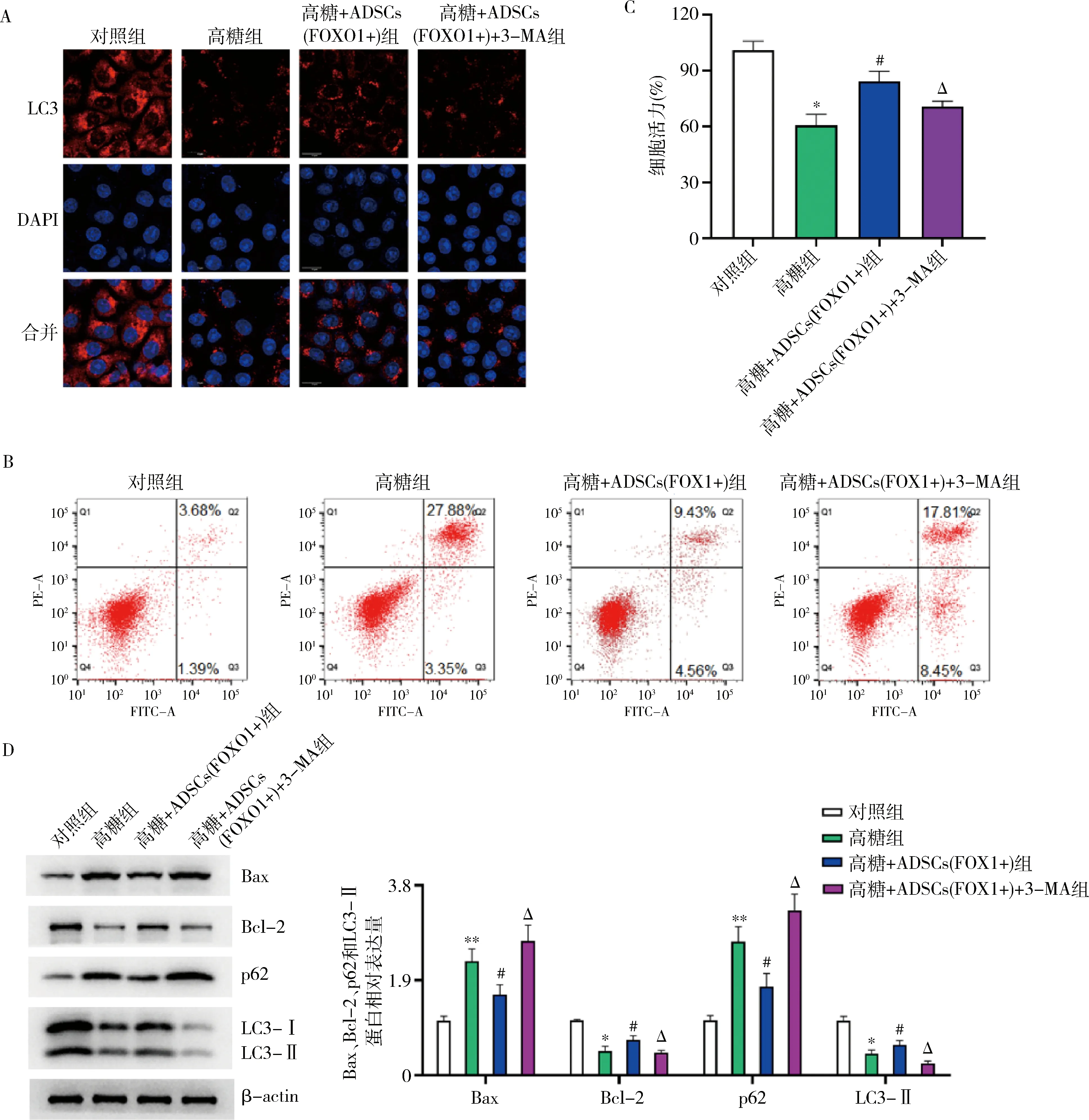
图5 ADSCs(FOXO1+)抑制高糖诱导足细胞损伤的调控机制A.免疫荧光检测MPC5细胞的自噬相关蛋白LC3表达;B.流式细胞术检测MPC5细胞凋亡;C.CCK-8检测MPC5细胞活力,与对照组比较,*P<0.001;与高糖组比较,#P<0.01;与高糖+ADSCs组比较,ΔP<0.05; D.Western blot法检测自噬相关蛋白Bax、Bcl-2、p62和LC3-Ⅱ表达,与对照组比较,*P<0.05,**P<0.01;与高糖组比较,#P<0.05;与高糖+ADSCs(FOXO1+)组比较,ΔP<0.05
讨 论
DN是以代谢紊乱和慢性炎症为特征的糖尿病并发症,同时DN足细胞功能障碍会加重糖尿病肾脏损伤[8]。因此,迫切需要新的治疗策略来改善DN损伤。本研究发现FOXO1通过调控自噬改善高糖诱导的足细胞损伤,为DN损伤的治疗提供了新的思路。
ADSCs已被证明对肾脏损伤具有保护作用,ADSCs也具有促进糖尿病大鼠肾脏细胞修复的潜能[9]。研究表明,ADSCs能够有效抑制DN足细胞凋亡,且ADSCs可以通过促进自噬和抑制足细胞凋亡来减轻DN[10,11]。本研究通过实验证实了ADSCs与MPC5细胞间接共培养能够降低高糖诱导MPC5细胞的凋亡,进而改善足细胞的损伤。本研究结果与既往研究报道具有一致性。
已有研究表明,自噬是细胞分解自身成分逃避多种应激条件来诱导细胞凋亡,而自噬也参与某些人类疾病的发展和分化[12]。在DN中增强细胞自噬能够保护细胞凋亡,且高糖能够诱导MPC5细胞发生自噬反应[13,14]。这些结论揭示增强细胞自噬能够改善高糖诱导的足细胞损伤,而在本研究中,高表达FOXO1的ADSCs可以促进高糖诱导的MPC5细胞的自噬,使MPC5细胞活力增加,这一结果与既往文献报道一致。
研究显示,激活FOXO1可以改善糖尿病大鼠肾细胞的损伤,而过表达FOXO1能够调控TXNIP来减少DN小鼠肾细胞凋亡[15,16]。同时,FOXO1通过影响脂肪干细胞在自噬过程中发挥重要作用[17]。因此,本研究着重探究高表达FOXO1的ADSCs对MPC5细胞的自噬影响。笔者的结果证实了过表达FOXO1的ADSCs能够促进高糖抑制的MPC5细胞自噬进而修复高糖诱导的足细胞损伤,但其具体的分子机制需进一步研究。
综上所述,本研究表明,过表达FOXO1的脂肪干细胞通过调控足细胞自噬,从而改善高糖诱导的足细胞损伤,为糖尿病肾病患者提供了新的治疗方向。
