CEP55和PLK1在卵巢浆液性癌中的表达及其临床意义
2022-02-10李晓蓉闫文佳
刘 艳 梁 钢 李晓蓉 闫文佳 肖 虹
卵巢浆液性癌(ovarian serous carcinoma, OSC)是卵巢癌最常见的组织病理学类型,75%以上的卵巢浆液性癌患者就诊时已是晚期,5年生存率仅为29%[1, 2]。在WHO女性生殖器肿瘤分类中指出,卵巢浆液性癌的发生、发展按照卵巢癌二元论的发病模型,分为低级别浆液性癌和高级别浆液性癌,并认为其绝大多数直接或间接起源于输卵管伞端上皮[3]。中心体相关蛋白55(centrosomal protein 55kDa, CEP55)是一种调节胞质分裂的蛋白,在多种肿瘤中表达增高,与肿瘤细胞的增殖、侵袭和转移等密切相关。PLK1(polo-like kinase 1, PLK1)是调控细胞周期的关键蛋白,主要参与中心体复制、纺锤体组装和胞质分裂等过程。在有丝分裂过程中,PLK1介导CEP55进行磷酸化,维持CEP55有序地募集至中间体,确保顺利完成胞质分裂。目前,国内外关于CEP55和PLK1在卵巢浆液性癌中的研究较少。因此,本研究应用免疫组化联合Western blot法探讨CEP55和PLK1在卵巢浆液性癌组织中的表达,分析两者的表达与患者临床病理因素的关系,旨在为卵巢浆液性癌的临床靶向治疗和预后评估提供一定的依据。
资料与方法
1.病例资料:收集山西医科大学第一医院2020年1月~2021年8月因盆腔肿物行手术切除的卵巢浆液性癌组织50例,其中,包括高级别浆液性癌组织30例和低级别浆液性癌组织20例,正常对照组为同一患者的正常输卵管伞端上皮组织50例,术后病理结果证实无肿瘤性病变。所有收集的新鲜组织均分为两部分,一部分制成石蜡组织标本,另一部分置于液氮中速冻,置于-80℃冰箱保存。所有组织切片均由2名妇科病理专家诊断完成。纳入标准:①临床资料记录完整;②术前均未行放疗和化疗等抗肿瘤治疗史。排除标准:①患有其他恶性肿瘤的病史;②临床资料不完整。患者年龄38~70岁,平均年龄为55岁,<55岁者20例,≥55岁者30例,采用国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)的分期系统对肿瘤进行分期,Ⅰ+Ⅱ期16例,Ⅲ+Ⅳ期 34例,发生淋巴结转移12例,未发生淋巴结转移38例[4]。本研究经山西医科大学第一医院医学伦理学委员会审批(伦理审批号:2022-K024),所有患者知情同意。
2.免疫组织化学染色:兔抗人CEP55单克隆抗体购自英国Abcam公司,小鼠抗人PLK1单克隆抗体购自美国Santa Cruz公司。所选组织标本均经10%中性甲醛溶液常规固定、常规脱水、石蜡包埋,4μm厚连续切片。免疫组化染色采用EnVision法,阴性对照以PBS代替一抗。石蜡切片经二甲苯脱蜡和梯度乙醇脱水后,分别置于pH值为9.0的EDTA缓冲液和pH值为6.0柠檬酸盐缓冲液中120℃ 3min,放入3%过氧化氢溶液中进行封闭内源性过氧化氢酶,15min;加入一抗CEP55(1∶300)和PLK1(1∶50),再置于37℃恒温箱孵育1h;PBS冲洗3次,每次2min,再加入二抗,37℃恒温箱孵育20min,PBS冲洗3次,每次2min;滴加DAB显色剂,镜检后自来水冲洗阻断显色;最后苏木精复染、分化、反蓝、脱水和封片。
3.免疫组织化学结果判读标准:染色判读方法是根据阳性细胞的染色强度和阳性细胞占肿瘤细胞的染色百分率两个方面进行综合性判断。CEP55蛋白表达主要定位在细胞质[5]。按阳性细胞染色强度评分:无着色为0分,淡棕黄色为1分,棕黄色为2分,深棕黄色为3分;按阳性细胞占肿瘤细胞的染色百分比例评分:阳性细胞百分比0为0分,1%~10% 为1分,11%~50%为2分,51%~75%为3分,76%~100%为4分。阳性细胞百分率与染色强度的乘积为最终结果,≥6分为高表达,<6分为低表达。PLK1表达定位在细胞质或细胞核[6]。按阳性细胞染色强度评分:无着色为0分,淡棕黄色为1分,棕黄色为2分,深棕黄色为3分;按阳性细胞占肿瘤细胞的染色百分比例评分:0%~10%为0分,11%~25% 为1分,26%~50%为2分, 51%~75%为3分,76%~100%为4分。两项评分结果相加为最终结果,0~1分为阴性(-),2~3分为弱阳性(+),4~6分为阳性(++),>6分为强阳性(+++);本研究中,<2分为阴性,≥2分为阳性。
4.Western blot法:使用细胞裂解液提取30例高级别浆液性癌、20例低级别浆液性癌和50例正常输卵管伞端上皮的新鲜组织中的总蛋白,BCA法测定蛋白浓度;将每对蛋白样本进行等量上样,在SDS聚丙烯酰胺凝胶上电泳和转至PVDF膜上,再经5%脱脂奶室温封闭1h,并加入一抗CEP55(1∶5000)和PLK1(1∶500)进行4℃摇床过夜孵育,次日回收一抗,洗涤后加入二抗在室温孵育1h,显影后用Image-Pro Plus软件进行观察。最后,通过计算CEP55和PLK1蛋白与内参蛋白灰度值及灰度值比值来分析CEP55和PLK1蛋白的表达水平。CEP55的相对分子质量为55kDa,PLK1的相对分子质量为68kDa,内参GAPDH的相对分子质量为36kDa。
结 果
1.免疫组化法检测CEP55和PLK1蛋白的表达: CEP55蛋白在卵巢浆液性癌组织中高表达率为60%(30/50),其中,高级别浆液性癌中高表达率为80%(24/30),低级别浆液性癌中高表达率为30%(6/20);在正常输卵管伞端上皮组织中高表达率为14%(7/50)。CEP55在卵巢浆液性癌组织中的蛋白表达高于正常输卵管伞端上皮组织,差异有统计学意义(χ2=22.694,P<0.001,图1)。PLK1蛋白在卵巢浆液性癌组织中阳性率为64%(32/50),其中,高级别浆液性癌中阳性率为90%(27/30),低级别浆液性癌中阳性率为25%(5/20);在正常输卵管伞端上皮组织中阳性率为10%(5/50)。PLK1在卵巢浆液性癌组织中的蛋白表达高于正常输卵管伞端上皮组织,差异有统计学意义(χ2=31.274,P<0.001,图2)。
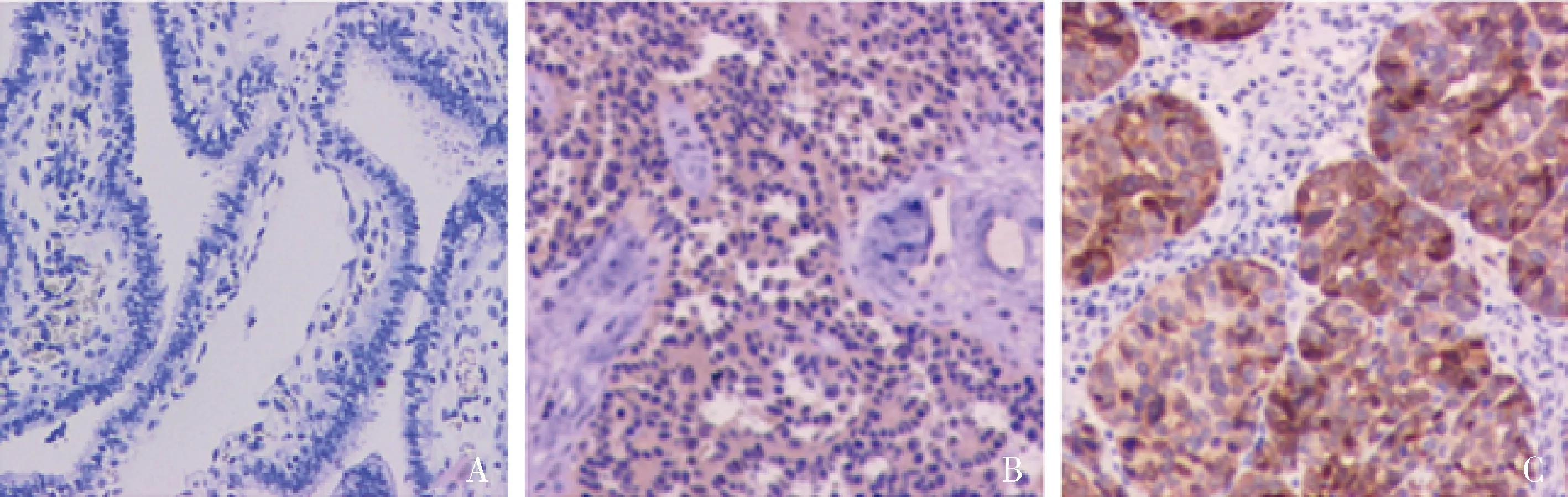
图1 免疫组化检测CEP55在3种组织中的表达(EnVision,×200)A.正常输卵管伞端上皮;B.低级别浆液性癌;C.高级别浆液性癌
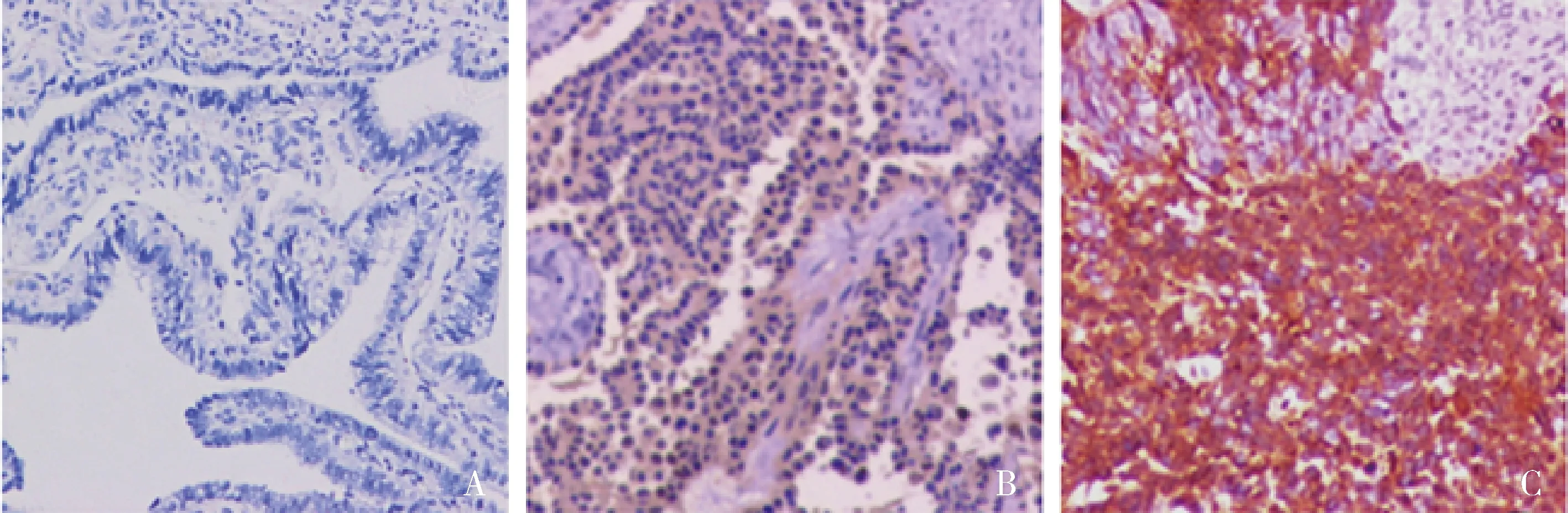
图2 免疫组化检测PLK1在3种组织中的表达(EnVision,×200)A.正常输卵管伞端上皮;B.低级别浆液性癌;C.高级别浆液性癌
2.Western blot法检测CEP55和PLK1的蛋白表达: CEP55蛋白在卵巢浆液性癌组织中的相对表达量(1.043±0.162)高于正常输卵管伞端上皮组织(0.457±0.061),差异有统计学意义(t=5.803,P<0.05)。其中,CEP55蛋白在高级别浆液性癌组织中的相对表达量(1.500±0.150)高于低级别浆液性癌组织(0.587±0.087)和正常输卵管伞端上皮组织(0.457±0.061),差异有统计学意义(F=85.662,P<0.001)。CEP55蛋白在低级别浆液性癌和正常输卵管伞端上皮组织中的相对表达量,差异无统计学意义(P>0.05,图3中A、B)。PLK1蛋白在卵巢浆液性癌组织中的相对表达量(0.648±0.073)高于正常输卵管伞端上皮组织(0.177±0.022),差异有统计学意义(t=10.869,P<0.05)。其中,PLK1蛋白在高级别浆液性癌组织中的相对表达量(1.046±0.166)高于低级别浆液性癌组织(0.251±0.080)和正常输卵管伞端上皮组织(0.177±0.022),差异有统计学意义(F=60.601,P<0.001)。低级别浆液性癌和正常输卵管伞端上皮组织的PLK1蛋白的相对表达量,差异无统计学意义(P>0.05,图3中A、C)。

图3 Western blot法检测CEP55和PLK1在3种组织中的蛋白表达量A.Western blot 法结果图(1.正常输卵管伞端上皮;2.低级别浆液性癌;3.高级别浆液性癌);B.CEP55相对表达量;C.PLK1相对表达量。*P<0.001
3.CEP55和PLK1表达与卵巢浆液性癌患者的临床病理特征的关系:CEP55的表达与患者的临床病理资料的分析结果显示,CEP55蛋白表达与组织学分级(χ2=12.500,P<0.001)、FIGO分期(χ2=7.414,P=0.006)、淋巴结转移(χ2=4.975,P=0.026)有关,与患者的年龄(χ2=0.347,P=0.556)无关。PLK1的表达与临床病理资料的相关性分析结果显示,PLK1蛋白表达与组织学分级(χ2=22.005,P<0.001)相关,但与患者的年龄(χ2=0.521,P=0.470)、FIGO分期(χ2=0.230,P=0.631)和淋巴结转移(χ2=1.576,P=0.209)无关(表1)。应用Spearman分析CEP55和PLK1蛋白在卵巢浆液性癌组织中表达的相关性,结果显示,在卵巢浆液性癌组织中CEP55和PLK1的蛋白表达呈正相关(r=0.408,P<0.05)。

表1 CEP55和PLK1在卵巢浆液性癌中表达与患者临床病理特征的关系
讨 论
CEP55是由Fabbro等[7]在2005年发现的一种EST FLJ10540编码的中心体相关蛋白,相对分子质量为55kDa,主要定位于人类染色体10q23.33。CEP55长期以来被认为是胞质分裂进行脱落的关键调节因子,负责调节两个子细胞的分离[8]。研究发现,CEP55过表达会引起胞质分裂紊乱,导致染色体错误分离和基因组不稳定,促进细胞进行肿瘤性增殖,提示CEP55过表达可能是肿瘤发生、发展的早期事件[9]。有研究表明,CEP55通过参与PI3K/Akt通路、JAK2/STAT3 通路和Akt/FoxM1通路等多种信号通路来促进肿瘤细胞的增殖、迁移和侵袭[10~14]。近年来研究发现,CEP55在结直肠癌、食管、肾和卵巢癌等多种恶性肿瘤中呈高表达,高表达率的波动范围为40%~65%[5, 12, 15, 16]。本研究结果显示,CEP55在卵巢浆液性癌中的蛋白表达与正常输卵管伞端上皮组织比较显著增高,CEP55高表达率为60%,提示CEP55蛋白表达与卵巢浆液性癌的发生、发展有一定的相关性。进一步分析发现,CEP55的表达与组织学分级、FIGO分期和淋巴结转移有关,即CEP55在高级别浆液性癌中的高表达率显著高于低级别浆液性癌,CEP55表达率越高,患者的FIGO分期越晚且易发生淋巴结转移,这一结果与既往研究报道相一致,意味着CEP55高表达的卵巢浆液性癌患者的预后较差。
PLK1是一种保守的丝氨酸-苏氨酸蛋白激酶,由一个N端的激酶结构域和一个C端的Polo-box结构域组成[17]。PLK1作为有丝分裂的关键调节因子,通过调节CDK1/Cyclin B复合物的活性来驱动细胞从G2期过渡到M期,参与调控细胞周期。PLK1表达上调会破坏G2/M检查点,引起细胞进行异常分裂和增殖,导致肿瘤的发生[17]。近期研究表明,PLK1在卵巢癌和淋巴瘤等恶性肿瘤中表达增高[18, 19]。在卵巢癌研究中,PLK1的阳性率波动范围较大,为38.0%~80.8%,且PLK1过表达是卵巢癌预后不良的影响因素[6, 18]。本研究发现,在卵巢浆液性癌中,PLK1的阳性率为64%,相对于正常输卵管伞端上皮组织显著增高,这与相关文献报道相一致。PLK1的表达在低级别浆液性癌中的阳性率要低于高级别浆液性癌,这可能预示着PLK1阳性率越高的卵巢浆液性癌患者的恶性程度越高;但与FIGO分期和淋巴结转移无关,这可能与样本量较小有关,今后还需扩大样本量进行进一步研究。
在有丝分裂期间,PLK1是CEP55的正向调节因子,通过介导CEP55在残基S436上进行磷酸化,促进CEP55按照一定的时空顺序募集至中间体,维持细胞正常进行胞质分裂和脱落过程[10]。Bastos等[20]研究报道,PLK1 降解过快会使CEP55 过早募集至中间体,引起胞质分裂失败,导致非整倍体细胞形成和染色体不稳定,最终抑制细胞凋亡和促进细胞异常增殖。另外有研究发现PLK1、p53和CEP55存在着p53-PLK1-CEP55的反馈调节轴,PLK1作为p53的直接转录靶点,p53能结合PLK1启动子来抑制PLK1的转录活性,从而进一步抑制CEP55的蛋白表达,当TP53基因发生突变时,会使p53转录的抑制功能丧失,引起PLK1和CEP55蛋白表达上调,导致细胞周期异常进行,促使肿瘤细胞的增殖和生长[21]。本研究证实了CEP55和PLK1在卵巢浆液性癌中的表达呈正相关(r=0.408,P<0.05),笔者推测CEP55和PLK1在卵巢浆液性癌的进展中发挥协同作用。此外,免疫组化联合Western blot法共同检测出PLK1和CEP55在高级别浆液性癌中的蛋白表达水平高于低级别浆液性癌,这可能与高级别浆液性癌常发生TP53突变有关,具体分子机制有待于进一步研究。
近年来,PLK1抑制剂在许多肿瘤模型中取得了显著的抗肿瘤活性,主要通过诱导肿瘤细胞在G2/M期发生有丝分裂停滞,抑制肿瘤细胞增殖和促进细胞凋亡,从而改善患者的预后[22]。Raab等[23]研究表明,PLK1抑制剂Volasertib联合紫杉醇会导致卵巢癌细胞的有丝分裂停滞,抑制肿瘤细胞增殖和核内复制,诱导其发生死亡。目前,Volasertib已被用于急性髓性白血病患者的临床研究阶段,Zeidan等[24]将Volasertib联合地西他滨药物用于治疗23例复发性或难治性的急性髓性白血病患者的临床一期研究中,结果显示患者未出现明显不良反应。因此Volasertib有可能成为卵巢浆液性癌患者的靶向治疗药物。除此之外,有研究报道,CEP55过表达可以保护退出有丝分裂停滞的非整倍体细胞,避免肿瘤细胞死亡,导致抗有丝分裂药物产生耐药性[25]。然而,使用MEK1/2抑制剂来降低CEP55过表达对非整倍体细胞的保护作用后,可提高肿瘤细胞对抗有丝分裂PLK1抑制剂的敏感度,进而有效地促进肿瘤细胞死亡[26]。在本研究中,CEP55在卵巢浆液性癌组织中过表达,与影响预后的临床病理因素有关,因此,CEP55有望成为卵巢浆液性癌患者治疗靶点和预后标志物。
综上所述,PLK1和CEP55在低级别浆液性癌与正常输卵管伞端上皮组织中的表达比较,差异无统计学意义,但两者均有略增高的趋势,这可能与样本量较小有关,日后还会收集更多的临床数据来进一步分析。此外,从CEP55和PLK1的蛋白表达及两者的表达与卵巢浆液性癌患者的临床病理特征的相关性上来说,两者在卵巢浆液性癌的表达显著高于正常输卵管伞端上皮组织,并且两者的过表达与较差的生物学行为相关,这预示着卵巢浆液性癌患者的预后较差。因此,CEP55和PLK1可能协同参与卵巢浆液性癌的发生、发展,未来有望成为卵巢浆液性癌潜在的治疗靶点,但还需开展更多的基础实验和临床研究予以证实。
