仔猪腹泻病例的RT-PCR诊断
2022-02-08张婧旭梁海英曾智勇汤德元徐松平黄二素
张婧旭 , 梁海英 , 曾智勇 , 汤德元 , 王 彬 , 万 娟 , 徐松平 , 黄二素 , 徐 玉 , 祝 羊
(贵州大学动物科学学院 , 贵州 贵阳 550025)
2020年10月初,贵州省安顺市某猪场7日龄仔猪发生严重腹泻,病程初期猪只发生腹泻、食欲废绝、精神不济、不愿走动,后期由于抗生素治疗无效,猪只持续性腹泻导致大量脱水死亡。为明确引起腹泻的具体病原,对送检腹泻病死仔猪的肠内容物分别进行了猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)、猪轮状病毒(Porcine rotavirus,PoRV)、猪传染性胃肠炎病毒(Transmissible gastroenteritis virus,TGEV)和猪丁型冠状病毒(Porcine delta coronavirus,PDCoV)的反转录聚合酶链反应(Reverse transcription-polymerase chain reaction,RT-PCR)诊断,现将诊断过程和结果报告如下。
1 材料与方法
1.1 待检样品 贵州省安顺市某猪场送检的7日龄腹泻病死仔猪的肠内容物。
1.2 主要试剂 MiniBEST Viral RNA/DNA Extraction Kit Ver.5.0、Prime ScriptTMOne Step RT-PCR Kit Ver.2.0、pMD19T vector、DL2 000 Marker,均购自宝生物工程(大连)有限公司;胶回收试剂盒,购自OMEGA生物有限公司。
1.3 4种病毒的RT-PCR检测 将腹泻病死仔猪的肠内容物于12 000 r/min离心5 min,取上清。按照MiniBEST Viral RNA/DNA Extraction Kit Ver.5.0试剂盒说明书的操作步骤提取核酸。参照参考文献[1-2]设计并合成PEDV、PoRV、TGEV和PDCoV的RT-PCR引物,应用Prime ScriptTMOne Step RT-PCR Kit Ver.2.0试剂盒,进行RT-PCR检测。反应体系(25.0 μL):2×1 Step Buffer 12.5 μL,Prime Script 1 Step Enzyme Mix 1.0 μL,模板3.0 μL,上、下游引物各1.0 μL,RNase Free ddH2O补充至25.0 μL。反应程序:50 ℃反转录40 min;94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,共38个循环;72 ℃延伸10 min。反应结束后,取5 μL RT-PCR产物进行1.0%琼脂糖凝胶电泳检测。
1.4 PoRVVP7基因扩增及序列分析
1.4.1 PoRVVP7基因的RT-PCR扩增 参考GenBank数据库中PoRVVP7基因序列,在两端保守区域设计1对通用引物,上游引物:5′-GGCTTTAAAAGMGAGAATTTCC-3′;下游引物:5′-GGTCACATCAWACARYTCTAMY-3′。由生工生物工程(上海)股份有限公司合成。预计扩增基因片段大小为1 062 bp。以提取的RNA为模板进行反转录,首先置于95 ℃温浴5 min,快速置于冰上5 min解开双链,加入引物,用Prime Script 1 Step Enzyme Mix进行反转录,反应体系同1.3。反应程序:50 ℃反转录40 min;94 ℃预变性5 min;94 ℃变性30 s,51 ℃退火30 s,72 ℃延伸1 min,共40个循环;72 ℃延伸10 min。反应结束后,取5 μL RT-PCR产物进行1.0%琼脂糖凝胶电泳检测。
1.4.2 PoRVVP7基因的序列分析 将上述RT-PCR产物回收纯化,送至生工生物工程(上海)股份有限公司测序。将测序获得的序列进行BLAST比对,并应用MegAlign软件,将GenBank上公布的VP7基因的G3、G4、G5、G6、G8、G9、G10血清型序列与该序列进行亲缘性分析,构建VP7基因序列的遗传进化树。
2 结果
2.1 4种病毒的RT-PCR检测 电泳结果显示,TGEV(531 bp)、PEDV(663 bp)、PDCoV(357 bp)呈阴性,未扩增出条带,PoRV(341 bp)呈阳性,扩增出与预期大小相符的目的条带,见图1。
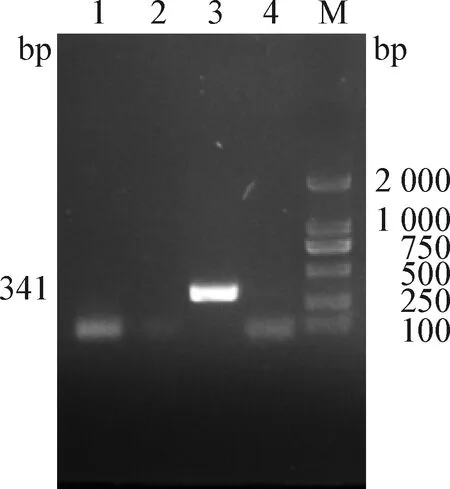
图1 样品的RT-PCR检测Fig.1 RT-PCR test of samplesM:DL2 000 DNA Marker; 1:TGEV; 2:PEDV; 3:PoRV; 4:PDCoV
2.2 PoRVVP7基因的扩增及序列分析 PoRVVP7基因的RT-PCR产物经1.0%琼脂糖凝胶电泳分析,可看到约1 062 bp的特异性条带,与预期的目的条带大小相符(图2)。测序所得序列[GZAS(2020)]与G5血清型处于同一分支,同源性最近,与其他血清型处于不同分支,同缘性较远(图3)。
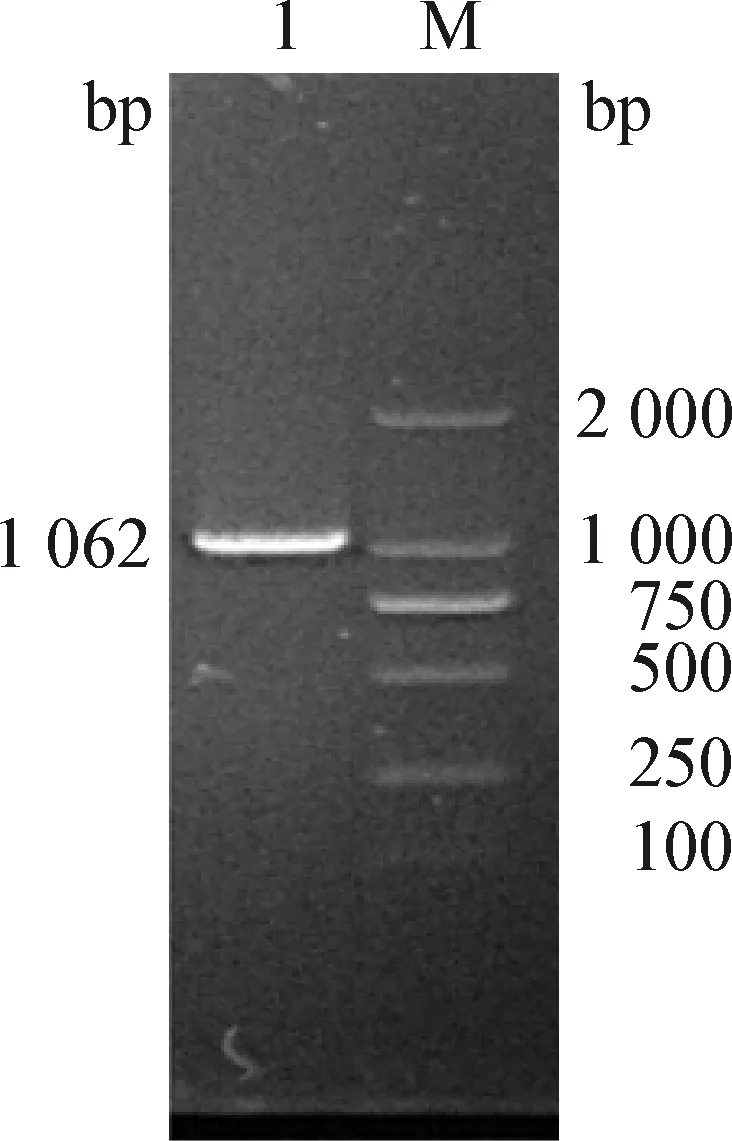
图2 PoRV VP7基因的RT-PCR扩增Fig.2 RT-PCR amplification of PoRV VP7 geneM:DL2 000 DNA Marker; 1:PoRV VP7基因M:DL2 000 DNA Marker; 1:PoRV VP7 gene
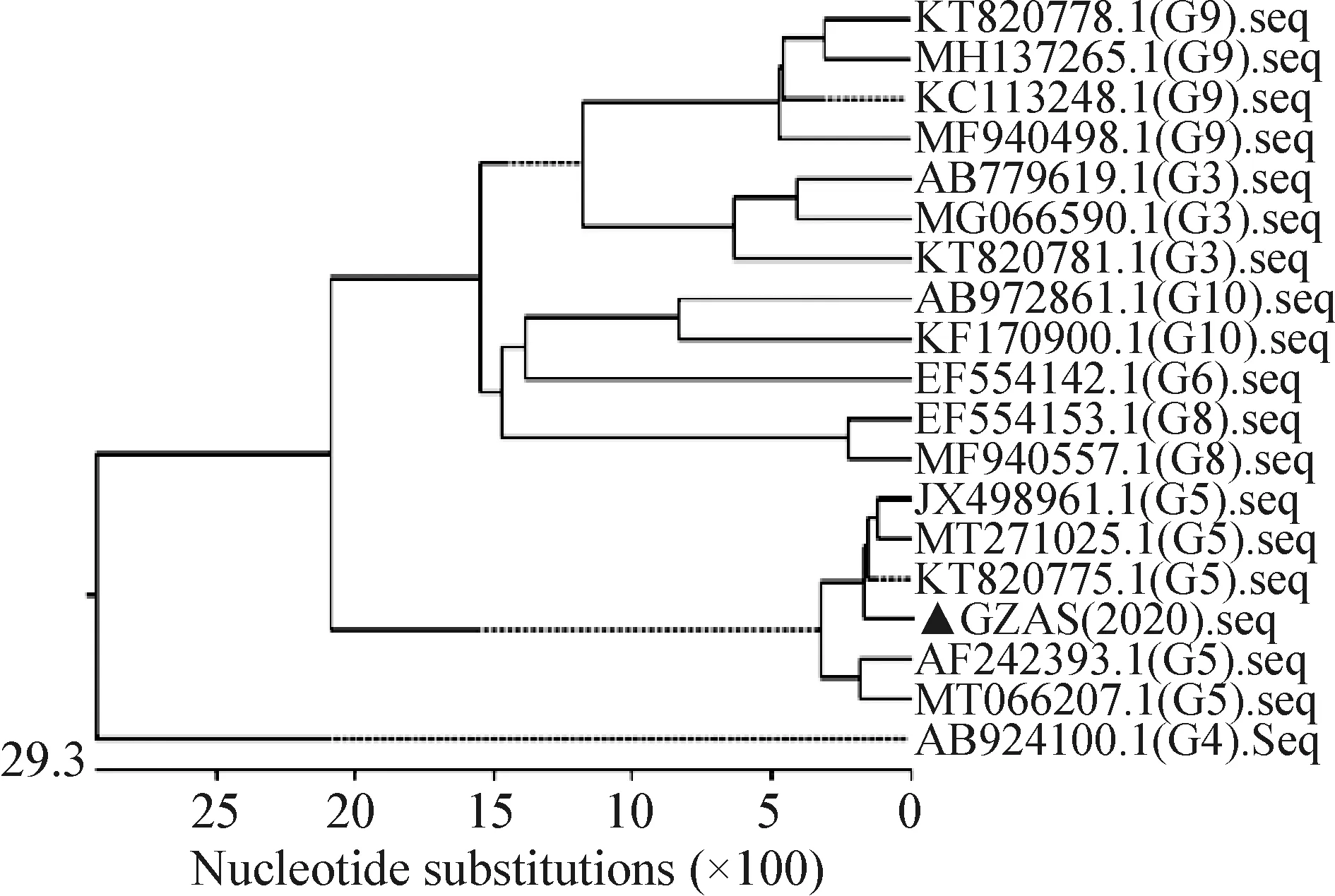
图3 PoRV VP7基因的遗传进化树Fig.3 Evolutionary tree of PoRV VP7 gene▲:本试验所得分离株▲:Strain obtained in this study
3 讨论
本试验通过对腹泻病死仔猪肠道内容物进行TGEV、PEDV、PDCoV、PoRV的RT-PCR检测,排除了TGEV、PEDV、PDCoV三个常见致腹泻病毒的感染。腹泻病死仔猪肠内容物含有PoRV,说明该猪场存在PoRV感染的情况。随后设计引物对VP7基因进行序列的扩增及测序,构建GZAS(2020)的遗传进化树,确定GZAS(2020)VP7全基因的具体血清型。序列分析结果显示,GZAS(2020)VP7全基因属于PoRV A群G5血清型。对于该病尚无有效的治疗药物,故本病以预防为主,要做好猪只的日常饲养管理工作,分不同饲养批次消毒处理,全进全出,注意防寒保暖,增强动物的抵抗力。新生仔猪尽早吮食初乳,以获得母源抗体的保护,当仔猪发生腹泻后应立即停止哺乳。在实际治疗过程中,由于该病的临床症状主要为腹泻,故在病程严重时会因脱水发生酸碱平衡紊乱而造成猪只死亡,饮用葡萄糖生理盐水和碳酸氢钠溶液有防止脱水和酸中毒的作用,对延缓病情起到较好的效果,同时高能量的日粮和限期饲喂可降低猪只的发病率和死亡率[3-4]。
1974年,英国Woode等首次从猪体分离出PoRV[5],随后感染PoRV导致仔猪腹泻死亡的病例在北爱尔兰、澳大利亚、法国、美国等国家陆续报道,PoRV的广泛传播逐渐引起了世界各国的重视[6]。PoRV主要感染幼龄仔猪,患病猪和带毒猪是主要传染源,经消化道感染,传播迅速,流行面广。饲喂非全价饲料,应激,在寒冷、潮湿、卫生不良的饲养环境下,继发或并发其他疾病等都可加重病情[7]。仔猪患腹泻病的情况在猪场非常普遍且发病情况日益严重,猪流行性腹泻(Porcine epidemic diarrhea,PED)、猪传染性胃肠炎(Transmissible gastroenteritis,TEG)、猪轮状病毒病(Porcine rotavirus disease,RV)、猪丁型冠状病毒病(Porcine delta coronavirus disease,PDCo)是严重困扰养猪场的病毒性传染病,发病时的临床症状极为相似,难以鉴别,一旦猪群发病会导致大范围的迅速传播,同时病毒难以净化,为了加强这4种腹泻疾病的防控,避免造成巨大的经济损失,通常养殖场发生腹泻类疾病时会要求同时检测这几种病毒,以便及时采取有效的防控治疗措施[8-9]。动物源的轮状病毒是人新型轮状病毒的潜在来源,具有非常重要的公共卫生学意义[10]。
