基于热红外成像的温室番茄植株水分评估方法
2022-02-07张舜凯杨慧杜太生
张舜凯,杨慧,杜太生
基于热红外成像的温室番茄植株水分评估方法
张舜凯,杨慧,杜太生※
(1. 中国农业大学中国农业水问题研究中心,北京 100083;2. 甘肃武威绿洲农业高效用水国家野外科学观测研究站,武威 733000)
为在诸多热红外指标中筛选出可靠的作物水分评估指标并探明其最优获取方法与最佳监测时段,该研究以西北旱区主要经济作物番茄为试验材料,设置2个灌水量水平(充分灌溉和1/2亏缺灌溉),通过对比三种干湿参考平面的选取方法(干湿红织物、干湿绿织物、人工喷涂介质),量化了包括作物水分胁迫指数(Crop Water Stress Index,CWSI)、相对气孔导度指数G、叶片温度leaf、叶气温差leaf-air在内的4个常用热红外指标与植株生理指标(气孔导度s、光合速率n、叶水势leaf)间的响应关系,并明确了利用热红外成像技术进行番茄植株水分评估的最佳测定时段。结果表明,以干湿红织物作为参考平面测得的CWSI与s、n、leaf间决定系数2分别达0.687、0.698、0.669,G与s、n、leaf间决定系数2分别达0.707、0.661、0.663,在三种方法中均最为显著。在12:00—14:00时段热红外指标CWSI与植株生理指标s、n、leaf相关性和G与植株生理指标s、n、leaf相关性均为最高,是利用热红外成像技术进行番茄植株水分监测的最佳时段,根据获得的相关函数可实时预测叶片缺水指标,依此判定植株水分状况并作为制定灌溉制度的依据。
作物;水分;胁迫指数;热红外成像;相对气孔导度指数;番茄
0 引 言
植株水分状况可直接影响其生长状态并可用于预测水分生产力水平,精准测量植株水分状况对于分析植株生长趋势及其对不同非生物胁迫响应过程模拟具有重要意义[1]。在特定时段测量植株茎叶水势是最常见的植株水分状态监测方法[2],但受限于试验人员间的测量误差以及测量操作的复杂性,难以进行大规模测样;另一种评估植株水分状况的方法是通过测量水蒸气在气孔中的扩散程度,来实现监测单个叶片气体交换的目的,但该方法需要与叶片直接接触,通常会对叶片的正常生理生态功能产生较大干扰[3]。此外,这两种测量方法大多费时费力且受到样本数目的制约。因此,离体测量方法在很大程度上限制了植物水分状况研究的深度与效率。
近十年来,远程、快速连续监测植物气孔导度(s)与光合速率(n)由于具有非破坏性和可重复性的特点逐渐成为评估植物水分状况的热点问题[4-7]。其中,热成像技术作为一种无损监测手段已成为植物水分状况的一种重要判定方法[8-12]。该技术可有效应用于单株、群体甚至更大的区域尺度[13]。可在非破坏性的条件下基于叶片表面温度降低差值与蒸发失水速率呈正比的原理[14],通过将植物体发出的不可见红外能量转变为可见的热图像来提取作物生命需水信息从而监测植株水分状况[15-16],并获得连续、实时、完整、客观的数据。植株的蒸腾作用会对叶片能量平衡产生影响,具体体现在叶片温度的变化上。因此,热成像是一种估算和量化气孔导度(s)与蒸腾速率()的有效技术手段[12,17]。目前,热红外成像监测技术已在植物与环境交互作用研究中表现出巨大的应用潜力,同时对诸如气孔关闭等特殊现象可提供相应的田间管理决策依据。然而,环境的可变性(例如光强、温度、相对湿度、风速)会影响热成像测量的准确性。
在实际生产中,已开发建立了一系列易于计算的评估指数,通过测得的冠层温度来评估植株的水分状况,如作物水分胁迫指数(Crop Water Stress Index,CWSI)[18-19]与相对气孔导度指数(G)[20]。这些指数的估算均涉及最高和最低叶片温度的参考靶叶确定问题。因此,能否选定适宜的参考平面对水分供应充足与受到水分胁迫的植株表面温度进行估算,决定着模型预测的精度。Leinonen等[21]用凡士林涂抹叶片气孔面做干参考靶叶,获取图像前在叶片两面喷1~2次清水作为湿参考靶叶,测得的G与s间呈线性相关,决定系数2为0.20;Pou等[22]用一块5 cm×1 cm的黑色薄金属板作为干参考靶叶,选用一块尺寸相同的能从集水器中吸水的黑色棉芯作为湿参考靶叶,由于金属板和棉芯与葡萄叶片边界层条件间的巨大差异,对叶片能量表征的准确性产生较大影响,测得的CWSI与s间决定系数2为0.39;Maes等[23]用一块绿色纯棉布作为干参考靶叶,浸湿后作为湿参考靶叶,两测量日内根据靶叶温度计算所得的G与s间呈显著相关(2=0.53,<0.01;2=0.65,<0.01)。基于可操作性与研究尺度等原因,前人的研究多限于一种参考方法的实测应用或在不同试验中比较不同干湿参考面,对多种干湿参考面选取方法在同一试验环境下进行评价的研究较少;且不同参考平面材料模拟叶片热能与光学特性的能力各有差异,因此对于最佳参考平面材料的选取原则目前尚无定论。同时,植株温度不仅受气孔导度和蒸腾作用影响,还受到一系列环境变量的影响[24-25],Pou等[22]通过在西班牙西北部的葡萄灌溉试验得出热红外最佳观测时间为11:00和16:00的结论;而García-Tejero等[10]的研究结果表明,11:00和14:00时热红外指标与叶气交换参数间的相关性最强。因此,确定一天内进行热红外监测的最佳时段对于有效评估植株叶气交换水平同等重要。本文拟通过西北旱区温室番茄亏缺灌溉试验,阐明植株叶片热红外特征值对水分胁迫的响应机理,明确作物水分胁迫指数和气孔导度指数的最优估算方法及最佳获取时段,以期为作物缺水表型信息识别及高效灌溉调控提供理论依据。
1 材料与方法
1.1 试验概况
试验于2021年5—9月在甘肃武威绿洲农业高效用水国家野外科学观测研究站日光温室内进行,试验所用温室为非加热自然通风型温室。温室内设有小型气象站,对温室内部空气温度、相对湿度和太阳辐射等环境因子进行连续观测。温室内0~1 m深度的土壤为灌漠土,计划湿润层0~0.6 m内的土壤容重为1.48 g/cm3,田间持水率为0.31 cm3/cm3。供试番茄为当地主要栽培品种粉禧5号。番茄籽苗以穴盘育苗法培育至四片真叶期时移栽到日光温室内对应的各小区中。在定植当日和定植后(DAT)7与15 d对所有植株分别进行3次充分灌溉(即定植水和缓苗水),以保证幼苗成活。番茄植株于2021年5月14日定植至9月22日收获,每株保留5穗果,全生育期共131 d。从定植到第一穗花开为番茄营养生长期,第一穗花开至第一穗结果为番茄开花期,第一穗结果至成熟为果实膨大和成熟期。
试验设置2个水分处理,分别为充分灌溉(W1)和亏缺灌溉(W2),每个处理设3个重复,每个重复1个小区,共计6个小区。当W1处理的土壤计划湿润层深度内平均含水率为田间持水率(F,cm3/cm3)的(75±2)%时进行灌水,灌水上限为(90±2)%F。W2的灌水频率与W1保持一致,每次灌溉水量为W1的1/2。灌溉方式采用膜下滴灌,灌水量(,mm)按下式计算

式中为计划湿润比,取0.5;为计划湿润层深度,取60 cm;v为计划湿润层深度内实测的土壤体积含水率,cm3/cm3。
除灌水外的其他农艺管理措施如施肥、授粉、吊蔓等均与当地常规方式保持一致,各试验小区间不设差异。
1.2 测定项目与方法
1.2.1 土壤的物理与水力特性
采用环刀法(体积为100 cm3)测定土壤的干容重(γ,g/cm3)、孔隙率和田间持水率,测定深度依次为20、40、60、80和100 cm。使用ECH2O土壤含水率监测系统(Decagon Devices,Inc.,Pullman,WA,USA)测定0~60 cm深度土壤的体积含水率与温度。
1.2.2 气象数据
采用标准自动气象站HOBO U30(Onset Computer Crop,USA)连续监测日光温室内的空气温度(a,℃)、相对湿度(RH,%)、太阳辐射(s,W/m2)等气象因子。
1.2.3 热红外指标
植株叶片热红外图像:共选取9个全天晴朗无云的典型测量日,利用Fluke TiX650便携式红外热成像仪(Fluke IR Flex Cam TiX650,Fluke Crop.,USA)在每个观测日内8:00—18:00,以2 h为一时段,在距离叶片向阳侧0.5 m的位置进行拍摄。
植株冠层热红外图像:共选取3个典型灌水周期,自每次灌水处理第二天开始至下次灌水处理前一天,连续于每日正午,在距离冠层向阳侧1.5 m[2,22]的位置进行拍摄。
热红外相机分辨率为640×480(像素),热灵敏度为0.025 ℃,测温范围为-40~2 000 ℃,可在7.5~14m的波段范围内正常工作。植株叶片与冠层的发射率均设置为0.96[10,22],以每个像素作为有效温度读数。可见光数字图像(RGB)与热红外图像同时拍摄,并结合两组图像来分离植株与参考平面及裸露地表,用SmartView工具软件,通过面积选择和测量工具从图像中提取植株叶片温度leaf、冠层温度c及干湿参考平面温度,圈选过程中忽略叶片边缘上的混合像素。
作物水分胁迫指数(CWSI)根据Jones[18-19]定义的简化公式计算

相对气孔导度指数(G)根据Jones[20]提出的公式计算
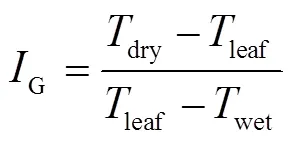
式中leaf为选定待测的番茄叶片温度,℃;dry为模拟气孔完全闭合的无蒸腾叶片温度,℃,分别选择干燥红织物、干燥绿织物以及人工向叶片涂抹凡士林的方式进行测量;wet为模拟气孔完全打开的充分蒸腾叶片温度,℃,分别选择湿润红织物、湿润绿织物以及人工向叶片喷水的方式进行测量。
1.2.4 植株生理指标
在完成热红外图像采集后,立即采用便携式光合测定系统LI-6400XT(LI-COR Corporation,Lincoln,NE,USA)测量对应时段下叶片的光合速率(n,mol/(m2·s))和气孔导度(s,mol/(m2·s)),利用植物压力室(Soil Moisture Equipment,Santa Barbara,CA,USA)测量各时段实时叶水势(leaf,MPa)。

图1 三种参考平面选取方法的RGB和其相应的热红外图像
1.2.5 数据处理
采用SPSS 20.0数据处理软件(SPSS Inc.,Chicago,IL,USA)对试验数据进行统计检验与分析,多重比较选用Tukey方法,采用Microsoft Office Excel 和Origin 2022进行图表绘制。
2 结果与分析
2.1 不同水分处理下土壤体积含水率及冠层温度
图2表示了3次典型灌水周期内不同水分处理下土壤体积含水率及番茄冠层温度的变化情况。如图所示,W1处理后的土壤体积含水率v1始终高于亏缺灌溉下的土壤体积含水率v2,两者间差异随灌水天数逐渐减小,在灌水周期末两者体积含水率间达到最小差值。在任一测量日内,亏缺灌溉下的番茄冠层温度c2均高于充分灌溉下的番茄冠层温度c1,两冠层间温度差值随土壤水分消耗逐渐减小,在灌水周期末无显著差异。
2.2 三种参考平面方法下热红外指标与植株生理指标响应关系
图3为三种参考平面选取方法下番茄植株叶片不同生理指标与相对气孔导度指数G间的响应关系,为探究各方法表征不同植株水分状况的能力,图中数据均采用同一参考方法下两个水分处理番茄热红外指标与叶片生理指标的均值(图4同)。如图3所示,G与叶片气孔导度s呈正相关关系,这与前人在葡萄植株[18]上的研究结果一致;不同水分处理下的G与叶水势leaf亦呈对数正相关关系。本研究中实测G值大于0.5的叶片,实时气孔导度s通常大于0.15 mol/(m2·s),光合速率n大于12mol/(m2·s),叶水势leaf通常高于-0.8 MPa。而G小于0.5时,对应更低的气孔导度与光合速率值,以及更低的实时叶水势值。
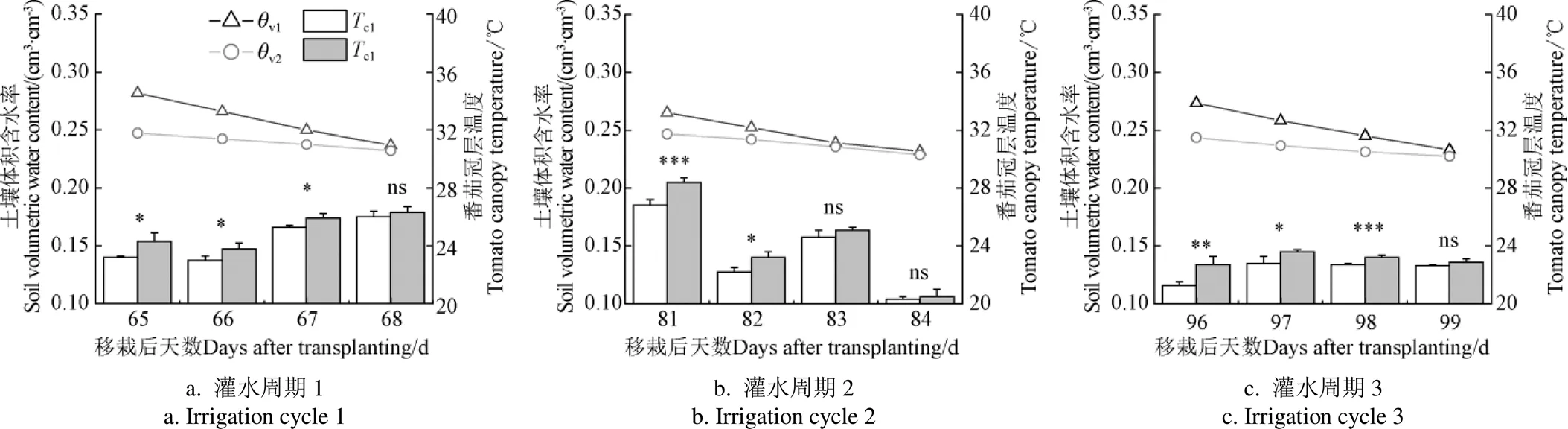
注:θv1、θv2分别为W1和W2处理下的土壤体积含水率,(cm3·cm-3);Tc1、Tc2分别为W1和W2处理下的番茄冠层温度,℃;W1为充分灌溉;W2为亏缺灌溉。*、**和***分别表示在P<0.05、P<0.01和P<0.001时两处理间有统计学意义的显著差异;ns表示差异不显著,下同。
在参考平面的选取方法上,采用干湿红织物为对照的方法计算的G与s的线性拟合2值最高,为0.707;其次为干湿绿织物对照法,2为0.652;人工喷涂方法下G与g的响应关系最差,2=0.631(图3a),在G与n和leaf间的响应关系中规律相同,均为红色织物效果最佳(图3b、3c)。同时,利用G衡量番茄植株生理指标的缺水响应情况时,G与s的相关关系要优于n,G与leaf的相关性最低。
作物水分胁迫指数CWSI与s间呈显著负相关关系,在CWSI与n以及leaf的响应关系中发现了同样的趋势。当CWSI≥0.7时,s、n、leaf的取值范围分别为0.02~0.1 mol/(m2·s)、2~10mol/(m2·s),-1.2~-0.8 MPa;当0.3≤CWSI≤0.6时,三者的取值范围分别在0.15~0.25 mol/(m2·s)、12.5~17.5mol/(m2·s),-0.6~-0.3 MPa(图 4)。
通过拟合三种参考平面选取方法下CWSI与植株生理指标间的响应关系,可以判断CWSI的最佳获取方式。如图4所示,采用干湿红织物为对照的方法计算的CWSI与g的拟合程度最优(2=0.687),采用干湿绿织物计算的CWSI与s的响应关系次之(2=0.631),采用人工喷涂介质计算的CWSI与g的决定系数2最低,为0.628(图4a)。这种规律同样体现在CWSI与n和leaf的响应关系中(图4b、4c),同样以干湿红织物作为参照效果最佳,决定系数2分别为0.698和0.669;人工喷涂介质的参照效果最差,2分别为0.643和0.609。在对CWSI与n间响应关系的研究中,三种方法下拟合所得的2值均大于0.6;同时,利用CWSI衡量番茄植株的需水状况时,n对CWSI的响应均优于s与leaf。

a. IG与gs响应关系a. Relationships between IG and gsb. IG与An响应关系b. Relationships between IG and Anc. IG与φleaf响应关系c. Relationships between IG and φleaf

a. CWSI与gs响应关系a. Relationships between CWSI and gsb. CWSI与An响应关系b. Relationships between CWSI and Anc. CWSI与φleaf响应关系c. Relationships between CWSI and φleaf
2.3 热红外指标与单叶气体交换参数间的关系
结合上文得到的最佳参考平面为红棉织物的结论,在研究不同热红外指标与叶片气体交换参数(s和n)间的响应关系时,均以红棉织物为参考平面来分别评估两个水分处理下的叶片生理指标。如表1所示,热红外指标CWSI和leaf与叶气交换参数之间呈负相关,而G和leaf-air与各生理指标呈正相关。两个水分处理下s、n均与环境温度归一化的热红外指标CWSI、IG呈极显著的相关关系(<0.01),CWSI与n、G与s的相关性更强。叶片红外温度leaf与气体交换参数间亦呈显著的相关性(<0.05),利用leaf预测s与n的效果大致相同,且不同处理间的相关性无显著差异。代表叶片与周围空气温度差值的leaf-air在与叶片生理指标的相关性评估中均未表现出显著差异。
2.4 利用热红外成像技术进行植株水分监测的最佳时段
为了进一步探究以干湿红织物为参考平面下不同时段热红外指标与番茄生理指标间的响应关系,分别对一天内不同时段测得的CWSI与n和leaf、G与s进行拟合分析(表2)。结果表明,一天内不同时段的CWSI、G均与植株生理指标n、leaf和s呈极显著相关,12:00 —14:00时段测得的CWSI与n间2值为0.761,、G与s间2值为0.755,CWSI与leaf间2值为0.686,均在此时段为最高。其次为10:00-12:00时段。

表1 四个热红外指标与叶片气体交换参数间的皮尔逊相关系数
注:表中参与相关性分析的数据为全天五个时段内测得的两个水分处理下不同热红外指标与叶片气体交换参数的观测值。
Note: The data involved in the correlation analysis in the table are the values of thermal indicators and leaf gas exchage parameters under two water treatments measured at five time periods.
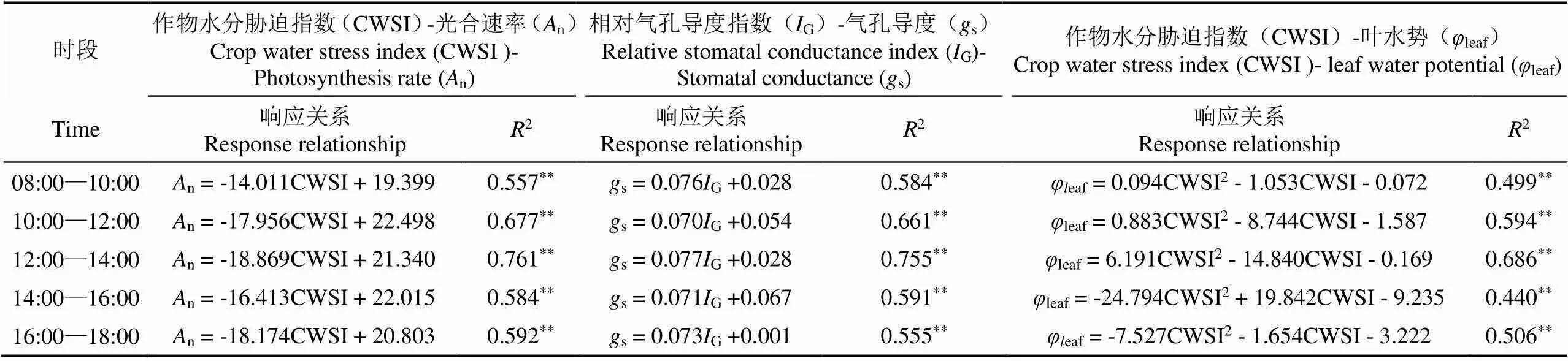
表2 不同时段内热红外指标与植株生理指标间的响应关系
注:表中数据均为不同时段下测得的两个水分处理下热红外指标与相应植株生理指标的均值。
Note: The data in this table are the pooled values of thermal indicators and plant physiological indicators under two water treatments measured at different time periods.
3 讨 论
通过遥感技术监测作物生长及水分状况可为灌溉制度的拟定及田间水分管理提供实时可靠的依据。前人研究表明,热红外成像技术可用于定量评估田间玉米[26-27]、水稻[28]、棉花[29]、葡萄[4]、杏树[30]、核桃[31]等作物与树木的水分状况。已有的部分研究着眼于红外图像的提取与分析优化,这为基于热红外成像技术进行植株水分状况诊断提供了可靠的技术支撑[32-33]。本文通过对比两个水分处理间温室番茄冠层温度c进一步证实,水分胁迫程度较高的番茄植株具有较高的冠层温度值,未受或受到轻度水分胁迫的植株表现出较低的冠层温度值,其根本原因是水分胁迫下的叶片会通过减小气孔开度来限制蒸腾作用,以减少水分的过多散失,从而导致冠层温度的升高[34-35]。然而,热红外指标不能单独作为植株水分亏缺的评估因素,必须将其实测值与植株的生理指标相关联,目的是为了减少单一温度估计产生的误差,提高利用热红外成像技术判断作物水分胁迫程度的可靠性。本文对比了三组不同参考平面选取方法,主要目的是甄别不同参考平面材料及其颜色对番茄植株水分监测结果的影响。结果表明,干湿红织物为对照的方法在一系列热红外指标中表现最为稳定,根据其计算的CWSI和G与番茄叶片生理指标间的响应关系均优于干湿绿织物和人工喷涂介质方式(图3、图4)。相较于干湿织物的参考方式,人工喷涂介质的方法难以保持操作的稳定性,且手动润湿后的叶片温度存在较短的稳定期[24],红外测温仅应在特定的时间内进行,否则容易造成wet的估算误差,在风速更高、干燥更快的野外种植条件下存在更大的局限性;通过人工涂抹凡士林来主动闭合叶片气孔的方式也会对番茄叶片生理与光学特性产生永久性影响,无法进行可持续生产。通过对比同种材料下不同颜色织物对评估结果产生的影响,发现以红色织物为参考平面进行植株水分监测的效果均优于绿色织物,这与两颜色织物对环境影响的不同反应有密切关系,绿色织物更易受到日光温室内太阳直射光及周围高温物体反射光的影响[36],且本研究中采用的暗红色织物材料较亮绿色材料具有更高的发射率,而发射率高的物体其表面温度更接近其真实温度,发射率低的物体表面温度与环境温度更接近,因此绿色织物易造成wet和dry的估计偏差,由此对评估结果产生影响。同时红色织物在热红外图像的处理过程中更易于区分,不会在图像提取过程中造成像素块的错误圈选,由此提升了测量的精度与准确性。
热红外指标CWSI、G与番茄植株生理指标n和s间表现出最高的线性回归系数,未经环境归一化处理的热红外指标leaf也与两生理指标间具备一定的相关性,但叶气温差leaf-air与两个水分处理下的番茄植株生理指标间均未表现出显著的相关性(表1),主要原因可能是由于部分测量目标叶片与温室内气象站间存在一定距离,由此对leaf-air测量的稳定性产生影响。与leaf相比,CWSI和G均需依据与目标叶片处在同一区域的参考表面温度(wet和dry)计算得出,是考虑环境因素的归一化指标,很大程度地避免了单一叶片温度受温室气象变化的影响,这也是leaf与s、n间的相关性较CWSI、G低的主要原因。尽管如此,参考平面温度的使用也存在一定的限制,可能会制约CWSI和G在植株水分评估上的表现,尤其是在种植环境复杂多变以及太阳辐射角不固定的情况下[37]。潮湿环境会减少水分的蒸发冷却,由此降低wet与dry间的差异[20];大风条件可能会改变冠层能量平衡并导致叶片气孔关闭[38]。
因此,在多变的气象条件下对缺水植株进行及时地识别,需要确定最可靠的热红外指标以及一天内进行热红外成像测量的最佳时段。本研究表明,利用热红外成像技术判定番茄植株水分状况的最佳时段为12:00-14:00,在这一时段内测得的热红外指标与植株生理指标间相关性最高(表2)。这也是一天内不同水分处理下番茄植株叶片温度leaf、热红外指标和叶片生理特性间差异最显著的时段。正是在这一时段内环境温度与植株水分蒸发强度达到最大值,由此导致叶片气孔开度以及叶片温度间的显著差异[10,22]。此外,在任一测量日内,W2处理下的冠层温度均高于W1处理,土壤水分的亏缺导致了不同水分处理下冠层温度c的差异,这也是热红外指标可以表征植株水分状态的根本原因。根据CWSI和G预测番茄植株叶气交换指标的线性函数证实了热红外成像技术在番茄植株水分状况判定上的应用潜力。本研究主要聚焦于利用热红外手段监测番茄植株水分状况的方法探究上,未来还需对亏水识别后热红外指标向灌水制度的转化进行深入研究与探讨,以便更好地服务于作物水管理。
4 结 论
1)以干湿红织物作为参考平面测得的作物水分胁迫指数、相对气孔导度指数与叶片生理指标间关系在三种方法中最为显著。作物水分胁迫指数与气孔导度、光合速率、叶水势间决定系数分别达0.687、0.698、0.669;相对气孔导度指数与气孔导度、光合速率、叶水势间决定系数分别达0.707、0.661、0.663,可作为热红外指标获取的最优方法。
2)作物水分胁迫指数、相对气孔导度指数与气孔导度、光合速率间均呈极显著相关关系(< 0.01),叶片温度与气孔导度、光合速率呈显著相关关系(< 0.05),叶气温差与气孔导度、光合速率无显著相关关系。作物水分胁迫指数和相对气孔导度指数可用于预测植株叶气交换水平,作为衡量番茄植株是否缺水的代表性热红外指标。
3)利用热红外成像技术获取具备生理学意义的热红外数据以评估番茄植株水分状况的最佳推荐时段为12:00 —14:00,此时作物水分胁迫指数与光合速率、叶水势间的决定系数分别为0.761、0.755,相对气孔导度指数与气孔导度间的决定系数为0.686,能更好地反映番茄作物水分胁迫状况。
[1] 山仑,邓西平,康绍忠. 我国半干旱地区农业用水现状及发展方向[J]. 水利学报,2002,33(9):27-31.
Shan Lun, Deng Xiping, Kang Shaozhong. Current situation and perspective of agricultural water used in semiarid area of China[J]. Journal of Hydraulic Engineering, 2002, 33(9): 27-31. (in Chinese with English abstract)
[2] Jones H G. Irrigation scheduling: Advantages and pitfalls of plant-based methods[J]. Journal of Experimental Botany, 2004, 55(407): 2427-2436.
[3] Costa J M, Grant O M, Chaves M M. Thermography to explore plant–environment interactions[J]. Journal of Experimental Botany, 2013, 64(13): 3937-3949.
[4] Petrie P R, Wang Y, Liu S, et al. The accuracy and utility of a low cost thermal camera and smartphone-based system to assess grapevine water status[J]. Biosystems Engineering, 2019, 179: 126-139.
[5] Briglia N, Montanaro G, Petrozza A, et al. Drought phenotyping inusing RGB and NIR imaging[J]. Scientia Horticulturae, 2019, 256: 108555.
[6] 毋海梅,闫浩芳,张川,等. 温室滴灌黄瓜产量和水分利用效率对水分胁迫的响应[J]. 农业工程学报,2020,36(9):84-93.
Wu Haimei, Yan Haofang, Zhang Chuan, et al. Responses of yield and water use efficiency of drip-irrigated cucumber in greenhouse to water stress[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2020, 36(9): 84-93. (in Chinese with English abstract)
[7] 王卫星,杨明欣,高鹏,等. 基于多光谱和气象参数的菜心水分胁迫指数反演[J]. 农业工程学报,2022,38(6):157-164.
Wang Weixing, Yang Mingxin, Gao Peng, et al. Inverting the water stress index of the Brassica chinensis using multiple-spectral and meteorological parameters[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2022, 38(6): 157-164. (in Chinese with English abstract)
[8] Akpolat H, Barineau M, Jackson K A, et al. Portable infrared sensing technology for phenotyping chemical traits in fresh market tomatoes[J]. LWT - Food Science and Technology, 2020, 124: 109164.
[9] Ludovisi R, Tauro F, Salvati R, et al. UAV-Based Thermal imaging for high-throughput field phenotyping of black poplar response to drought[J]. Frontiers in Plant Science, 2017, 8: 1681.
[10] García-Tejero I F, Costa J M, Egipto R, et al. Thermal data to monitor crop-water status in irrigated Mediterranean viticulture[J]. Agricultural Water Management, 2016, 176: 80-90.
[11] 刘又夫,周志艳,田麓弘,等. 红外热成像技术在农业中的应用[J]. 农业工程,2019,9(11):102-110.
Liu Youfu, Zhou Zhiyan, Tian Luhong, et al. Application of infrared thermal imaging technology in agriculture[J]. Agriculture Engineering, 2019, 9(11): 102-110. (in Chinese with English abstract)
[12] 韩文霆,张立元,牛亚晓,等. 无人机遥感技术在精量灌溉中应用的研究进展[J]. 农业机械学报,2020,51(2):1-14.
Han Wenting, Zhang Liyuan, Niu Yaxiao, et al. Review on UAV remote sensing application in precision irrigation[J]. Transactions of the Chinese Society for Agricultural Machinery, 2020, 51(2): 1-14. (in Chinese with English abstract)
[13] Jones H G, Vaughan R A. Remote Sensing of Vegetation: Principles, Techniques and Applications[M]. Oxford, UK: Oxford University Press, 2010.
[14] Brown H T, Escombe F. Researches on some of the physiological processes of green leaves, with special reference to the interchange of energy between the leaf and its surroundings[J]. Proceedings of the Royal Society of London Series B-Containing Papers of a Biological Character, 1905, 76(507): 29-111.
[15] Yousfi S, Kellas N, Saidi L, et al. Comparative performance of remote sensing methods in assessing wheat performance under Mediterranean conditions[J]. Agricultural Water Management, 2016, 164: 137-147.
[16] Tattaris M, Reynolds M P, Chapman S C. A direct comparison of remote sensing approaches for High-Throughput phenotyping in plant breeding[J]. Frontiers in Plant Science, 2016, 7: 1131.
[17] Virnodkar S S, Pachghare V K, Patil V C, et al. Remote sensing and machine learning for crop water stress determination in various crops: A critical review[J]. Precision Agriculture, 2020, 21(5): 1121-1155.
[18] Jones H G. Use of infrared thermometry for estimation of stomatal conductance as a possible aid to irrigation scheduling[J]. Agricultural and Forest Meteorology, 1999, 95(3): 139-149.
[19] Jones H G. Use of thermography for quantitative studies of spatial and temporal variation of stomatal conductance over leaf surfaces[J]. Plant Cell and Environment, 1999, 22(9): 1043-1055.
[20] Jones H G, Stoll M, Santos T, et al. Use of infrared thermography for monitoring stomatal closure in the field: Application to grapevine[J]. Journal of Experimental Botany, 2002, 53(378): 2249-2260.
[21] Leinonen I, Jones H G. Combining thermal and visible imagery for estimating canopy temperature and identifying plant stress[J]. Journal of Experimental Botany, 2004, 55(401): 1423-1431.
[22] Pou A, Diago M P, Medrano H, et al. Validation of thermal indices for water status identification in grapevine[J]. Agricultural Water Management, 2014, 134: 60-72.
[23] Maes W H, Baert A, Huete A R, et al. A new wet reference target method for continuous infrared thermography of vegetations[J]. Agricultural and Forest Meteorology, 2016, 226/227: 119-131.
[24] Maes W H, Steppe K. Estimating evapotranspiration and drought stress with ground-based thermal remote sensing in agriculture: a review[J]. Journal of Experimental Botany, 2012, 63(13): 4671-4712.
[25] Alchanatis V, Cohen Y, Cohen S, et al. Evaluation of different approaches for estimating and mapping crop water status in cotton with thermal imaging[J]. Precision Agriculture, 2010, 11(1): 27-41.
[26] 张智韬,于广多,吴天奎,等. 基于无人机遥感影像的玉米冠层温度提取及作物水分胁迫监测[J]. 农业工程学报,2021,37(23):82-89.
Zhang Zhitao, Yu Guangduo, Wu Tiankui, et al. Temperature extraction of maize canopy and crop water stress monitoring based on UAV remote sensing images[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2021, 37(23): 82-89. (in Chinese with English abstract)
[27] 杨文攀,李长春,杨浩,等. 基于无人机热红外与数码影像的玉米冠层温度监测[J]. 农业工程学报,2018,34(17):68-75.
Yang Wenpan, Li Changchun, Yang Hao, et al. Monitoring of canopy temperature of maize based on UAV thermal infrared imagery and digital imagery[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2018, 34(17): 68-75. (in Chinese with English abstract)
[28] Krishna G, Sahoo R N, Singh P, et al. Application of thermal imaging and hyperspectral remote sensing for crop water deficit stress monitoring[J]. Geocarto International, 2021, 36(5): 481-498.
[29] 张智韬,边江,韩文霆,等. 无人机热红外图像计算冠层温度特征数诊断棉花水分胁迫[J]. 农业工程学报,2018,34(15):77-84.
Zhang Zhitao, Bian Jiang, Han Wenting, et al. Cotton moisture stress diagnosis based on canopy temperature characteristics calculated from UAV thermal infrared image[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2018, 34(15): 77-84. (in Chinese with English abstract)
[30] García-Tejero I F, Ortega-Arévalo C J, Iglesias-Contreras M, et al. Assessing the crop-water status in almond (Mill. ) trees via thermal imaging camera connected to smartphone[J]. Sensors, 2018, 18(4): 1050.
[31] 孙圣,张劲松,孟平,等. 基于无人机热红外图像的核桃园土壤水分预测模型建立与应用[J]. 农业工程学报,2018,34(16):89-95.
Sun Sheng, Zhang Jinsong, Meng Ping, et al. Establishment and application of prediction model of soil water in walnut orchard based on unmanned aerial vehicle thermal infrared imagery[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2018, 34(16): 89-95. (in Chinese with English abstract)
[32] Parihar G, Saha S, Giri L I. Application of infrared thermography for irrigation scheduling of horticulture plants[J]. Smart Agricultural Technology, 2021, 1: 100021.
[33] Salgadoe A S A, Robson A J, Lamb D W, et al. A non-reference temperature histogram method for determining Tc from Ground-Based thermal imagery of orchard tree canopies[J]. Remote Sensing, 2019, 11(6): 714.
[34] Gates D M. Transpiration and leaf temperature[J]. Annual Review of Plant Physiology, 1968, 19(1): 211-238.
[35] Mukherjee S, Nandi R, Kundu A, et al. Soil water stress and physiological responses of chickpeaL.subject to tillage and irrigation management in lower Gangetic plain[J]. Agricultural Water Management, 2022, 263: 1-17.
[36] 李云红. 基于红外热像仪的温度测量技术及其应用研究[D]. 哈尔滨:哈尔滨工业大学,2010.
Li Yunhong. Research on Temperature Measurement Technology and Application Based on Infrared Thermal Imager[D]. Harbin: Harbin Institute of Technology, 2010. (in Chinese with English abstract)
[37] Jones H G, Grant O M. Remote Sensing and Other Imaging Technologies to Monitor Grapevine Performance[M]. Hoboken, NJ: Wiley-Blackwell, 2016.
[38] Campbell-Clause, J M. Stomatal response of grapevines to wind[J]. Australian Journal of Experimental Agriculture, 1998, 38(1), 77-82.
Evaluating the water status of greenhouse tomatoes using thermal infrared imaging
Zhang Shunkai, Yang Hui, Du Taisheng※
(1.100083; 2.733000)
Infrared thermography is a promising technology for crop water status assessment. Effective information can be acquired for the timely formulation of regulated deficit irrigation strategies. However, it is very necessary to optimize the assessment under field conditions, especially under variable environmental conditions (daily and seasonal). Besides, simplicity and robustness are the basis of thermography applicability in the field. In this study, the optimal thermal indicator and the best acquisition were proposed for the monitoring daily period using thermal infrared imaging. The trial was carried out in the solar greenhouse of the National field scientific observation and research station on efficient water use of oasis agriculture in Wuwei from May to September 2021. The tomato plants (Fenxi 5) were selected as the research object. Two irrigation treatments were set: W1-full irrigation (control); W2-deficit irrigation (50% of the control). Firstly, three groups of dry and wet reference planes were selected to calculate the thermal indicators, including the red fabric, green fabric, and artificial spray medium. Subsequently, the performance was evaluated on the four common thermal indicators (Crop Water Stress Index (CWSI), Relative Stomatal Conductance Index (G), leaf temperature (leaf),and the difference betweenleafand surrounding air (leaf-air)) in the plant water status diagnosis. Finally, the optimal daily period of thermal imagery acquisition was determined for the tomato plants. The results showed that there were significant correlations of the normalized indices (CWSI andG) with the plant physiological indicators, such as stomatal conductance (s), photosynthetic rate (n), and leaf water potential. The leaf temperatureleafwas also used in a stable planting environment to determine whether the plant was dehydrated or not. There were no significant correlations between theleaf-airand the physiological indicators of tomato plants under two water treatments. The correlations between the CWSI andGobtained by the red fabric as the reference plane with thes,n,and leaf water potential were the most significant among the three groups of reference planes, where the determination coefficients were 0.687, 0.698, 0.669 and 0.707, 0.661, 0.663 respectively. By contrast, the thermal indicators obtained by the green fabric as the reference plane showed a weaker correlation with thes,n,and leaf water potential, where the determination coefficients were 0.631, 0.655, 0.615, and 0.652, 0.634, 0.638 respectively. The CWSI andGobtained by the spraying medium artificially were achieved in the lowest determination coefficients with the leaf physiological indicators, which were 0.628, 0.643, 0.609, 0.631, 0.624, and 0.586, respectively. Among the three groups of reference plane acquisition,wetanddryobtained by the red fabric were least affected by the reflection of ambient light. There was no permanent damage to the physiological characteristics of tomato leaves, thereby much easier to distinguish and extract from the thermal imagery. Therefore, the red fabric achieved a great performance to select the reference plane. In addition, the CWSI andGwere most significantly correlated withs,nand leaf water potential during 12:00-14:00 under both irrigation treatments. Different mathematical functions were obtained to estimate the leaf gas exchange using the best-performing thermal indicators. Therefore, the water status of the plant was effectively determined using thermal infrared imaging.
crops; water content; stress index; infrared thermography; relative stomatal conductance index; tomato
10.11975/j.issn.1002-6819.2022.18.025
S274.1
A
1002-6819(2022)-18-0229-08
张舜凯,杨慧,杜太生. 基于热红外成像的温室番茄植株水分评估方法[J]. 农业工程学报,2022,38(18):229-236.doi:10.11975/j.issn.1002-6819.2022.18.025 http://www.tcsae.org
Zhang Shunkai, Yang Hui, Du Taisheng. Evaluating the water status of greenhouse tomatoes using thermal infrared imaging[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2022, 38(18): 229-236. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2022.18.025 http://www.tcsae.org
2022-07-01
2022-08-12
国家自然科学基金项目(51725904);中央高校基本科研业务费专项资金项目(2021TC107)
张舜凯,研究方向为节水灌溉理论与新技术。Email:zhangshunkai@cau.edu.cn
杜太生,教授,研究方向为农业节水与水资源高效利用。Email:dutaisheng@cau.edu.cn
