基于FeOOH 修饰的丝网印刷电极传感器同时检测Pb(II)和Cu(II)*
2022-02-04林温程王心怡胡燕婕孙先佑王天星
林温程,王心怡,胡燕婕,孙先佑,万 浩,王天星,王 平*
(1.浙江大学生物传感器国家专业实验室,生物医学工程教育部重点实验室,生仪学院,浙江 杭州 310027;2.浙江大学附属邵逸夫医院,浙江 杭州 310016;3.浙江亿联康医疗科技有限公司,浙江 杭州 310011)
重金属会对人体造成多种危害[1]。例如,铅(Pb)是一种有毒的重金属,能与蛋白质上的巯基紧密结合,会严重破坏人的神经系统和血液系统,尤其对儿童和胎儿的影响极大[2];铜(Cu)虽然是人体必需元素,但过量的铜元素也会对人体产生损害,造成细胞膜中脂质过氧化增加以及DNA 损伤[3]。重金属污染造成的生态和公共卫生问题越来越受到人们的关注,因此,需要一种检测重金属离子的方法。目前使用的原子吸收光谱[4]、原子荧光光谱[5]、电感耦合等离子体质谱[6]等实验室分析手段往往昂贵、笨重、耗时、不易操作,相比之下,电化学传感器更为简单和快速。
为了检测重金属,金纳米颗粒[7]、碳纳米管[8]、石墨烯[9]等一系列纳米材料在电化学传感器中得到了广泛应用。其中,氢氧化物纳米材料是一类令人感兴趣的电极修饰材料,包括FeOOH、MnOOH[10]、AlOOH[11]、NiOOH[12]、CoOOH[13]等。羟基氧化铁(FeOOH)作为一类新型的无机纳米材料,具有独特的电催化活性,有望应用于重金属的检测。
FeOOH 主要有四种晶体结构:α-FeOOH(针铁矿)、β-FeOOH(四方纤铁矿)、γ-FeOOH(纤铁矿)、δ-FeOOH(六方纤铁矿)[14]。不同的晶体结构会表现出不同的电化学性能,其中,最常使用的是α-FeOOH。Yang 等人[15]进一步比较了α-FeOOH 和β-FeOOH对Pb(II)的电敏感性,发现α-FeOOH 对Pb(II)的吸附能力强于β-FeOOH,有助于检测Pb(II)。
目前,FeOOH 已经应用于电化学传感器中,由于其优异的电催化性能,在对H2O2的非酶检测中应用广泛[16-20]。但目前,使用FeOOH 修饰的电极检测重金属离子的报道还很少。Liu 等[21]通过在纳米多孔金微电极上沉积FeOOH 实现了对Hg(II)的检测,且发现具有高吸附能力的FeOOH 纳米薄片可以将分析物堆积在电极表面上,这使得电极具有灵敏度高、检测限低的特点。Zhang 等人[22]利用α-FeOOH 作为吸附剂和电极基体改性剂,实现了对As(III)的选择性富集以及电化学检测。此外,Zhong 等人[23]联合电化学和比色方法,基于As(V)对FeOOH 纳米棒的过氧化物酶活性的抑制作用,实现了对As(V)的检测。
以上文献合成FeOOH 大多采用湿化学法或水热法,耗时长、步骤复杂,相比之下,电沉积路线更为简单易行。Jiao 等人[24]开发了一种电沉积路线,通过在(NH4)2Fe(SO4)2和CH3COOK 水溶液中电沉积制备了α-FeOOH,而且改变二者的浓度可以获得不同尺寸和形状的纳米结构,基于此方法可以快速在电极表面制备α-FeOOH。
本文中,开发了一种海胆状FeOOH 修饰的丝网印刷金电极,用于同时检测Pb(II)和Cu(II)。通过电沉积法快速制备FeOOH 修饰的丝网印刷金电极,使用方波溶出伏安法(SWSV)检测Pb(II)和Cu(II)两种重金属离子,流程图如图1 所示。此外,还对检测条件进行了优化,对电极的性能进行了测试,并将其应用于实际样本。

图1 FeOOH 修饰的丝网印刷金电极制备及Pb(II)和Cu(II)检测的流程图
1 实验
1.1 实验试剂与仪器
六水合硫酸亚铁铵(NH4)2Fe(SO4)2·6H2O、无水乙酸钠 CH3COONa 用于修饰电极。乙酸CH3COOH、无水乙酸钠CH3COONa 用于配置乙酸-乙酸钠缓冲溶液。铁氰化钾K3[Fe(CN)6]、亚铁氰化钾K4[Fe(CN)6]和氯化钾KCl 用于对电极的循环伏安测试。硫酸H2SO4经稀释后用于电极的活化。氢氧化钠NaOH 用于调节溶液的pH。MgSO4、Al(NO3)3、KCl、CaCl2、Cr(NO3)3、K2Cr2O7、MnSO4、FeSO4、ZnCl2、AgNO3、Cd(NO3)2、Hg(NO3)2等用于离子干扰实验。以上试剂均为分析纯,购自国药集团化学试剂有限公司。铅标准样品(1 000 μg/mL,1% HNO3)、铜标准样品(100 μg/mL,1% HNO3)购自上海麦克林生化科技有限公司。实验中使用的超纯水(>18.2 MΩ cm)由Heal Force 超纯水系统制得,用于溶液稀释及清洗。
电化学分析采用上海辰华的CHI660E 电化学工作站。DRP-220BT 丝网印刷电极购自瑞士万通中国有限公司。pH 测量采用雷磁PHS-4F 型pH计。使用的场发射扫描电子显微镜为卡尔蔡司的Ultra 55 型号。原子吸收光谱法使用赛默飞世尔的SOLAAR M 系列原子吸收光谱仪。
1.2 电极的修饰
修饰前,需对丝网印刷电极进行活化,以去除其金工作电极表面的氧化层,使电极处于最佳工作状态,具体活化方法如下:丝网印刷电极在0.5 mol/L的硫酸溶液中采用循环伏安法自0 V 至1.5 V 以0.1 V/s 的速度扫描10 圈。活化完成后,对丝网印刷电极进行FeOOH 修饰。FeOOH 修饰采用电沉积的方法,参考文献[21]中的做法,在0.1 mol/L 乙酸钠和0.01 mol/L 硫酸亚铁铵的混合溶液中对丝网印刷电极施加1 800 s 的0.7 V 恒电位。修饰完成后,冲洗电极并准备用于检测Pb(II)和Cu(II)。
1.3 Pb(II)和Cu(II)的检测
实验中对于重金属Pb(II)和Cu(II)的检测采用方波溶出伏安法。在富集电压-0.6 V、富集时间120 s、静息电压-0.5 V、静息时间15 s 的条件下,使用pH=4.5 的乙酸-乙酸钠缓冲溶液作为电化学过程中的支持电解质溶液。方波溶出伏安法的参数如下:步进电压5 mV,脉冲幅度50 mV,脉冲周期25 Hz,扫描起始电压-0.5 V,扫描终止电压0.5 V。
2 结果与讨论
2.1 电极的表征
图2(a)、2(b)是修饰前的扫描电镜图,放大倍数分别为10 000 倍和50 000 倍。可以观察到电极表面坑洼不平的球状结构,其直径大小普遍在1 μm左右。图2(c)、2(d)是修饰后的扫描电镜图,放大倍数分别为10 000 倍和50 000 倍。修饰后,电极表面变为海胆状的刺球结构,这对于增加电极比表面积、增大检测过程中的电流密度响应具有十分重要的意义。

图2 修饰前后丝网印刷金电极的扫描电子显微镜对比图
2.2 电极的电化学特性
为了研究电极修饰引起的变化,使用了铁氰化钾/亚铁氰化钾氧化还原对。在含有5 mmol/L[Fe(CN)6]4-/[Fe(CN)6]3-的0.1 mol/L KCl 溶液中分别对修饰前后的电极进行循环伏安扫描,并依次改变扫描速率,如图3(a)所示。根据Randles-Sevcik 方程[25],计算得到修饰前后电极的活性表面积分别为6.83 mm2和11.6 mm2。活性表面积用于计算电化学过程中的电流密度,以更好地评估电极的电化学性能。
使用方波溶出伏安法在含有100 μg/L Pb(II)、Cu(II)的pH=4.5 的乙酸-乙酸钠缓冲溶液中检测修饰前后的电流密度变化。结果如图3(b)所示,其中虚线为未加入重金属离子的基线响应。Pb(II)的溶出峰出现在-0.1 V 左右,Cu(II)的溶出峰出现在0.25 V 左右。修饰后电极的电流密度明显增大,尤其是Pb(II)的峰变尖锐了。这说明FeOOH 修饰的丝网印刷金电极的灵敏度比修饰前提高了50%以上,适用于Pb(II)和Cu(II)的检测。

图3 修饰前后丝网印刷金电极的电化学测试结果图
2.3 实验条件的优化
溶出伏安法分为富集和溶出两个阶段,富集阶段对溶出阶段的电流信号有很大的影响。因此,富集电压和富集时间的优化十分关键。此外,还优化了溶液的pH。
在含有100 μg/L Pb(II)、Cu(II)的pH =4.5 的乙酸-乙酸钠缓冲溶液中研究了-0.9 V 至-0.3 V 的富集电压对溶出电流密度的影响,结果如图4(a)所示。由图可见,富集电压越负,Pb(II)和Cu(II)的电流密度越大,但同时电流密度的标准差也急剧增大,这主要是由于电压过负导致的析氢反应。实验过程中也可以观察到电极表面不断有小气泡产生,然后融合为大气泡,最终破裂,这严重影响了重金属离子在电极表面富集的一致性。因此,将富集电压确定在-0.6 V 是比较合理的。
在富集电压为-0.6 V 的条件下,优化了富集时间,结果如图4(b)所示。随着富集时间的增加,Pb(II)和Cu(II)的电流密度不断增大,但当富集时间超过120 s 后,电流密度的增加速度降低,尤其是Pb(II)。因此,将富集时间确定为120 s,继续增加富集时间虽然可以使电流密度小幅增加,但会付出较大的时间成本。
配制了一系列pH 为3.5 至5.5 的乙酸-乙酸钠缓冲溶液,并加入100 μg/L Pb(II)和Cu(II),其溶出电流密度如图4(c)所示。由图可见,pH 为3.5至5.5 的范围内,电流密度的变化不大,pH 不会对检测造成明显影响,说明该电极能够适应在该pH范围内对Pb(II)和Cu(II)的检测。考虑到乙酸的酸解离常数pKa 为4.76,乙酸-乙酸钠缓冲溶液在3.6 至5.8 的pH 范围内具有较好的缓冲效果,因此,选择在缓冲能力较强的pH 为4.5 的缓冲溶液中检测。
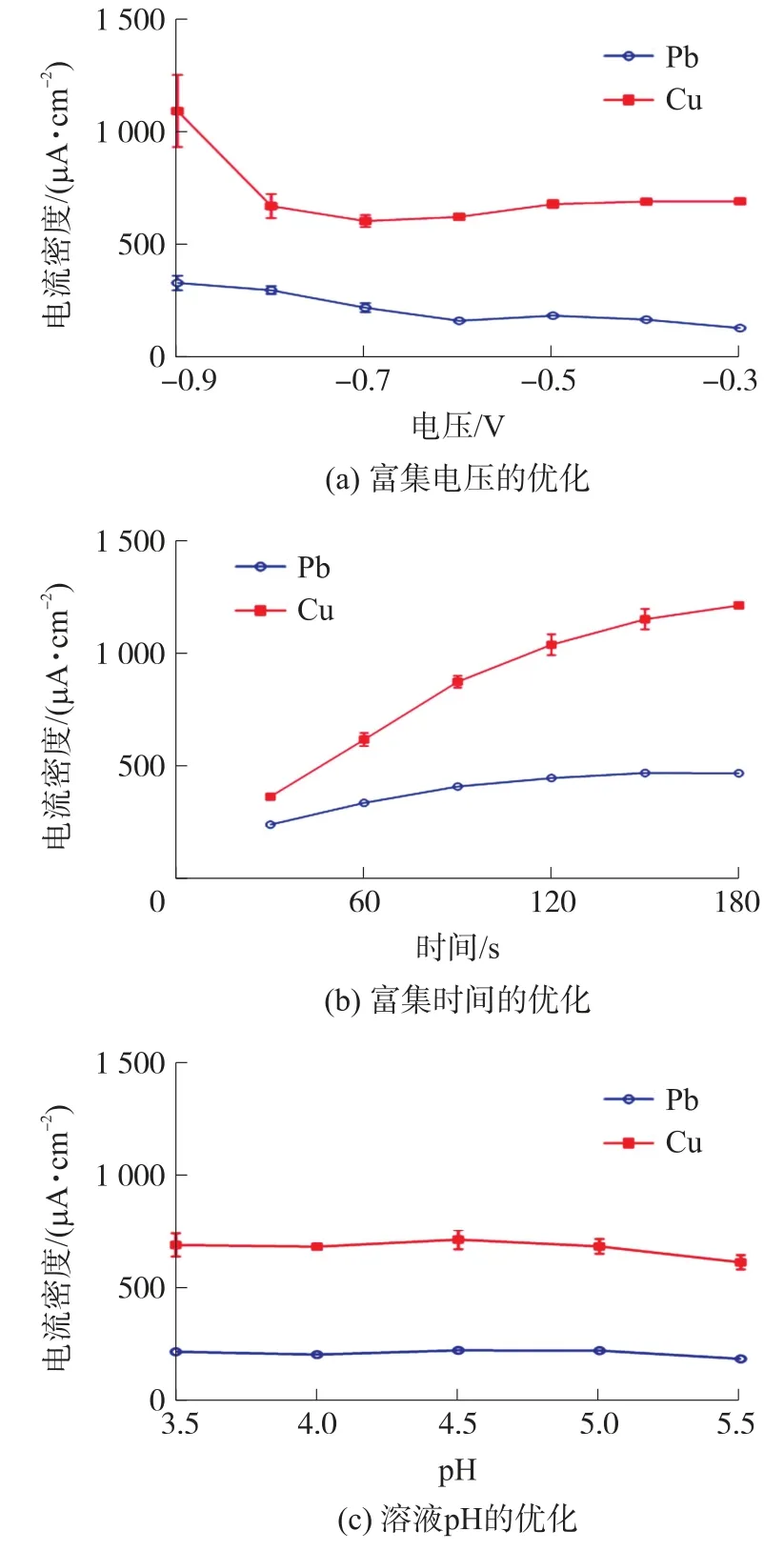
图4 FeOOH 修饰的丝网印刷金电极检测Pb(II)和Cu(II)的实验条件优化结果图
2.4 Pb(II)和Cu(II)的同时检测
在富集电压为-0.6 V、富集时间为120 s、溶液pH为4.5 的优化条件下,图5(a)为Pb(II)和Cu(II)在10 μg/L 至200 μg/L 范围内的电流密度曲线,其中25 μg/L 至200 μg/L 的步长为25 μg/L。图5(b)为Pb(II)和Cu(II)的标准曲线,相关系数分别为0.94和0.99,灵敏度分别为0.66 μA L μg-1cm-2和4.19 μA L μg-1cm-2。计算得到Pb(II)和Cu(II)的检出限(LOD)分别为2.82 μg/L 和0.44 μg/L,低于国家地表水Ⅰ类标准(标准均为10 μg/L)。
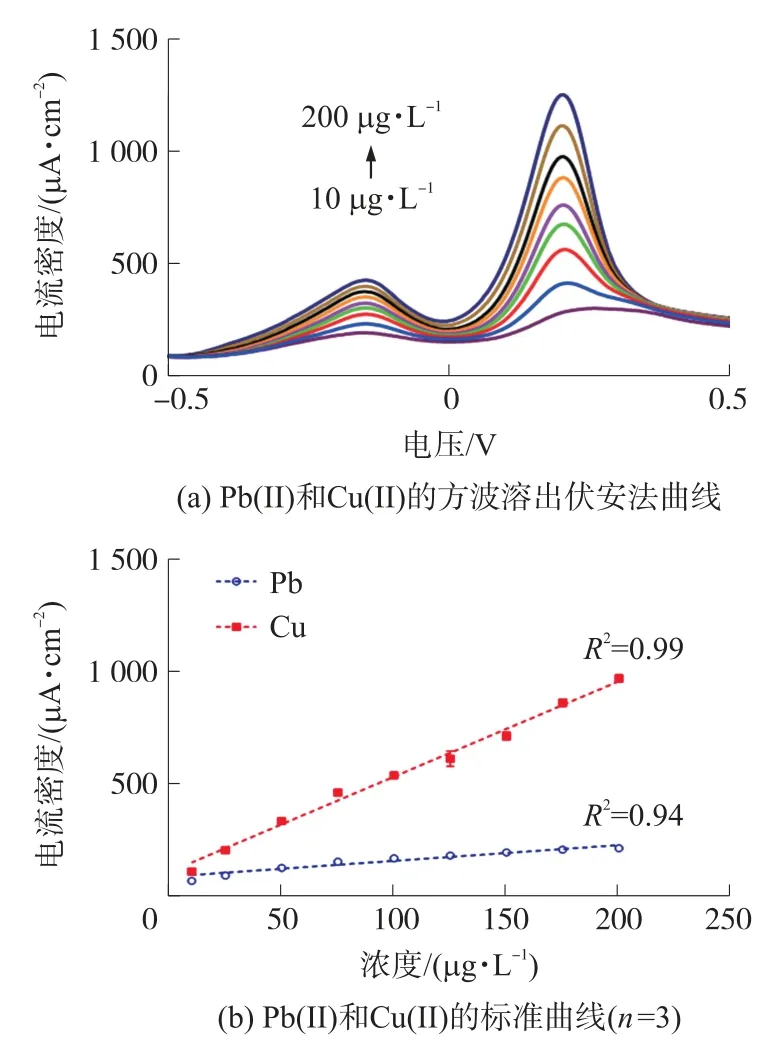
图5 FeOOH 修饰的丝网印刷金电极同时检测Pb(II)和Cu(II)的结果图
2.5 电极的重复性、一致性与抗干扰性
对同一电极进行连续10 次方波溶出伏安法扫描,以验证电极的重复性,结果如图6(a)所示,溶出曲线基本重叠,说明电极具有良好的重复性,Pb(II)和Cu(II)的相对标准偏差(RSD)分别为4.27%和3.37%。
为了验证电极的一致性,测试了3 个FeOOH 修饰的丝网印刷金电极的溶出伏安响应。图6(b)中,Pb(II)和Cu(II)的相对标准偏差分别为8.22%和1.19%,可见电极的一致性较好。
使用电化学方法检测Pb(II)和Cu(II)的过程中,电极易受到其他离子的干扰,因此进行了电极的抗干扰性实验。在Pb(II)和Cu(II)浓度均为100 μg/L 的情况下,研究了分别加入100 μg/L 的Mg(II)、Al(III)、K(I)、Ca(II)、Cr(III)、Cr(VI)、Mn(II)、Fe(II)、Zn(II)、Ag(I)、Cd(II)、Hg(II)等干扰离子的响应变化情况。图6(c)是添加干扰离子后Pb(II)和Cu(II)的响应变化情况,为-0.1 V 和0.25 V电位附近处加入后的溶出峰电流密度与加入前的比值,由图可见,同浓度的干扰离子对Pb(II)和Cu(II)的溶出峰电流密度影响有限。

图6 FeOOH 修饰的丝网印刷金电极的性能测试结果图
2.6 实际样本检测
为了验证电极的实际样本检测能力,从城市自来水系统中取流动水样,使用FeOOH 修饰的丝网印刷金电极对Pb(II)和Cu(II)进行检测,并与标准方法原子吸收光谱法比较。其中,使用电极进行电化学分析时,加入乙酸和乙酸钠以提供必需的支持电解质。结果显示,两种方法均未检测到Pb(II)和Cu(II)。为防止假阴性,采用标准回收的方法确认实际样品中FeOOH 修饰的丝网印刷金电极的检测能力。表1 是电极在50 μg/L 和200 μg/L 浓度下的回收率,可见无论是较低浓度还是高浓度,回收率的偏差均较小,FeOOH 修饰的丝网印刷金电极可以用于实际样品分析。
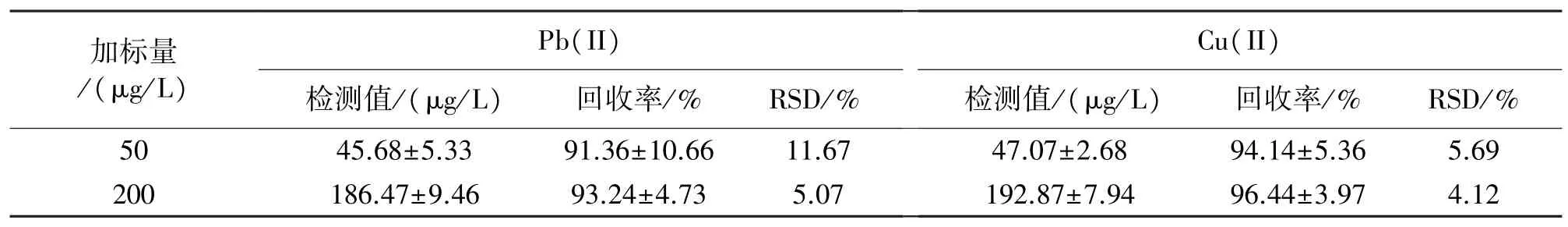
表1 实际样品中Pb(II)和Cu(II)的回收率
3 结论
研究了一种简单的电沉积方法,制备了基于FeOOH 修饰的丝网印刷电极,可用于检测水中的Pb(II)和Cu(II)。扫描电子显微镜检测表明,修饰后的电极表面为海胆状的刺球结构,这有利于提高电化学传感器响应的电流密度和检测灵敏度。通过检测过程中对传感器富集电压、富集时间、溶液pH等参数的优化设计,建立了传感器检测Pb(II)和Cu(II)的标准曲线,实现了传感器在10 μg/L 到200 μg/L 的浓度范围内对Pb(II)和Cu(II)的定量检测,检出限分别为2.82 μg/L 和0.44 μg/L。实验结果表明,传感器具有良好的重复性、一致性与抗干扰性,可以应用于实际自来水样本中Pb(II)和Cu(II)的同时检测,具有良好的应用推广前景。
