PRRSV-1在我国的流行现状及其感染防控的研究进展
2022-02-04谭菲菲田克恭
谭菲菲,周 智,田克恭,4*
(1.普莱柯生物工程股份有限公司,河南 洛阳 471003;2.国家兽用药品工程技术研究中心,河南 洛阳 471003;3.中国动物疫病预防控制中心,北京 100125;4.国家/OⅠE猪繁殖与呼吸综合征参考实验室,北京 100125)
猪繁殖与呼吸综合征(Porcine respiratory and re⁃productive syndrome,PRRS)俗称“猪蓝耳病”,是以母猪厌食和流产、死胎、木乃伊胎、弱仔等繁殖障碍及仔猪呼吸道症状为特征的一种严重危害养猪业的传染病[1]。20 世纪80 年代末,美国的猪场出现了一种“猪神秘病”,90 年代初德国也报道了症状相似的疫病,随后很快蔓延至荷兰、比利时、西班牙等国家[2]。1992 年5 月份在美国召开的第一届国际猪病学术会上,统一将该病正式命名为“猪繁殖与呼吸综合征”[3],目前该病已在世界范围内普遍存在,且对全球养猪业造成了严重的影响。引起PRRS 的病原为PRRS 病毒(PRRSV)。1991 年,荷兰首次分离到PRRSV,命名为Lelystad 株[4],1992 年美国分离到另一株病毒,命名为VR2332 株[5]。1996 年郭宝清首次从我国猪场的流产胎儿中分离到了PRRSV CH-1a株,证实了该病毒在我国的存在[6]。2006 年我国暴发的高致病性PRRS(HP-PRRS)病,给中国养猪业带来了严重的经济损失[7]。2013 年之后,类NADC30 株开始在我国流行,并逐渐成为猪群的流行株[8-9]。
根据2017 年国际病毒分类委员会(The Interna⁃tional Committee on Taxonomy of Viruses,ICTV)的最新分类原则,PRRSV 属于套式病毒目动脉炎病毒科Po⁃rarterivirus属,进一步可分为两个种:PRRSV-1 和PRRSV-2[10]。PRRSV-1 和PRRSV-2 基 因 组 结 构 相同,均为不分节段的单股正链RNA,长约15.4 kb,5'端到3'端 分 别 为5'非 编 码 区(Untran-slated region,5'UTR)、ORF(Open reading frame)1、ORF2a、ORF2b、ORF3-ORF5、ORF5a、ORF6、ORF7、3'UTR,5'UTR 上游为帽子结构,3'UTR 下游为Poly(A)尾[11-12]。ORF1占病毒基因组的80%,编码病毒的复制酶复合体,通过核糖体移码机制翻译产生两个多聚蛋白(Poly⁃protein)pp1a 和pp1ab,由ORF1a 编码的3 种蛋白酶切割产生至少14 种非结构蛋白(Nonstructural protein,Nsp),其 中Nsp2 变 异 最 大[13]。ORF2a、ORF2b、ORF3、ORF4、ORF5a 分别编码的糖基化膜蛋白(Glycoprotein,GP)GP2a、E(Envelope)蛋白、GP3、GP4、GP5a,是病毒的次要结构蛋白;ORF5、ORF6、ORF7 分别编码的糖基化囊膜蛋白GP5、非糖基化膜蛋白M(Membrane protein)、核衣壳蛋白N(Nucleocap⁃sid protein),是病毒的主要结构蛋白[14]。结构蛋白的ORF 之间有不同程度的重叠,通过一系列共5'和3'端的亚基因组翻译产生,其中GP5 是最易变异的结构蛋白。
1 PRRSV-1 在我国的整体流行情况
2011 年陈南华等首次从2006 年~2009 年采集的临床样品中分离、鉴定出2 株PRRSV-1(BJEU06-1、NMEU09-1),这是首次在中国大陆发现PRRSV-1 临床分离株[15]。国内公开发表的文章与国家/OIE 猪繁殖与呼吸综合征参考实验室2018 年~2020 年连续3 年的监测数据显示,迄今为止PRRSV-1 已经在我国至少22 个省份流行,遍布华中、华北、华南、华东、东北、西南地区[16-20]。顾小雪2011 年~2013 年对全国29 个省、市、自治区的98 个原种猪场进行PRRSV病原监测,结果连续3 年PRRSV-1 的个体阳性率分别为0.26%、0.16%、0.03%,场阳性率分别为8.16%、5.26%、1.08%[21],表明PRRSV-1 在原种猪群中持续存在。国家/OIE PRRS 参考实验室连续3 年从原种猪场、屠宰场和临床样品中均能检测到PRRSV-1,其中原种猪场2018 年、2019 年、2020年PRRSV-1 阳性场的比例分别为6.3%(6/95)、9.6%(8/83)、3.8%(3/79),阳性样品的比例分别为1.4%(53/3823)、2.5%(119/4764)、0.1%(3/3148)。屠宰场2018 年、2019 年PRRSV-1 阳性场的比例分别为10%(5/50)、3/46(6.5%),阳性样品的比例分别为0.4%(10/2480)、0.3%(13/4256)。临床样品2018 年、2019 年、2020 年的PRRSV-1 阳性样品比例分别为8.8%(10/114)、43.5%(10/23)、4%(2/50)。数据显示原种猪场PRRSV-1 的检出率高于屠宰场,表明我国PRRSV-1 的源头可能仍与引种相关;而屠宰场持续检出阳性,表明PRRSV-1 已从原种猪场扩散至商品猪场;临床样品的高检出率提示出现疑似PRRS 临床症状的猪群,既要检测PRRSV-2、也要检测PRRSV-1。翟少伦等收集了广东省50 个养殖场的750 份样品,其中PRRSV-1 阳性率24.8%(186 份),是我国PRRSV-1 阳性检出率最高的报道[22]。
2013 年开始,本实验室持续对临床样品进行PRRSV的监测,检测为阳性的样品进行病毒分离和全基因组测序,至今共分离鉴定到5株PRRSV-1(P073-3、180420-1、180975-5、200604-75、181187-2),获得6 条PRRSV-1 的全基因组序列(P073-3 的GenBank登 录 号MK214314, 180900-5 的GenBank 登 录 号MK303390;其余4 条序列未公开)[23]。截至2021 年10月,公开发表的文献资料表明国内分离鉴定的PRRSV-1 有53 株[16-20];GenBank 共有32 条国内提交的PRRSV-1 全基因组序列,另有27 条PRRSV-1 单个基因序列,以ORF5 为主,其中多条序列与PRRSV-1疫苗株的序列一致性达99%以上[18,20,24]。与国内提交至GenBank 的上千条PRRSV-2 全基因组与单个基因序列相比,PRRSV-1 的序列仍较少,一方面由于PRRSV-1 不是国内流行的PRRSV,另一方面反映了国内养猪业对PRRSV-1 的重视程度不高。
2 PRRSV-1 的遗传变异情况
2.1 遗传进化分析PRRSV-1 自1990 年在荷兰发现以来,迅速蔓延到欧洲各个国家。欧盟内部密集的猪肉贸易使病毒在各国家之间传播,活疫苗的使用也加剧了PRRSV-1 的变异和进化[25-27]。PRRSV-1分 为4 个 亚 型:Subtype I(Global)、Subtype I(Rus⁃sia)、Subtype II(Russia;Lithuania;Belarus)和Sub⁃type III[28]。西欧和中欧主要流行Subtype I(Global),目前仅此亚型蔓延到欧洲以外的地区,包括美国[29]、加拿大[30]、韩国[31-32]、中国[15]、泰国[33]等。
陈南华等在2017 年首次将国内的PRRSV-1 分为4 个 基 因 亚 群[34]:Amervac-like、BJEU06-1-like、HKEU-16-like、NMEU09-1-like。其 中BJEU06-1、NMEU09-1-like 为国内首次分离自北京、内蒙古的PRRSV[15];HKEU-16 为2007 年香港分离株;疫苗株指西班牙海博莱生物大药厂(HIPRA)生产的活疫苗AMERVAC PRRS。目前为止国内分离到的PRRSV-1以Subtype I(Global)居多,如广西2020 年~2021 年新发PRRSV-1 的ORF5 基因与香港分离欧洲株HKEU16 亲缘关系较近[35]。但焦臣鹏从广东分离到的PRRSV-1 CN-2016 株与PRRSV-1 Lena 株的亲缘关系较近[36],Lena 为Subtype III 的代表株,表明可能有其他亚型的PRRSV-1 在我国出现。
顾瑞恒利用MEGA对本实验室获得的6条PRRSV-1全基因组序列与GenBank 中的57 条全基因组序列进行遗传进化分析,结果180975-5株位于Amervac-like亚群;P073-3 株位于NMEU09-1 亚群;180420-1、200604-75 株 位于BJEU06-1 like 亚群;而181187-2、180900-5 株与意大利分离的高致病性PRRSV(HPPRRSV)PR40/2014 株[37]遗传距离较近,且形成一个新的分支[23];6 条ORF5 序列与国内外94 株ORF5 序列的遗传进化分析结果与全基因组分析结果一致[23]。表明国内的PRRSV-1 在持续发生变异或有新的病毒株被引入我国,且致病性可能有增强的趋势,因此需要持续关注和监测PRRSV-1 的流行情况。
2.2 氨基酸高变区序列分析国内分离的PRRSV-1基因组的高变区主要位于非结构蛋白Nsp2和结构蛋白ORF3 的编码区、ORF4 重叠区域[38]。最近有文献报道从全国性病原监测样品中分离到4株PRRSV-1,全基因组核苷酸序列与LV 株的一致性介于87.4%~90.7%,变异区域主要集中于Nsp2、ORF3 和ORF4,且存在不连续的碱基缺失或插入,导致相应的氨基酸缺失或插入[17,39]。对国内代表株的Nsp2序列分析表明,与LV 株相比,我国PRRSV-1 Nsp2 区域存在至少12 种不同类型的插入或缺失模式,其中(aa357~aa360)+aa411 缺失是出现频率最高的缺失类型[19]。本实验室获得的6 株序列中有2 株(180420-1、200604-75)为该缺失模式;其余4 株的缺失类型如下:180975-5 株的aa288~aa294 缺失;P073-3 株的aa310~aa343+aa423~aa431缺失及aa697插入;180900-5和181187-2株的aa306~aa359 缺失,均为国内尚未见报道的缺失/插入类型。对国内代表株的ORF3、ORF4 重叠区域(LV 株重叠区域为256 个碱基)进行核苷酸序列分析,与LV 株相比,我国PRRSV-1 分离株ORF3 与ORF4 重叠区域的核苷酸存在不同长度的缺失,进而导致GP3、GP4 两个蛋白的氨基酸均发生缺失。GP3的缺失特征如图1A 所示,aa238~aa245 缺失与aa243缺失出现的频率最高,本实验室获得的P073-3 与180900-5、180420-1、181187-2 株分别具有这两种缺失特征,200604-75 株的aa241~aa245 缺失,而180975-5 株未缺失。GP4 的缺失特征如图1B 所示,aa60~aa67 缺失与aa63 缺失出现的频率最高,本实验室获得的P073-3 株与180900-5、180420-1、181187-26 株分别具有这两种缺失特征,而200604-75 株的aa60~aa63+aa68 缺失,而180975-5 株未缺失。表明国内分离的PRRSV-1 Nsp2 与ORF3/4 重叠区域仍是基因组变异较大的区域,且不断地有新的缺失/插入类型被报道,进一步提示需要持续关注PRRSV-1 的流行及序列变异情况。
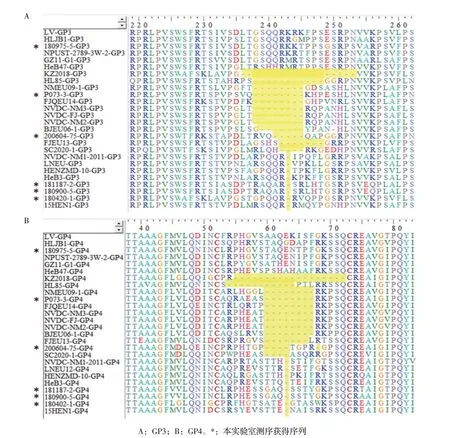
图1 ORF3与ORF4重叠区域核苷酸缺失导致的GP3、GP4氨基酸序列缺失特征
2.3 重组分析2017 年陈南华等在国内分离到的PRRSV-1 HLJB1 株全基因组序列(KT224385)与疫苗株Amervac 的一致性最高(91.64%),但进化树分析HLJB1 株位于BJEU06-1 like 亚群;利用RDP4 重组软件检测到HLJB1 分离株为Amervac 疫苗株和BJEU06-1 株之间的重组,在ORF1a~ORF3 之间存在3 个潜在的重组断点,是国内第一篇PRRSV-1 疫苗株与野毒株自然重组的文章[34]。2020 年于芳等对GenBank 的91 条PRRSV-1 分离株的全基因组序列进行重组分析,结果共有24 个重组株,其中5 个重组事件涉及疫苗株(1 株为国内PRRSV HLJB1)[40]。
2021 年顾瑞恒利用RDP4 软件对本实验室的6 株PRRSV 进行重组分析,结果6 株病毒均不存在重组事件[23]。PRRSV 自身具有易重组的特性,虽然目前国内报道的PRRSV-1 重组株较少,但随着临床越来越多的PRRSV-1 被检测到,PRRSV-1 在自然界的重组也不容忽视,需要持续监测分析。
3 我国PRRSV-1 的致病性研究
以LV 为代表的Subtype 1 亚型的PRRSV-1 均具有中等致病性,致宿主表现为轻微的临床症状和病理变化[41-43]。但是从2006 年起东欧国家开始出现高致病性PRRSV-1[44],之后西欧、韩国等地也出现HPPRRSV-1,宿主感染后均表现出更严重的临床症状、病理变化、病毒血症、高组织病毒载量或更高死亡率[32,45]。
我国目前报道的已经做过致病性评价的PRRSV-1有3 株,分别为GZ11-G1 株[46]、HLJB1 株(KT224385)[47]、LNEU12 株[48]。3 株病毒的亚群、接种仔猪日龄及接种途径、造成的临床症状和主要的剖检变化汇总如表1所示。总体而言,3株病毒均为中等致病性,接种后未造成仔猪死亡,主要的病变组织为肺脏和淋巴结。如前文所述,本实验室获得的181187-2、180900-5株与意大利分离的HP-PRRSV 遗传距离较近;但180900-5 株的致病性评价表明该病毒株为中等致病力,未表现出与国外HP-PRRSV-1 相同的致病力(文章未发表)。虽然目前国内仍无HP-PRRSV-1 的出现,但国外HP-PRRSV-1 在陆续出现[49],且随着PRRSV-1 在国内的持续演化变异及种猪贸易往来,国内是否也会出现HP-PRRSV-1 株值得持续关注。

表1 国内PRRSV-1分离株的致病性评价结果汇总
4 小结与展望
PRRS 自上世纪80 年代出现以来已在全球流行30 多年,研究者对其病原学、病毒与宿主互作、病毒遗传变异特性等已经有了更加深入的了解,但因其变异频繁、容易重组等特性仍给PRRS 的防控带来极大的挑战。目前PRRSV-2 仍是我国的主要流行株,且近年来PRRSV-2的变异与演化呈现加快、病毒株多样性急剧增加的趋势,新病毒株及重组病毒株出现的频率不断提高,已经受到了广泛关注[50]。与PRRSV-2 相比,目前PRRSV-1 对我国养猪业的危害较小,但是近年来越来越多的PRRSV-1被分离到,病毒多样性也在增加,应引起足够重视。
由于国内的核心原种猪群主要通过不定期从国外引种来补充和更新,2018 年~2020 年连续3 年原种猪场PRRSV-1 的检出率均高于屠宰场,表明我国PRRSV-1 的源头可能仍与引种相关,所以引种前必须严格实施隔离检疫,做到从源头控制。尽管PRRSV-1 疫苗并未正式在我国注册使用,但国内多位研究者从临床分离的PRRSV-1 的序列与疫苗株的序列一致性均较高[18,20,24,51],表明国内可能有猪场使用PRRSV-1 疫苗。虽然目前国内报道的PRRSV-1 分离株的致病性均为中等,但为了避免疫苗株与野毒株重组产生HP-PRRSV-1 株,应禁止非法使用PRRSV-1疫苗。
为贯彻落实《中华人民共和国动物防疫法》的有关要求,2021 年10 月,农业农村部关于推进动物疫病净化工作的意见中明确将PRRS 列入需净化的重大动物疫病之一,需要在种猪场扎实开展PRRS 等垂直传播性疫病的净化。因此有必要持续关注PRRSV-1在我国猪群中的感染及造成的临床疾病,并持续监测其遗传变异以及可能出现的新病毒株,为采取积极有效的防控策略积累必要的分子与流行病学研究基础。在推进净化工作的时候,既要关注PRRSV-2株,同时也要关注PRRSV-1 株,同时需要强化针对PRRSV-1 和PRRSV-2 的检测技术研究,建立及完善相应的检测方法与诊断标准。
