甘草酸通过HMGB1/TLR4/JNK信号通路抗猪急性腹泻综合症冠状病毒感染的研究
2022-02-04冯书风时洪艳张记宇陈建飞张燎原冯廷帅景朝阳季朝阳
冯书风,时洪艳,张记宇,陈建飞,张 鑫,张燎原,冯廷帅,景朝阳,季朝阳,石 达,冯 力
(中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室,黑龙江 哈尔滨 150069)
2019 年12 月新型冠状病毒肺炎(Coronavirus dis⁃ease 2019,COVID-19)的暴发,给人类的健康造成了致命的威胁[1]。2017 年在广东省清远某猪场首次分离鉴定出一种新发病毒[2],经过测序发现该病毒与甲型冠状病毒属的菊头蝠冠状病毒HKU2 序列同源性高达95%,命名为猪急性腹泻综合征冠状病毒(SADS-CoV)[2-3],该病的暴发造成数个大型猪场约两万仔猪死亡;据Li 等报道2018 年在福建省某猪场也出现了SADS-CoV[4];2019 年2 月在广东省再次出现了SADS-CoV 的感染,导致将近2 000 头仔猪死亡[2]。猪急性腹泻综合征(SADS)的暴发给养猪业造成了严重的经济损失。SADS-CoV 属于套式病毒目、冠状病毒科、α-冠状病毒属成员,是有囊膜的单股正链RNA 病毒,基因组约27 kb,有4 个结构蛋白,分别为纤突蛋白S、囊膜蛋白E、膜蛋白M 和核衣壳蛋白N[5]。除此之外,还包括复制酶ORF1a、ORF1b及非结构蛋白NS3a、NS7a、NS7b 等。SADS-CoV 物种嗜性广泛,可以感染蝙蝠、鸡、小鼠甚至人类的多种细胞系,同时有学者也建立了SADS-CoV 感染的小鼠模型[6],在一定程度上说明该病毒能够跨物种传播,因此更应重视该病的防控。截止目前,尚无针对SADS-CoV 的特效药或有效疫苗,甘草酸(Glyc⁃yrrhizin,GLY)是从甘草中提取的一种毒性较低的天然药物,具有抗炎、抗病毒、抗肿瘤、抗癌症、免疫调节、增强其他药物活性等作用[7-8]。GLY 还可以减少因外界刺激或病原侵入而引起的炎症因子的产生,因而具有治疗作用。因此,本研究利用western blot、TCID50和间接免疫荧光试验(IFA)等方法探究GLY 抗SADS-CoV 体外感染的信号通路,为SADS 的防制提供新的参考依据。
1 材料与方法
1.1 主要实验材料SADS- CoV/GDWT/CN 株(MG557844.1)由华南农业大学马静云教授惠赠;猪回肠上皮细胞(IPI-2I)和非洲绿猴肾细胞(Vero E6)由本实验室保存;GLY、瑞沙托维(TAK)和JNK 抑制剂SP600125 购自MedChemExpress 公司;胎牛血清购自金源康生物科技有限公司;DMEM 购自Gibco 公司;Cell Counting Kit-8 购 自Dojindo 公 司;Prime ScriptTMⅣ1st strand cDNA Synthesis Mix 购自宝生物工程(大连)有限公司;X-tremeGENE siRNA 转染试剂和兔源GAPDH 单克隆抗体(MAb)购自Sigma公司;SADS-CoV N 蛋白MAb 由本实验室制备;兔源RAGE MAb、p-p38 MAb、p-JNK MAb、p-ERK1/2 MAb、p38 MAb、JNK MAb、ERK1/2 MAb、HMGB1 MAb、HA PAb 均购自Ab⁃cam 公司;羊抗鼠IgG-Dy680、羊抗兔IgG-Dy680 购自Invitrogen公司。
1.2 GLY 对SADS-CoV 感染影响的检测将DMSO(对照组)和不同浓度的GLY(0.1 mmol/L、0.2 mmol/L、0.4 mmol/L、0.6 mmol/L、0.8 mmol/L)加入生长至约60%密度的Vero E6 和IPI-2I 细胞中培养24 h,每孔加入CCK-8 溶液,作用1 h 后用酶标仪测定OD450nm值,分析GLY 对细胞活性的影响。在Vero E6 和IPI-2I 细胞传代约48 h 后,用无菌的PBS清洗细胞,加入维持液,并用不同浓度的GLY 预处理2 h;洗去药物,分别感染SADS-CoV(MOI 0.1、MOI 1、MOI 5),作用1 h 后加入维持液和GLY,当细胞出现病变后,收获细胞上清液和细胞样品。对收获的细胞上清液用Vero E6 细胞测定TCID50,即每个细胞孔中加入100 μL 10 倍倍比稀释的细胞上清液(101~108),设定8 个重复孔,在37 ℃培养4 d~5 d,试验重复3 次并统计结果,通过Spearman-Karber 法计算病毒的滴度;将收获的蛋白样品利用western blot 检测病毒N 蛋白表达量的变化,即分别以SADS-CoV N 蛋白MAb(1∶1 000)、兔源GAPDH MAb(1∶5 000)为一抗,羊抗鼠IgG-Dy680(1∶10 000)、羊抗兔IgG-Dy680(1∶10 000)为二抗,经近红外荧光扫描成像系统成像,分析GLY 对SADS-CoV 体外感染的影响。
1.3 GLY 对病毒在Vero E6 和IPI-2I 细胞侵入和复制影响的检测将病毒液加入平皿中在超净台紫外照射12 h 灭活后不具有复制的能力[9]。利用不同浓度(见1.2)的GLY 分别对Vero E6 和IPI-2I 细胞预处理2 h后,感染MOI 1 的灭活病毒置于4 ℃作用1 h,加入不同浓度(见1.2)的GLY,37 ℃共孵育1 h 后收获细胞样品裂解后,以SADS-CoV N 蛋白MAb(1∶1 000)为一抗,羊抗鼠IgG-Dy680(1∶10 000)为二抗,经近红外荧光扫描成像系统成像,检测N 蛋白表达量的变化,分析GLY 对该病毒侵入的影响;选取0.4 mmol/L的GLY 对Vero E6 和IPI-2I 细胞预处理2 h 后,利用SADS-CoV(MOI 1)分别感染细胞2 h、6 h、12 h 后收获细胞上清液和细胞样品,按照1.2 的方法检测N 蛋白和病毒滴度,分析GLY 对病毒复制的影响。
1.4 HMGB1与其受体TLR4和RAGE的结合对SADSCoV 感染影响的检测采用软件SnapGene 设计HMGB1 以及其关键位点突变的引物,利用HMGB1 引物(HMGB1-U:GCATCGATATGGGCAAAGGAGATCCTA A/HMGB1-L: GCCTCGAGTTATTCATCATCATCATCTT)从Vero E6 细胞全基因组扩增HMGB1 基因,将其克隆于pCAGGS-HA 载体中构建重组真核表达质粒pHAHMGB1。以上述扩增的HMGB1 基因为模板,采用如下引物(HMGB1(C45S)-U:ACTTCTCAGAGTTTTCTAA GAAGAGCTCAGAGAGGTGGAAGACCATGTCT/HMGB1(C45S)-L:AGACATGGTCTTCCACCTCTCTGAGCTCTT CTTAGAAAACTCTGAGAAGT;HMGB1(C106S)-U:CT CCTTCGGCCTTCTTCCTGTTCAGCTCTGAGTATCGCCC AAAAATCAAA/HMGB1(C106S)-L:TTTGATTTTTGG GCGATACTCAGAGCTGAACAGGAAGAAGGCCGAAGG AG)经PCR 扩增HMGB1 的3 个突变体(C45S、C106S、C45/106S)基因,将其克隆于pCAGGS-HA 载体分别构建重组真核表达质粒pHA-HMGB1-C45S、pHAHMGB1-C106S、pHA-HMGB1-C45/106S,并由库美生物科技有限公司测序鉴定。将上述测序正确的3 个HMGB1 的突变真核表达质粒分别转染Vero E6 细胞48 h 后,感染SADS-CoV(MOI 0.1)24 h 后收获细胞样品和上清液;将合成有效的干扰小RNA(siRNA)和X-tremeGENE siRNA 转染试剂按照1∶1 比例混匀,加入密度约为30%的Vero E6 细胞中(HMGB1 和RAGE 的siRNA 靶序列如下:HMGB1:GGGAGGAGCAUAA GAAGAATT; RAGE: GCUGGAAUGGAAACUGAAUT T),感染SADS-CoV(MOI 0.1)24 h 后收获细胞样品和上清液。设置未处理组(No treat)以及加入转染试剂的Mock 组,按照1.2 的方法利用western blot 和TCID50检测N 蛋白变化量和病毒滴度的变化,分析HMGB1与TLR4、RAGE 的结合对该病毒感染的影响。
1.5 SADS-CoV 感染对细胞MAPK 信号通路影响的检测将Vero E6 和IPI-2I 细胞传代约48 h,感染SADS-CoV(MOI 0.1),分别于0.5 h、1 h、3 h、6 h、12 h、24 h、48 h 收获细胞样品,经细胞裂解液处理后分别以N 蛋白MAb(1∶1 000)、兔源p-p38 MAb(1∶1 000)、p38 MAb(1∶1 000)、p-JNK MAb(1∶1 000)、JNK MAb(1∶1 000)、p-ERK1/2 MAb(1∶1 000)、ERK1/2 MAb(1∶1 000)、GAPDH MAb(1∶5 000)为一抗,以羊抗鼠IgG-Dy680(1∶10 000)、羊抗兔IgGDy680(1∶10 000)为二抗,利用western blot 检测p-p38、p38、p-JNK、JNK、p-ERK、ERK、N、GAPDH 蛋白的表达量,分析该病毒感染对MAPK 信号通路的影响。
1.6 GLY、TAK、HMGB1 对细胞MAPK JNK 信号通路影响的检测利用不同浓度的GLY(0.1 mmol/L、0.2 mmol/L、0.4 mmol/L、0.8 mmol/L)和TAK(0.5 μmol/L、1 μmol/L、5 μmol/L、10 μmol/L)对Vero E6 和IPI-2I细胞预处理2 h 后,感染SADS-CoV(MOI 0.1),24 h后收获细胞样品,按照1.5 的方法采用western blot 检测p-p38、p38、p-JNK、JNK、p-ERK、ERK、N、GAPDH 蛋白的表达量,分析GLY 和TAK 对该通路的影响。将SADS-CoV(MOI 0.1)感染Vero E6 细胞并加入不同剂量(0.1 μL、0.5 μL、1 μL)的商品HMGB1中和抗体;将构建的3 种HMGB1 突变真核表达质粒以 及HMGB1 的siRNA 分 别 转 染Vero E6 细 胞48 h 后感染SADS-CoV(MOI 0.1),设置未处理组(No treat)以及加入转染试剂的Mock组,24 h后收获细胞样品,分别以N 蛋白MAb(1∶1 000)、兔源p-JNK MAb(1∶1 000)、GAPDH MAb(1∶5 000)为一抗,以羊抗鼠IgG-Dy680(1∶10 000)、羊抗兔IgG-Dy680(1∶10 000)为二抗,利用western blot 检测p-JNK、N、GAPDH 蛋白的表达量,分析HMGB1 对JNK 磷酸化的影响。
1.7 JNK 的竞争性抑制剂SP600125 对SADS-CoV感染影响的检测将不同浓度的SP600125(1 μmol/L、2 μmol/L、5 μmol/L、10 μmol/L、15 μmol/L)对Vero E6 和IPI-2I 细胞预处理2 h,再感染SADS-CoV(MOI 0.1),作用24 h 收获细胞上清液和细胞样品,按照1.2 的方法采用western blot 和TCID50检测N 蛋白表达量和病毒滴度的变化。当SADS-CoV(MOI 0.1)感染Vero E6 细胞约24 h 并出现病变时,弃上清液,甲醇固定30 min;加入5%的脱脂乳常温封闭2 h;以SADS-CoV N蛋白MAb(1∶1 000)为一抗,以488荧光标记的羊抗鼠IgG为二抗(1∶5 000),按照1∶1 000的比例稀释DAPI 染核,最后加入1 mL 的PBS 避光保存,于倒置荧光显微镜下观察病毒的复制情况,采用IFA分析SP600125 对该病毒感染的影响。将不同浓度的SP600125(1 μmol/L、2 μmol/L、5 μmol/L、10 μmol/L、15 μmol/L)加至约60%密度的Vero E6 和IPI-2I 细胞中培养24 h,每孔加入CCK-8 溶液,作用1 h 后用酶标仪测定OD450nm值,分析SP600125 对细胞活性的影响。
1.8 数据分析采用Image J 和Graph Pad prism 8.0软件分析结果并绘制柱状图,*:P<0.05 表示差异显著,**:P<0.01 表示差异极显著。
2 结 果
2.1 GLY 对SADS-CoV 感染细胞影响的检测结果利用CCK8 进行了细胞活性试验,结果显示不同浓度(见1.2)的GLY 与DMSO 对照组相比,细胞活性无差异(图1A),表明所添加的GLY 对Vero E6 和IPI-2I 的细胞活性无明显影响。用不同浓度(见1.2)的GLY 处理Vero E6 和IPI-2I 细胞2 h,感染SADSCoV(MOI 0.1),利用western blot 检测N 蛋白表达量的变化。结果显示N 蛋白表达量呈剂量依赖性减少(图1B、图1C),表明GLY 对MOI 0.1 的SADS-CoV抑制效果显著(P<0.05)。收取上述细胞上清液进行TCID50测定,结果显示病毒滴度减少,表明GLY 抑制病毒的复制(P<0.05)(图1D)。为了进一步观察GLY 的抑制效果,利用MOI 1 和MOI 5 的SADS-CoV再次进行验证,western blot 结果显示N 蛋白表达量呈剂量依赖性减少(P<0.05,图1F、图1E),表明GLY 对MOI 1 和MOI 5 的SADS-CoV 抑制效果显著。

图1 GLY对SADS-CoV感染细胞影响的检测结果Fig.1 Antiviral effect of GLY against SADS-CoV infection
2.2 GLY对病毒在Vero E6和IPI-2I细胞侵入和复制影响的检测结果利用紫外灭活病毒检测GLY 对病毒侵入细胞的影响,western blot 结果显示,在GLY浓度为0.8 mmol/L时,N蛋白的表达量减少,表明浓度高的GLY 对病毒的侵入抑制效果显著(P<0.05,图2A、图2B)。在病毒复制的早期收获不同时间点的细胞样品检测发现N 蛋白表达量减少(P<0.05,图2C、图2D 和图2E),表明GLY有效抑制病毒的侵入及复制。
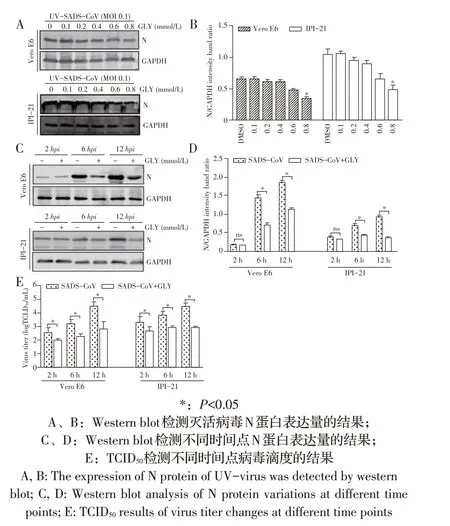
图2 GLY对病毒在Vero E6和IPI-2I细胞侵入和复制影响的检测结果Fig.2 Effects of GLY on SADS-CoV entry and replication
2.3 HMGB1 与其受体TLR4 和RAGE 的结合对SADS-CoV 感染影响的检测结果GLY 通过竞争细胞受体抑制HMGB1 发挥功能。当HMGB1 结合TLR4发挥作用时,可在Cys23和Cys45之间形成二硫键,也会影响Cys106位点。将1.4 构建的HMGB1 关键位点突变的真核表达质粒转染Vero E6 细胞后感染病毒,收获细胞上清液和细胞样品。Western blot 试验结果显示,N 蛋白的表达量比Mock 组均显著减少(P<0.05)(图3A),TCID50结果显示,病毒滴度比Mock 组均显著下降(P<0.05)(图3B),表明HMGB1 和受体的结合与病毒复制有关。HMGB1 的另一受体是RAGE,将该受体的siRNA 转染Vero E6 细胞48 h 后接种病毒,收获细胞样品和细胞上清液。Western blot 和TCID50结果分别显示,N 蛋白表达量比未处理组、Mock 组和SiScr 3 个对照组显著减少(P<0.05),且病毒滴度显著下降(P<0.05)(图3C、图3D),表明HMGB1和RAGE的结合影响了病毒的复制。
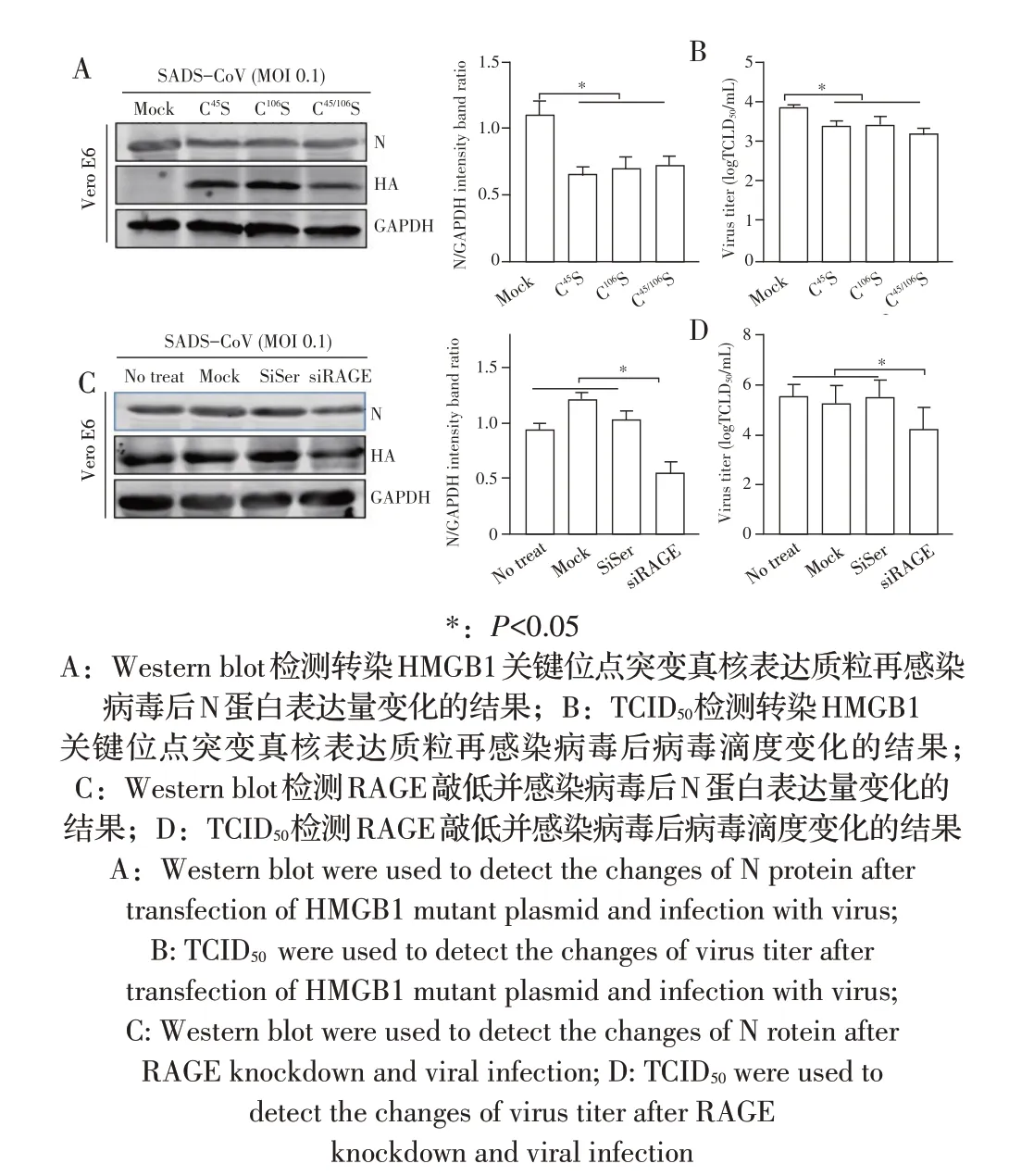
图3 HMGB1与其受体TLR4和RAGE的结合对SADS-CoV感染影响的检测结果Fig.3 Detection of the effect of binding of HMGB1 to its receptors TLR4 and RAGE on SADS-CoV infection
2.4 SADS-CoV 感染对MAPK 信号通路影响的检测结果为探究GLY 影响SADS-CoV感染的具体信号通路,首先检测SADS-CoV 感染细胞后激活的细胞信号通路,分别将SADS-CoV感染Vero E6和IPI-2I 细胞均并于不同时间点收获蛋白样品,经western blot检测MAPK信号通路的下游蛋白时发现p-p38、p-JNK、p-ERK 在病毒感染的早期和晚期均被激活(图4A 和图4B),表明MAPK 信号通路在病毒感染时被激活。
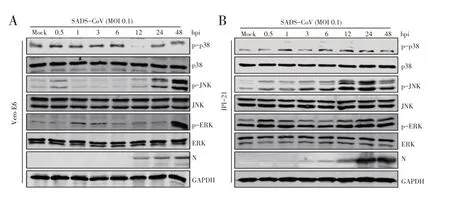
图4 病毒感染Vero E6 细胞(A)和IPI-21细胞(B)后MAPK信号通路相关蛋白表达量变化的western blot检测结果Fig.4 Western blot analysis of MAPK pathway related protein expression changes in Vero E6 cells(A)and IPI-21 cells(B)infected with virus
2.5 GLY、TAK、HMGB1 对MAPK 信号通路影响的检测结果利用不同浓度(见1.6)的GLY 和TAK 分别对Vero E6 和IPI-2I 细胞预处理2 h,然后接种SADS-CoV(MOI 0.1),24 h 后收获细胞样品。West⁃ern blot 试验结果显示,与Mock 组相比N 蛋白和磷酸化的JNK 表达量均呈剂量依赖性减少,但p38 和ERK的磷酸化无明显变化(图5A、图5E),表明GLY 和TAK 通过影响JNK 的磷酸化发挥抗病毒的作用。随后用HMGB1 中和抗体、转染HMGB1 关键位点突变的真核表达质粒以及利用siRNA 敲低HMGB1 分别对Vero E6 细胞进行处理,再接种病毒之后收获细胞样品,利用western blot 检测JNK 磷酸化的变化情况,结果显示,与Mock 组相比,p-JNK 蛋白水平均显著降低(P<0.05)(图5B、图5C、图5D)。以上结果表明,GLY、TAK 和HMGB1 在SADS-CoV 感染后通过影响MAPK信号通路下游激酶JNK的磷酸化发挥作用。
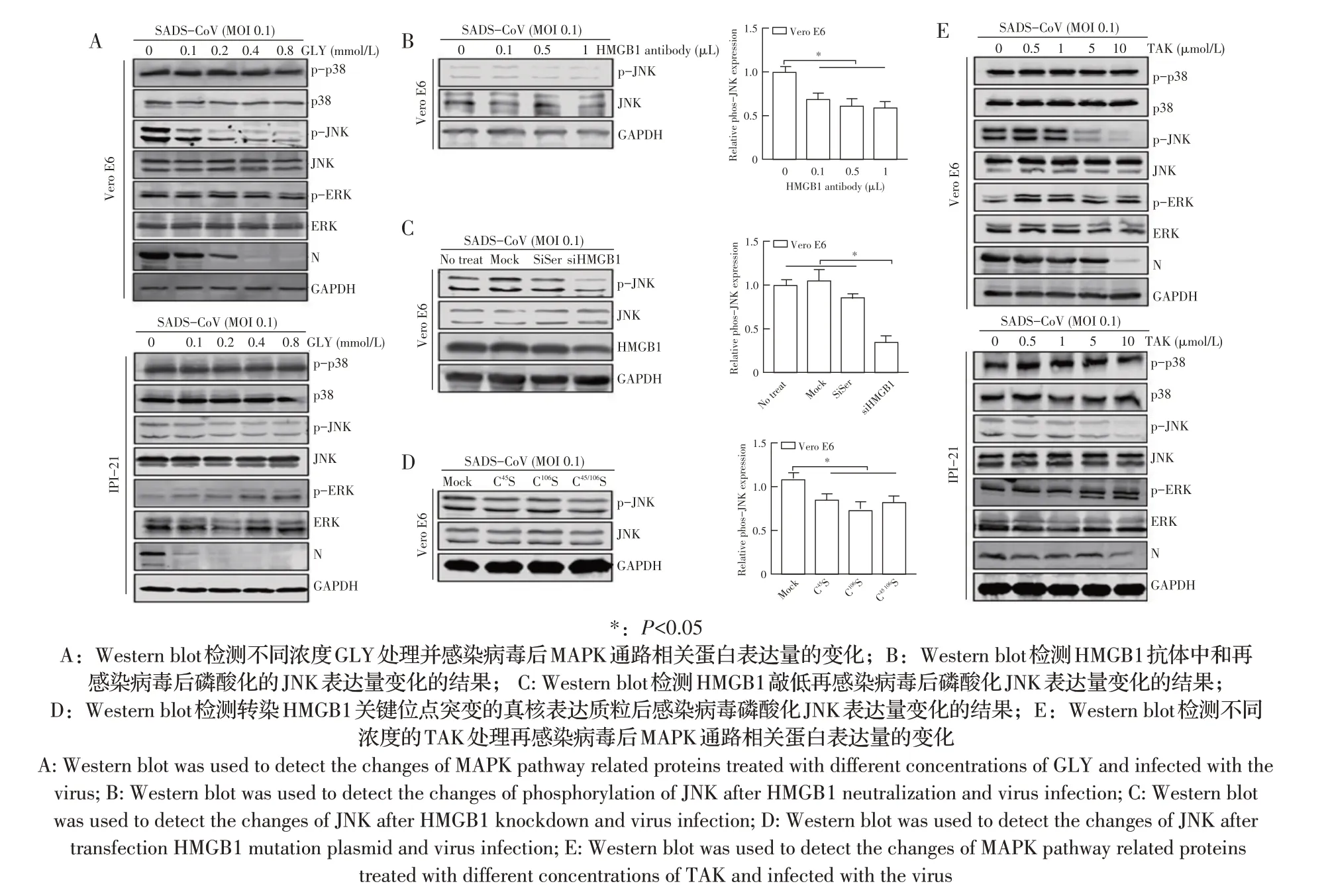
图5 GLY、TAK、HMGB1对磷酸化JNK蛋白表达量影响的结果Fig.5 Effects of GLY,TAK and HMGB1 on the expression of phosphorylated JNK protein
2.6 SP600125 对SADS-CoV 感染影响的检测结果利用JNK 的抑制剂SP600125 对Vero E6 和IPI-2I细胞预处理2 h 后,接种SADS-CoV(MOI 0.1),作用24 h后收获细胞样品,利用western blot 检测N 蛋白表达量变化,结果显示与Mock 组相比N 蛋白表达量呈剂量依赖性减少(图6A);TCID50试验结果显示病毒滴度下降,IFA 试验结果显示SP600125 能显著抑制病毒的复制(P<0.05)(图6B、图6C);CCK-8 试验结果显示不同浓度SP600125 对Vero E6 和IPI-2I 的细胞活性无影响(图6D)。综上所述,SADS-CoV 的感染能够激活JNK 信号通路并起负调控作用,也表明JNK 信号通路对于该病毒复制是至关重要的。
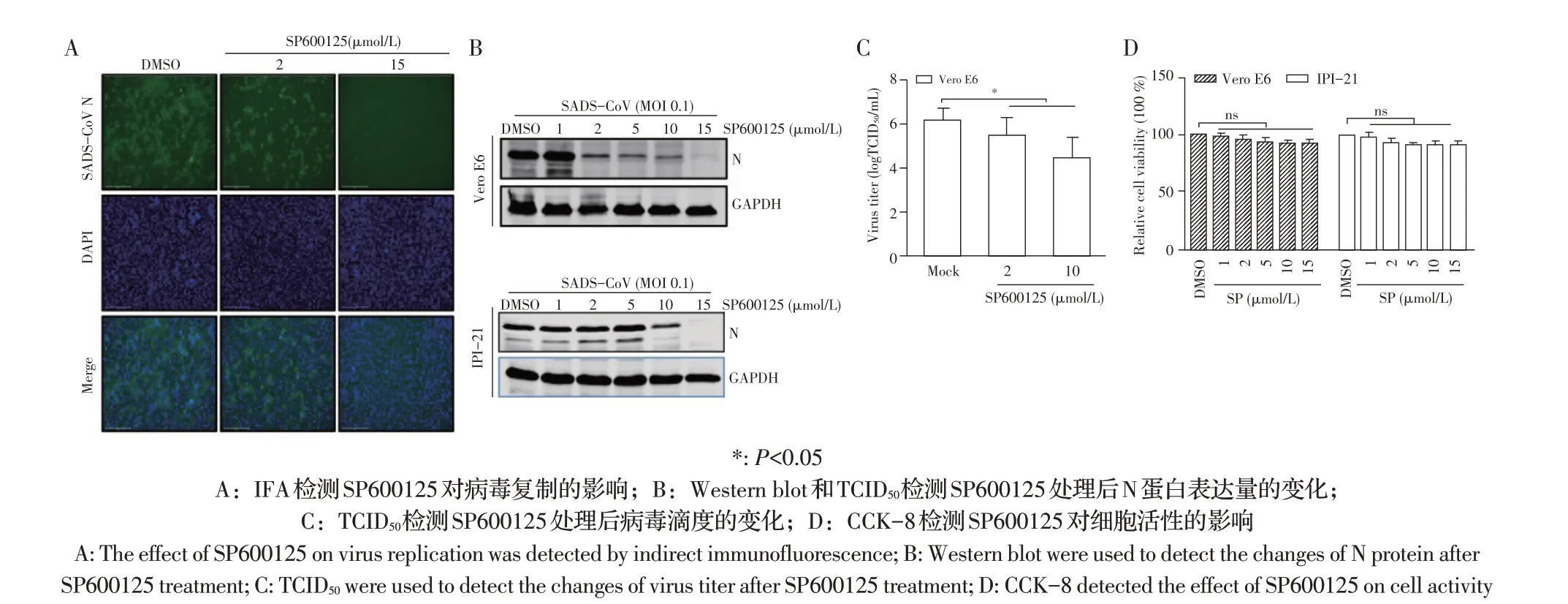
图6 SP600125对SADS-CoV感染影响的检测结果Fig.6 Antiviral effect of SP600125 against SADS-CoV infection
3 讨 论
SADS-CoV 是近几年新出现的动物冠状病毒,关于其治疗的有效方法还未见报道。基于该病毒引起仔猪高死亡率且可在多种细胞系中增殖,存在跨物种传播的潜在风险,所以对其有效药物的开发极其重要[6]。
GLY 是甘草的主要成份,具有抗病毒、抗炎和抗肿瘤等作用,通过宿主的免疫调节可有效抑制多种病毒的复制[10]。GLY 是HMGB1 的竞争性抑制剂,通过影响病毒和细胞的结合进而抑制病毒的复制。根据文献报道,GLY 能够抑制多种呼吸道病毒的复制[11-12],如对呼吸道合胞病毒,其主要阻止病毒的粘附。然而,GLY 对引起肠道感染的SADS-CoV 的作用机制尚无报道。本研究首次报道了GLY 抑制SADSCoV 在Vero E6 和IPI-2I 细胞中侵入和复制的机制。
GLY 是HMGB1 的竞争性抑制剂,而HMGB1 通过与不同受体的相互作用激活细胞内不同的信号应答,激活其先天免疫反应。TLR4 和RAGE 是已知的HMGB1 细胞因子功能受体。HMGB1 与TLR4 联合诱导细胞因子释放通过HMGB1 中C106以及C23与C45之间的二硫键发挥作用[13]。HMGB1 突变体的实验证实,HMGB1 与TLR4 的结合促进了SADS-CoV 的感染,提示HMGB1 的正确构象对SADS-CoV 的复制至关重要。本研究还通过RAGE 基因敲除试验证实RAGE参与了SADS-CoV 的感染过程。
因为病毒的生命周期最终取决于宿主细胞,所以MAPK 信号通路可在病毒感染中被激活。当病毒感染细胞时,会在不同时期引起细胞信号通路的改变,已有学者利用单细胞示踪技术对PEDV 实时示踪,解析了PEDV 早期入胞的动态过程[14]。同时,MAPK 级联反应可还参与病毒感染细胞的免疫应答和凋亡的调节[15]。MAPK 通路可作为病毒复制的正调控或负调控因子,利用外源性MAPK 通路激活因子促进自身的复制。结果表明,SADS-CoV 在Vero E6和IPI-2I细胞感染早期可激活JNK、ERK和p38 MAPK通路。
本研究进一步探究GLY对SADS-CoV 感染的作用机制。据报道,MAPK 信号通路的激活对冠状病毒至关重要。ERK途径已被证明在病毒的生物合成和促进PDCoV的复制中发挥关键作用[16]。有研究表明,PEDV感染后期激活细胞中的p38 MAPK和JNK[17]。这两种激酶是PEDV 体外有效复制所必需的。本研究结果表明,GLY 可以显著降低SADS-CoV 诱导的MAPK 通路的激活,这意味着该信号通路可能也参与了GLY的抗SADS-CoV 过程。此外,通过使用HMGB1 中和抗体、转染HMGB1 关键位点突变的真核表达质粒以及利用siRNA 技术敲低HMGB1 等方法对Vero E6 细胞预处理后接种病毒,western blot 检测发现以上处理均抑制了JNK 的磷酸化水平。实验结果表明,GLY 阻断了HMGB1与TLR4的结合,抑制了TLR4的活性。与这些发现一致的是,GLY 依赖于TLR4 的激活降低JNK 的活性。本研究使用TLR4 的竞争性抑制剂TAK 对细胞处理后western blot 的结果显示,TAK 也降低了JNK的磷酸化水平但并不影响ERK 和p38 的磷酸化,表明JNK 的激活可能在SADS-CoV 感染过程中起重要作用。本研究中JNK 抑制剂SP600125 抑制SADS-CoV感染的试验结果也再次证实了JNK 的作用。
综上所述,本研究表明细胞外HMGB1 与TLR4的相互作用导致JNK 的激活,而ERK 和p38 的激活并不会促进SADS-CoV 的感染。GLY 阻止HMGB1 与TLR4 结合,抑制SADS-CoV 体外感染,其作用主要依赖于HMGB1/TLR4/JNK 信号通路。本研究为研发抗SADS-CoV 新型药提供了理论支持。
