BRAF V600E野生型甲状腺乳头状癌303例临床病理学特征
2022-02-01刘艺璇李雪晴王丽丽林东亮谷海燕王婧楠王继纲
李 栋,刘艺璇,李雪晴,王丽丽,林东亮,谷海燕,王婧楠,王继纲
甲状腺癌是最常见的内分泌系统恶性肿瘤,我国甲状腺癌的发病率在过去几十年内始终处于上升趋势。甲状腺乳头状癌(papillary thyroid cancer, PTC)是甲状腺癌中最常见的类型,占85%~90%[1],文献报道东亚人群中BRAF V600E基因突变率远高于西方国家,在日本PTC人群中BRAF V600E基因突变率约为85%[2],在美国PTC人群中BRAF V600E基因突变率约40%[3]。一般认为BRAF V600E突变型PTC需要更加积极的治疗策略,而在临床实践中发现部分BRAF V600E野生型PTC也具有高侵袭性的生物学行为。目前,国内尚无BRAF V600E野生型PTC的大样本研究报道,有关该类型的临床病理特征以及基因学变异特点尚待进一步分析。本文收集303例BRAF V600E野生型PTC,探讨其临床病理特征、诊断、鉴别诊断,为临床和病理医师提供参考。
1 材料与方法
1.1 临床资料收集2017年1月~2021年11月青岛大学附属医院PTC手术标本9 729例,其中4 757例行BRAF V600E免疫组化检测;其中阳性者4 007例(84.2%),阴性者750例(15.8%)。甲状腺微小PTC(最大径<1 cm)的预后良好,本组排除微小癌病例。本组共纳入1 564例PTC,其中BRAF V600E阳性者1 261例(80.6%),BRAF V600E阴性者303例(19.4%)。收集BRAF V600E阴性病例的病理切片和临床资料,包括患者年龄、肿瘤大小、部位、数目、被膜侵犯(被膜下生长)、区域淋巴结转移、伴发病变等情况。随访时间1~4年,通过查阅本院病历存档系统获取术后复查影像学结果,并通过细胞病理学或组织病理学结果判断有无术后复发。PTC组织病理学分型标准根据WHO(2017)内分泌肿瘤:包括经典型、包裹型、滤泡型(完全为滤泡性的生长方式,乳头不超过1%,否则视为经典型)、柱状细胞型等多种。本实验获得青岛大学附属医院伦理委员会审批通过。
1.2 BRAF V600E免疫组化染色及结果判读免疫组化染色采用美国Ventana Medical Systems开发的VENTANA anti-BRAF V600E(克隆号VE1,针对氨基酸596-606的人工合成肽)鼠单抗,在Roche Bench mark ULTRA全自动免疫组化染色平台上进行。染色切片采用10%中性福尔马林固定、石蜡包埋的组织,脱蜡后,抗原修复(细胞调理液1)100 ℃ 64 min,过氧化物酶抑制剂5 min,一抗孵育36 ℃ 16 min,Opti View DAB IHC检测试剂盒(包括HQ Linker和HRP Multimer,Ventana Medical Systems),用苏木精Ⅱ和蓝染试剂复染组织4 min。采用染色系统推荐的阴性试剂质控小鼠单抗代替一抗评价非特异染色,阳性对照用已知的阳性PTC切片作为质控对照。BRAF V600E(VE1)的阳性染色模式为低倍镜下可见确切的肿瘤细胞胞质染色,结果由两位病理医师根据肿瘤中是否存在特异性胞质染色来评估:对肿瘤细胞内高于背景的、任何强度的明确胞质染色判定为阳性。其中,对2017年5月~2019年6月连续103例BRAF V600E阴性石蜡标本同时行ARMS-PCR检测(ADx-ARMS BRAF基因V600E突变检测试剂盒,厦门艾德生物公司),检测方法按照试剂盒说明书进行。
1.3 靶向基因二代测序采用All-in-One Cancer Panel进行测序和生物信息分析(项目编号:X101SC20051089-Z01-J001)。该方法可以检测560个与癌症及用药密切相关基因以及TERT基因的启动子突变热点区段,有效测序深度1 000×。15例BRAF V600E野生型PTC标本(同时经免疫组化及ARMS-PCR验证)进行测序,包括7例经典型、5例滤泡型、1例柱状细胞型、1例嗜酸细胞型、1例实性型。测序标本采用石蜡包埋的癌和癌旁组织(11例为淋巴结,4例为癌旁正常甲状腺组织)进行基因组DNA提取、文库构建、库检及上机测序。DNA经Covaris破碎仪随机打断成长度为180~280 bp的片段,采用Agilent Sure Select XT Custom 试剂盒进行建库和捕获,末端修复和加A尾后,在片段两端分别连接接头进行文库制备。带有特异index的文库与生物素标记的探针进行液相杂交,使用带链霉素的磁珠将捕获目标基因的目标片段,经PCR线性扩增后进行文库质检;根据有效浓度及数据产出需求进行Illumina Hi Seq PE150测序。测序结束获得原始测序序列后进行基因变异信息挖掘及分析。利用Sam tools软件检测患者正常组织中的胚系突变,筛选可能的癌症易感基因;将体细胞突变结果与数据库中的已知驱动基因进行比较,筛选已知驱动基因。
1.4 统计学分析采用SPSS 26.0软件进行统计学分析。采用χ2检验分析BRAF野生型和突变型PTC的临床病理特征差异,以P<0.05为差异有统计学意义。
2 结果
2.1 BRAF V600E野生型PTC的临床病理学特点303例BRAF V600E野生型PTC中,男性67例,女性236例,男女比为1 ∶3.5,年龄11~70岁,平均42岁,中位年龄43岁(图1);病灶最大径1~7.5 cm,平均1.8 cm,198例有被膜侵犯(或发生于被膜下)(65.3%),207例有区域淋巴结转移(68.3%),120例伴桥本甲状腺炎(39.6%),80例为多发病灶(26.4%)。在1 261例BRAF V600E突变型PTC中,男性298例,女性963例(男女比为1 ∶3.2),年龄17~77岁,平均44岁(中位年龄43岁),病灶最大径1~8 cm,平均1.58 cm,900例有被膜侵犯或位于被膜下(71.4%),717例有区域淋巴结转移(56.9%),221例伴有桥本甲状腺炎(17.5%),411例病灶多发(32.6%)。随访BRAF V600E野生型PTC患者134例,其中3例复发(出现区域淋巴结转移,均未进行二代测序)。随访BRAF V600E突变型PTC患者146例,其中6例复发(出现区域淋巴结转移)。

图1 303例BRAF V600E野生型甲状腺乳头状癌的年龄及性别分布
经统计学分析显示:与BRAF V600E突变型PTC相比,BRAF V600E野生型PTC更常伴发桥本甲状腺炎,区域淋巴结转移率更高,差异有统计学意义(表1)。
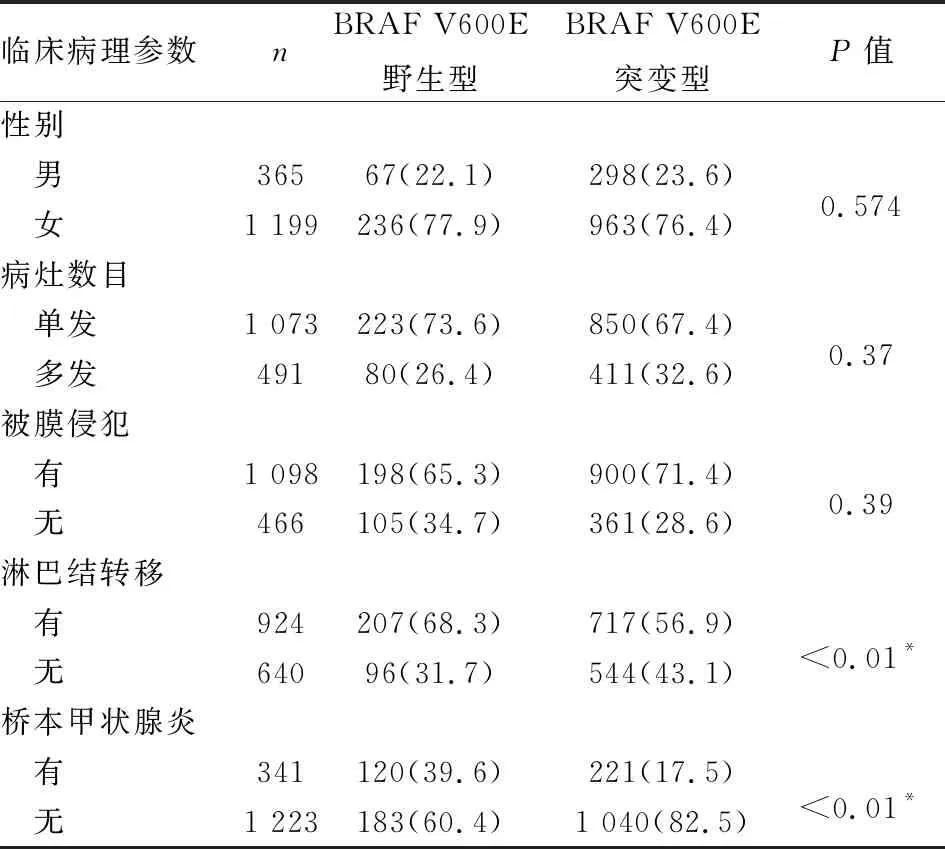
表1 BRAF V600E突变型与野生型甲状腺乳头状癌临床病理特征对比分析[n(%)]
2.2 BRAF V600E野生型PTC的病理学亚型103例BRAF V600E免疫组化阴性PTC的ARMS-PCR检测结果均为野生型,采用免疫组化和ARMS-PCR两种方法的检测结果完全一致。BRAF V600E野生型PTC组织学类型:大部分为经典型(79例),其他类型包括滤泡型21例、柱状细胞型1例、嗜酸细胞型1例、实性型1例(图2~6)。
2.3 BRAF V600E野生型PTC的基因变异15例BRAF V600E野生型PTC中共筛选出30个肿瘤易感基因突变(图7);此外,在4例样本中检出9个癌症驱动基因外显子区域的突变(表2),其中1例滤泡型PTC出现NIN无义突变,1例经典型PTC出现CHIC2、KAT6B、AXIN1错义突变和PHF6同义突变,1例经典型PTC出现LPHN3错义突变和DOCK8移码突变,1例经典型出现IKZF1和NLRP1同义突变。本组15例均未检测到RAS基因及TERT启动子突变。

②③④⑤⑥图2 经典型甲状腺乳头状癌:以乳头状结构为主,核为磨玻璃样,常见核沟和核内假包涵体 图3 滤泡型甲状腺乳头状癌:完全或几乎完全由滤泡构成,核磨玻璃样,可有核沟和核内假包涵体 图4 柱状细胞型甲状腺乳头状癌:乳头被覆假复层柱状上皮,缺乏典型的乳头状癌样核特征 图5 嗜酸细胞型甲状腺乳头状癌:嗜酸性滤泡上皮细胞,核具有典型的乳头状癌样特

表2 15例BRAF V600E野生型甲状腺乳头状癌标本的二代测序结果*
3 讨论
BRAF V600E突变是PTC中常见的突变之一,既往研究认为BRAF V600E状态与PTC临床生物学行为和预后相关,BRAF V600E突变是PTC预后不良的独立影响因素[4]。近年研究发现,BRAF V600E突变状态与PTC患者临床预后无相关性:BRAF V600E突变与PTC组织学亚型有关,与其他临床病理特征未见相关性,不能作为PTC的独立预后因子[5-6]。研究结果不同的原因可能是存在BRAF以外的其他因素,如重要的未知的驱动基因变异;其次不同人群中BRAF突变率存在显著差异,如既往与预后相关的报道中BRAF突变率分别为48.5%、37.3%、45.7%[3-4,7],而无预后相关的报道中BRAF突变率较高,分别为86.5%、65%、56%[5-6,8]。本组BRAF突变率为80.4%,也远高于西方人群的报道。
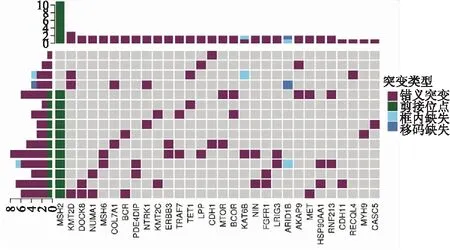
图7 15例BRAF V600E野生型甲状腺乳头状癌的癌症易感基因
本组发现,相对于BRAF V600E突变型PTC,BRAF野生型PTC更常伴发桥本甲状腺炎;在BRAF V600E突变型PTC中桥本甲状腺炎的检出率为17.5%,而BRAF V600E野生型PTC中的检出率为39.6%。目前,大部分研究认为合并桥本甲状腺炎的PTC中BRAF V600E阳性率低[9-10],与本实验结果基本一致。有研究表明,桥本甲状腺炎可通过调控肿瘤特异性免疫反应来降低肿瘤的侵袭风险,抑制PTC的进展,是PTC的保护性因素[11]。然而,桥本甲状腺炎中的滤泡上皮经常发生萎缩后不典型增生,在此基础上可能更易发展为PTC,多为BRAF V600E野生型。
本组BRAF V600E突变型与野生型PTC的淋巴结转移差异有显著性,BRAF V600E突变型PTC的淋巴结转移率是56.9%,而BRAF V600E野生型为68.3%,提示BRAF V600E野生型PTC同样具有较强的侵袭转移能力。既往大多数研究认为BRAF V600E突变型PTC的淋巴结转移率更高[12],更易发生被膜侵犯[13-14]。不同研究结果的差异可能因其他重要的驱动基因或分子生物学指标在不同人群中的分布差异,仅凭BRAF V600E指标可能难以评估真实的生物学行为。本组BRAF V600E突变型PTC被膜侵犯的比例高于野生型病例(71.4%vs65.3%),但这并不能说明BRAF V600E是PTC发生被膜侵犯的危险因素,也不能说明BRAF V600E突变型具有较强的侵袭性,因为部分PTC好发于甲状腺被膜下,且被膜侵犯的病理学诊断标准病理医师的主观性较强,作者认为以被膜外软组织的侵犯转移作为局部浸润侵袭性的指标可能更具代表性。此外,Yan等[15]在研究PTC临床病理特征时发现,BRAF V600E突变与肿瘤多灶性相关,这与本组结果一致,与BRAF V600E野生型PTC相比,BRAF V600E突变型PTC更易发生多个病灶,并且多发于双侧甲状腺。本组中复发病例数较少(仅有9例),且随访时间均未超过5年,仍不能根据区域淋巴结转移或被膜侵犯情况来判断预后,还需进行更长时间的随访来研究BRAF V600E野生型PTC的远期结局。
文献报道男性PTC患者的BRAF V600E基因突变率高于女性,提示男性患者预后比女性差[12];而Basolo等[16]和本实验结果均未显示不同性别组中的BRAF V600E基因突变存在显著差异,本组男性患者肿瘤BRAF V600E突变率高于女性。未来可进一步研究来验证性别应用于PTC患者危险分层和管理时,是否应该区分BRAF V600E基因突变状态。
本组发现BRAF V600E野生型PTC中约80%病例的组织学亚型为经典型,约20%病例为滤泡型。虽然本组并未对BRAF V600E突变型PTC的组织学亚型进行分类,但既往报道滤泡型PTC中BRAF多为野生型[17],BRAF野生型PTC中滤泡型的比例相对较高。既往研究发现不同基因变异可能与组织学类型和生物学行为密切相关[18]:BRAF突变PTC常为经典型;RAS突变PTC多表现为滤泡型;RET/PTC1重排常发生在年轻散发的PTC患者,预后相对较好;RET/PTC3重排好发于射线暴露PTC且多为实体型;ETV6-NTRK3重排也与射线暴露相关,且具有较强的侵袭性;TERT启动子突变好发于老年男性患者。多项大样本的高通量测序研究均提示:BRAF和RAS突变是PTC中较为常见的基因突变,但相对于欧美国家,中国人群BRAF突变发生率高,RAS突变率低[19-20]。本组15例BRAF V600E野生型PTC中均未检测到RAS突变,亦提示我国人群RAS突变发生率较低。进一步文献检索发现,本组病例检出的9种体细胞基因突变在既往PTC测序研究中罕见报道,进一步扩大样本量进行验证,明确这几种基因突变的临床病理意义有助于对BRAF V600E野生型PTC进一步分型。
综上,与文献报道BRAF V600E突变可作为PTC独立的预后危险因素不同,本组发现BRAF V600E野生型PTC更易合并桥本甲状腺炎和淋巴结转移,提示应对BRAF V600E野生型PTC进行进一步的危险度分层,寻找预后相关影响因素。进一步明确BRAF V600E突变对PTC的影响及其对PTC患者预后的影响,寻找其他有价值的分子生物学指标,对这类疾病的精准筛查、风险监测及个体化治疗具有重要作用。
