菌株接种比例和碳源对大豆皮发酵的影响
2022-01-27丁立人李英英刘淇朱崇淼杭苏琴
丁立人,李英英,刘淇,朱崇淼,杭苏琴*
(1. 南京农业大学动物科学类国家级实验动物中心,江苏 南京 210095;2. 南京农业大学动物消化道营养国际联合研究中心,江苏 南京 210095;3. 南京致润生物科技有限公司,江苏 南京 211200)
大豆皮是大豆加工过程中的副产物,预计至2030年全球产量可达2 970~3 710万t[1],我国每年大豆皮的产量约1 200多万t[2]。大豆皮因产量高,纤维含量高(32%~38%),含有10%左右的粗蛋白,且价格低廉成为畜禽潜在的饲料资源[2]。但大豆皮过高的纤维水平又限制了在畜禽饲料中的推广和应用,尤其是在单胃动物饲料上应用的潜力。目前,提高饲料营养价值、降低饲料抗营养成分的常见处理方法有物理法、化学法,酶制剂处理法和微生物发酵法[3-4],其中微生物发酵因其操作简单,安全环保,并且微生物可代谢产生有益物质而广泛应用在饲料生产中。
微生物发酵指利用特定的微生物,在适宜的条件下,将原料经过特定的代谢途径转化为动物机体所需要产物的过程,其发酵水平与菌种本身的遗传特性和培养条件十分有关[5]。常用于发酵的菌种有细菌,如乳酸菌和芽孢杆菌,真菌如酵母菌和霉菌[6]。乳酸菌发酵可通过产生乳酸降低pH值,抑制病原菌生长,延长饲料保质期[7];芽孢杆菌发酵主要是分泌酶的能力较强,可分泌纤维素酶等降解纤维素和半纤维素[8];酵母菌是天然的发酵剂,能改变原料风味,还可将纤维类物质转化为菌体蛋白[9]。并且在微生物发酵时适当补充碳、氮源,可显著促进菌株生长,提高发酵效果[10-11]。目前,发酵大豆皮的研究还较少,如适合发酵的菌种(株)、单菌或复合菌发酵、发酵菌株的接种比例、以及辅料添加等都还尚不清楚。
因此本试验利用实验室前期筛选的菌株,研究各纯菌株以大豆皮为唯一碳源的生长特性,以及各菌株复合比例和不同碳源(麸皮、玉米粉)对大豆皮发酵的影响,以期提高大豆皮的营养价值,改善其品质,为提高大豆皮的利用率提供数据支撑。
1 材料与方法
1.1 试验原料
大豆皮、麸皮、玉米粉均由江苏省南通市青禾杂粮合作社提供,粉碎后过40目备用。
1.2 试验菌株的解冻及活化
将实验室前期-20 ℃保存的植物乳杆菌LY19(LactobacillusplantarumLY19)、纳豆芽孢杆菌ND1(BacillusnattoND1)和酿酒酵母菌NJ(SaccharomycescerevisiaeNJ)解冻,分别按1%接种量接种于MRS、LB和YPD培养基中(均购自青岛海博生物有限公司),37 ℃培养24 h,再按照同样方式进行二次活化,获得植物乳杆菌LY19、纳豆芽孢杆菌ND1和酿酒酵母NJ的种子液用于后续试验,菌株活菌数为108~109CFU/mL。
1.3 各试验菌株以大豆皮为唯一碳源进行发酵
将 10 g 大豆皮、20 mL水加入发酵瓶中混匀、灭菌,将上述活化的3种菌株的菌液分别以1%接种至大豆皮和各菌株培养基中,最终大豆皮与水的比例为1∶2,37 ℃培养48 h,试验组为各纯菌株+大豆皮,对照组为各纯菌株+特异培养基,每组3个重复,发酵结束后分析发酵底物的产气量、pH值、乳酸浓度和各菌株的活菌数。
1.4 3株试验菌株以不同接种比例发酵大豆皮
试验分为5组,对照组为无菌水(20 mL)+大豆皮,试验Ⅰ组为植物乳杆菌LY19∶纳豆芽孢杆菌ND1∶酿酒酵母菌NJ=1∶1∶1,试验Ⅱ组为植物乳杆菌LY19∶纳豆芽孢杆菌ND1∶酿酒酵母菌NJ=1∶10∶1,试验Ⅲ组为植物乳杆菌LY19∶纳豆芽孢杆菌ND1∶酿酒酵母菌NJ=1∶1∶10,试验Ⅳ组为植物乳杆菌LY19∶纳豆芽孢杆菌ND1∶酿酒酵母菌NJ=1∶10∶10,每组4个重复。将 10 g 大豆皮、19.7 mL的无菌水加入发酵瓶中混匀、灭菌,将上述活化的3株菌液,根据试验分组中各菌株的数量比例接种至大豆皮中,接种菌液量0.3 mL,最终大豆皮与水的比例为1∶2,37 ℃培养48 h,结束后分析发酵底物中各菌株的活菌数,大豆皮残渣的蛋白及纤维等成分,筛选合适的菌株复合比例用于后续试验。
1.5 3株试验菌株以不同碳源为辅料发酵大豆皮
试验分为5 组,对照组为无菌水(20 mL)+大豆皮,试验Ⅰ组为1.4中筛选的合适比例的3株复合菌(M)+大豆皮+10%麸皮,试验Ⅱ组为M+大豆皮+10%玉米粉,试验Ⅲ组为M+大豆皮+5%麸皮+5%玉米粉,试验Ⅳ组为M+大豆皮+2%葡萄糖(阳性对照),每组4个重复。将 10 g大豆皮和适量水加入发酵瓶中,再根据以上分组分别添加适当比例的麸皮和玉米粉,加19.7 mL的无菌水混匀,进行灭菌,然后将3株菌按上述筛选的合适比例混合后再按3%的量接种至大豆皮中,最终大豆皮与水的比例为1∶2,37 ℃培养48 h,发酵结束后分析发酵底物的pH值、乳酸浓度和各菌株的活菌数,大豆皮残渣的蛋白及纤维物质等成分,筛选出适于复合菌发酵大豆皮的碳源。
1.6 测定指标及方法
发酵结束后,直接用pH值测定仪测定发酵液的pH值,活菌数用稀释涂布平板法检测;发酵液的乳酸含量严格按照乳酸试剂盒(南京建成:A019-2-1)测定,大豆皮残渣的粗蛋白含量用凯氏定氮法测定,中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)含量用滤袋法测定[12]。
1.7 统计分析
数据以“平均值±标准差”表示,采用SPSS 22.0统计软件进行单因素(One-way ANOVA)模型分析,Tukey’s-b法进行显著性检验,P<0.05表示差异显著。
2 结果与分析
2.1 各菌株以大豆皮为唯一碳源的生长特性
从图1可以看出,植物乳杆菌LY19以大豆皮为唯一碳源生长时,虽然48 h 产气量只有2.33 mL,但乳酸浓度达到74.49 mmol/L,显著高于纳豆芽孢杆菌ND1和酿酒酵母菌NJ(P<0.05);植物乳杆菌LY19组的pH值为5.73,显著低于酿酒酵母菌NJ和对照组(P<0.05),说明植物乳杆菌LY19以大豆皮为培养基时,可进行生长并产酸。
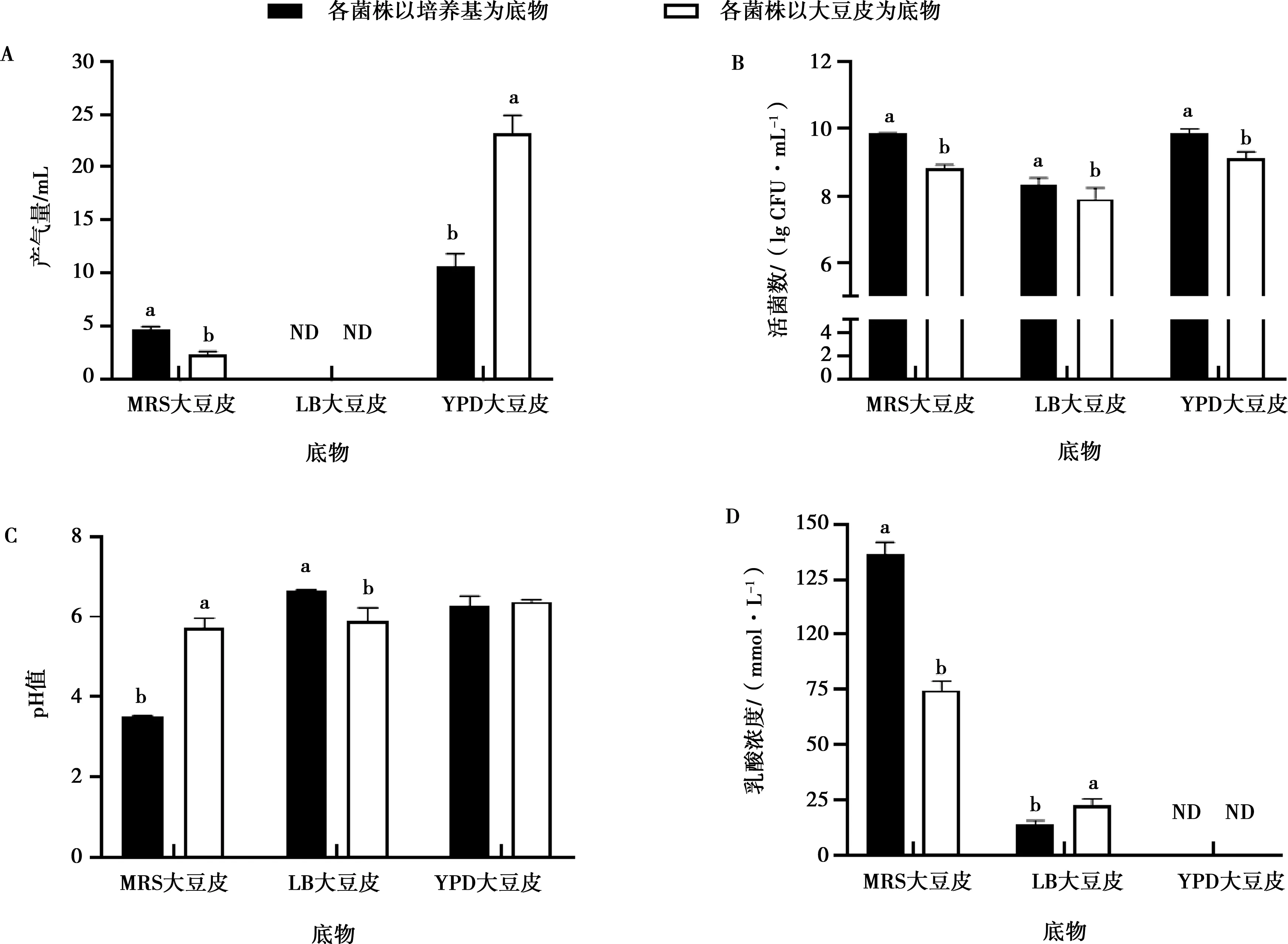
A.产气量;B. 活菌数;C. pH值;D. 乳酸浓度;ND表示未能检测出结果;柱上方字母不同表示差异显著(P<0.05)图1 各菌株以大豆皮为唯一碳源的生长特性
纳豆芽孢杆菌ND1以大豆皮为唯一碳源生长时,全程几乎不产气,48 h 乳酸浓度只有13.65 mmol/L,pH值为5.91,活菌数为7.91 lg CFU/g,与对照组相比虽有一定差异(P<0.05),但仍表明纳豆芽孢杆菌ND1不能以大豆皮为唯一碳源很好地生长。酿酒酵母菌NJ以大豆皮为唯一碳源生长时,产气量是3株菌中最高的,说明酵母菌可在大豆皮中生长发酵,但酿酒酵母在生长发酵过程中并产生乳酸,因此底物大豆皮的pH值无变化。
2.2 接种比例对菌株生长和大豆皮主要成分的影响
表1看出,当3种菌接种比例为1∶1∶10时,活菌数显著高于其他各组(P<0.05),中性洗涤纤维、酸性洗涤纤维含量显著低于对照组(P<0.05),粗蛋白含量与其他组之间无显著差异,但高于对照组,表明3株菌的接种比例为1∶1∶10发酵对大豆皮的营养价值产生了积极影响,综合考虑各指标,选择1∶1∶10比例进行后续试验。
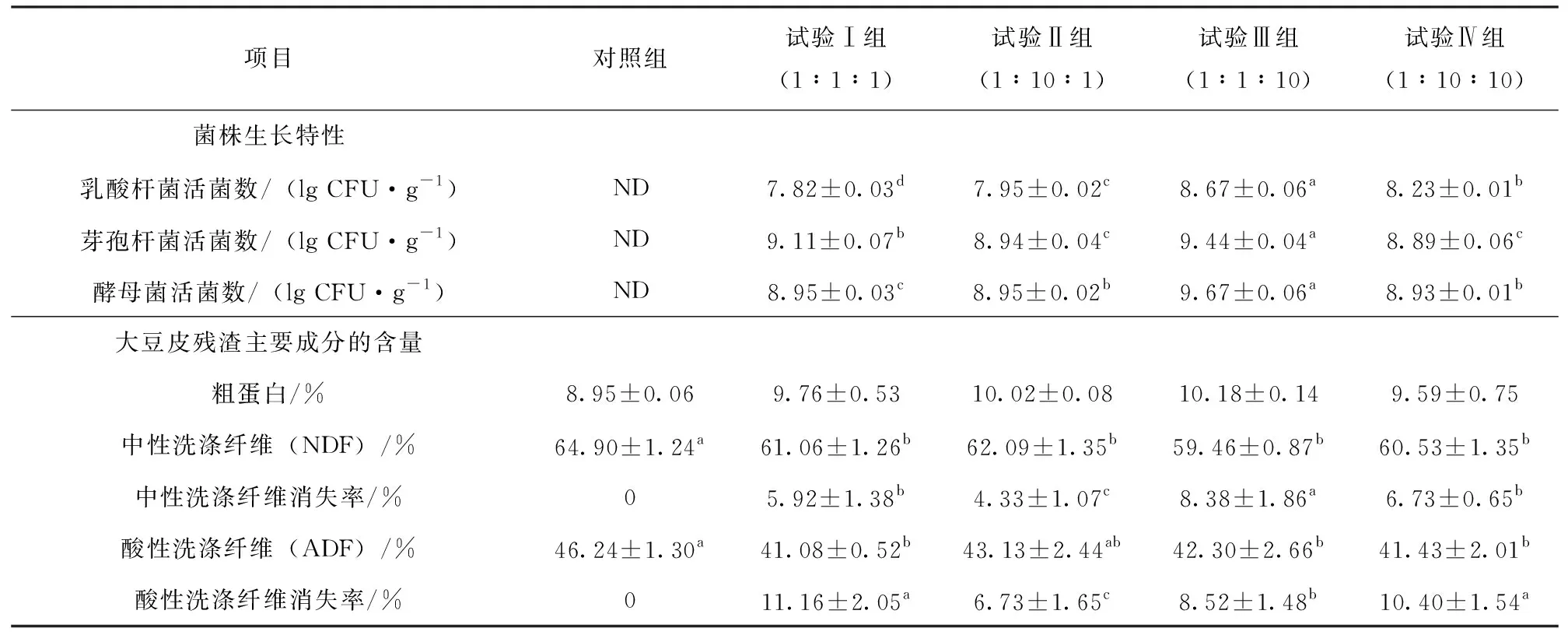
表1 接种比例对菌株生长和大豆皮主要成分的影响
2.3 菌株以不同碳源为辅料对大豆皮发酵的影响
表2可以看出,葡萄糖是各菌株生长时最容易利用的单糖,因此以该组为阳性对照组,评价麸皮、玉米粉为辅料时混合菌对大豆皮发酵的影响。各试验组产气量、乳酸浓度均显著低于葡萄糖组(P<0.05),乳酸杆菌活菌数各组间差异不显著(P>0.05);麸皮组的芽孢杆菌和酵母菌活菌数显著高于玉米粉组和麸皮、玉米粉混合组(P<0.05),与葡萄糖组差异不显著(P>0.05);麸皮组的中性洗涤纤维含量显著低于对照组(P<0.05),与葡萄糖组、玉米粉组差异不显著(P>0.05),但高于麸皮、玉米粉混合组(P<0.05);麸皮组的酸性洗涤纤维含量显著低于对照组(P<0.05),但与其他组差异不显著(P>0.05);麸皮组粗蛋白显著高于对照组,低于其他组(P<0.05),但玉米粉组和麸皮、玉米粉组发酵后出现了结块现象,发酵过程中底物出现结块易导致杂菌的生成。综合考虑各指标,10%麸皮更适合作为碳源用于复合菌发酵大豆皮。
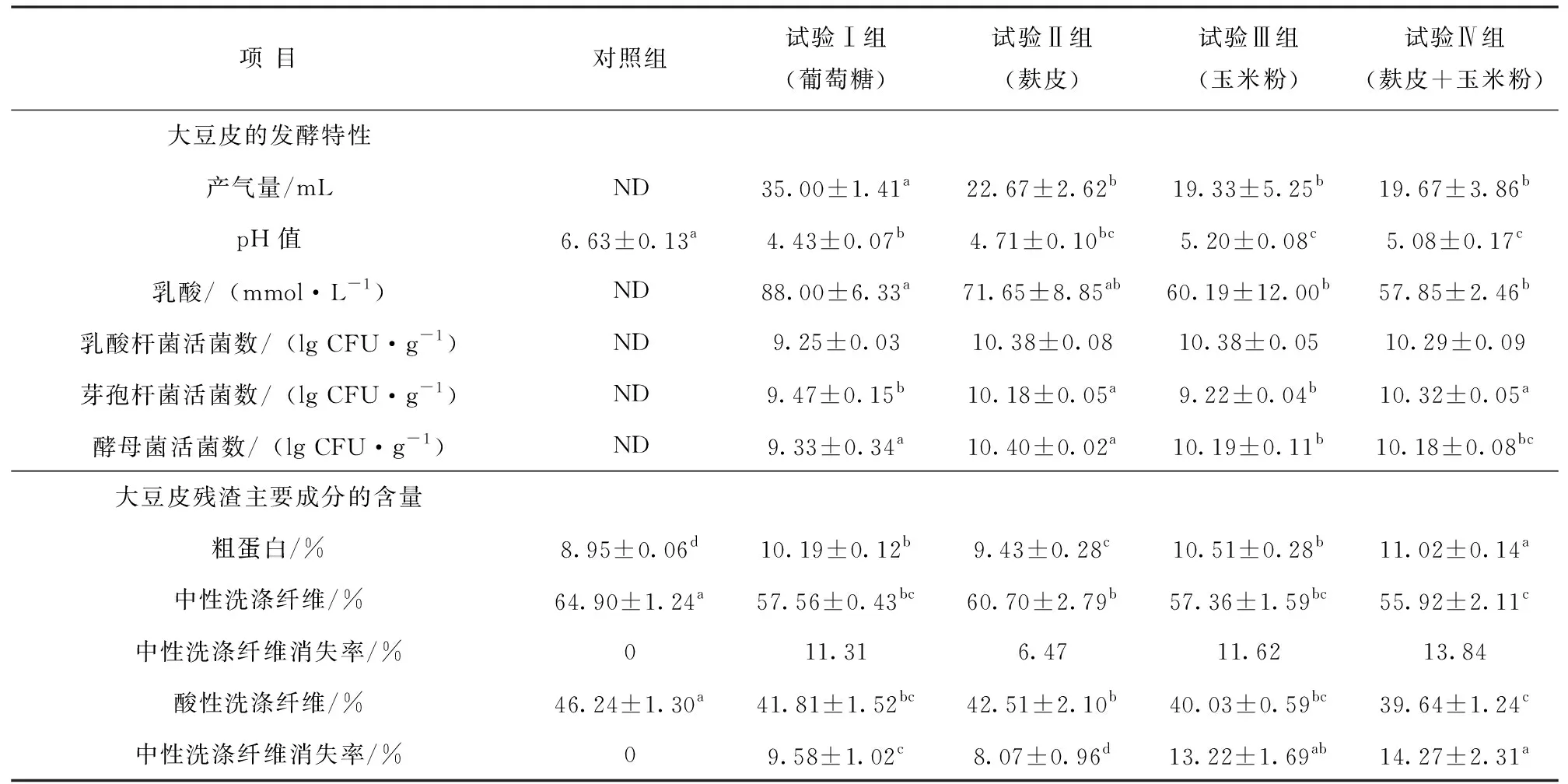
表2 菌株以不同碳源为辅料对大豆皮发酵的影响
3 讨论
3.1 各菌株以大豆皮为唯一碳源的生长特性
发酵饲料的品质好坏与微生物种类、自身特点和发酵条件密不可分。本试验所选用3株菌是前期实验室筛选其各自特异培养基上的生长性能获得。乳酸杆菌生长良好的表现就是乳酸产量和活菌数。饲料被微生物发酵的直观表现是产气,本研究所用植物乳杆菌LY19以大豆皮为碳源生长时产气量仅有2.33 mL,产生的乳酸浓度只有74 mmol/L,其浓度仅为MRS培养基的一半,说明植物乳杆菌LY19在大豆皮中的生长不如在培养基中的生长,其原因可能是大豆皮中菌株生长所需要的营养物质较少;芽孢杆菌因分泌酶类和抗菌物质而受关注,发酵大豆皮时所需芽孢杆菌有较好的分泌纤维素酶的能力,本试验所用纳豆芽孢杆菌ND1产生的纤维素酶活达24.51 FPU/mL[13],当纳豆芽孢杆菌ND1以大豆皮为培养基培养时,产气量更低,无法检测出来,这可说明纳豆芽孢杆菌ND1不能很好利用大豆皮产生纤维素酶;酿酒酵母菌NJ以大豆皮为碳源生长时,产气量为23 mL显著高于其特异培养基。以上结果说明,这3株纯菌株不能以大豆皮为碳源良好地生长,但植物乳杆菌LY19在3株菌中相对生长较好。大豆皮主要由40%~45%的纤维素,30%~35%木聚糖,9%~12%蛋白质和1%~4%木质素组成[14],本试验3株菌的碳源主要是糖类,这可能是3株菌不能以大豆皮为碳源生长良好的主要原因。
3.2 菌株不同接种比例对大豆皮发酵的影响
菌株接种比例,即发酵体系中各类有效活菌数,也是影响发酵效果的重要因素之一,菌种接种比例过低或过高都会影响底物中营养物质的消耗,最终影响发酵饲料的质量[15]。本试验用植物乳杆菌LY19、纳豆芽孢杆菌ND1和酿酒酵母菌NJ单一菌株发酵大豆皮时,各菌株在大豆皮中的生长性能较差,因此,不能用单一菌来发酵大豆皮。复合菌株之间可能存在共生协同关系,能帮助微生物更好地适应复杂的环境系统[16]。还有研究报道,在以乳酸菌等细菌为发酵菌株时,发酵体系中初始活菌数在1×108~1×109CFU/g时,发酵效果最好[17-18]。所以本试验3株菌发酵初始活菌数均为1×108CFU/g,最终以植物乳杆菌LY19∶纳豆芽孢杆菌ND1∶酿酒酵母菌NJ接种比例为1∶1∶10发酵效果最好,这可能与3株菌的之间存在协同作用有关,纳豆芽孢杆菌ND1和酿酒酵母菌NJ发酵时消耗大量氧气[19],可以为植物乳杆菌 LY19生长创造厌氧环境,纳豆芽孢杆菌ND1生长过程中还能产生纤维素酶降解大豆皮中的纤维生成单糖[20],而酿酒酵母菌NJ则可以利用芽孢杆菌产生的单糖进行生长,产生菌体蛋白,从而提高大豆皮中蛋白含量[21]。有研究表明,用乳酸杆菌、枯草芽孢杆菌和酿酒酵母菌复合发酵豆粕,发现可以去除豆粕中的蛋白酶抑制剂等抗营养因子,从而提高豆粕的饲用价值[22]。因此,合适比例的3株菌复合能一定程度地促进大豆皮的发酵。
3.3 不同碳源为辅料对大豆皮发酵的影响
麸皮和玉米粉常被用作饲料生物发酵时的补充碳源,麸皮富含20%可溶性纤维,可为微生物的生长提供养分,还可减少底物的成团现象,增加发酵基质的透气性,从而有利于微生物生长[23]。玉米粉含有70%的淀粉,发酵大豆皮时添加适量的麸皮或玉米粉,可适当弥补可消化糖类的不足,有利于发酵[24]。童鑫等[25]用酿酒酵母和嗜酸乳杆菌发酵枣渣时加入碳源、氮源和无机盐,显著地提高了枣渣的蛋白水平。本试验中,添加10%的麸皮显著促进了3株菌的生长,活菌数、乳酸产量在所有试验组中最高,pH值最低;同时,大豆皮的粗蛋白提高了19.98%,中性洗涤纤维和酸性洗涤纤维分别降低了11.43%和14.17%,虽然麸皮、玉米粉组的粗蛋白提高,但其发酵过后的底物过黏,形成结块,不利于微生物的发酵,容易滋生其他杂菌,这可能与玉米粉淀粉含量过高,发酵过程淀粉遇水凝结成块年在一起[23],从而影响了发酵基质的疏松性和通气性有关。此外,玉米粉过高的淀粉含量易使微生物生长的碳氮比不平衡,直接影响菌体的生长和代谢,当碳氮比偏小,会导致菌体生长过剩,易造成菌体提前衰老自溶;碳氮比过大,菌体繁殖数量少,发酵活菌数密度低[26-27]。因此,10%的麸皮作为大豆皮发酵的辅料可使微生物能在大豆皮中较好的生长,并且提高了大豆皮的粗蛋白含量,降低了中性洗涤纤维和酸性洗涤纤维的含量,使大豆皮的营养价值得到了提升。
4 结论
植物乳杆菌LY19、纳豆芽孢杆菌ND1和酿酒酵母菌NJ纯菌株发酵大豆皮时,各菌株生长较差,当3株菌以1∶1∶10接种比例、10%麸皮作为大豆皮发酵的辅料粗蛋白提高了19.98%,中性洗涤纤维和酸性洗涤纤维分别降低了11.43%和14.17%,使大豆皮的营养价值得到一定改善,可使大豆皮作为饲料添加到畜禽日粮中。
