猪树突状细胞表面分子CD103的表达及其抗血清的制备
2022-01-27张韬付钰广李宝玉王金泉刘光亮1
张韬,付钰广,李宝玉,王金泉,刘光亮1,*
(1. 新疆农业大学动物医学学院,新疆 乌鲁木齐 830052;2. 中国农业科学院兰州兽医研究所/家畜疫病病原生物学国家重点实验室,甘肃 兰州 730046)
树突状细胞(dendritic cells, DCs)是机体免疫反应中主要的抗原递呈细胞,其在启动、调节及维持免疫过程中有起着重要的作用[1-2]。DCs是一类特殊的抗原递呈细胞群体,它们在体内不同位置及不同时间向免疫中枢递呈抗原的方式也有所不同,不仅可以调节T细胞以及B细胞,也可以依赖抗原启动二次免疫反应[2-3]。DCs除了可以启动抗原特异性免疫,还可以调节免疫稳态[4-5]。DCs表面的分子对其功能划分提供了重要依据,如CD103+DCs在免疫反应过程中主要调节自身与外源抗原的交叉呈递、诱导肠道中效应T细胞归巢以及诱导CD4+CD25+FoxP3+调节性T细胞的产生,而CD103-DCs在先天免疫过程中主要扮演抗原清除以及介导白细胞吸附的角色[6-7]。在机体内只有少量的DCs可以直接与外界接触并捕获抗原,多数DCs主要存在上皮细胞下层,在血液中也存在未成熟的DCs[8-9]。当遇到抗原时DCs被活化,相关DCs细胞会迁移到淋巴组织中激活B细胞以及T细胞,从而达到调控免疫反应的作用[10-11]。
CD103+DCs是机体黏膜组织系统中的一类DCs亚群,其功能主要是可捕获入侵黏膜系统的病原体并迁移至机体黏膜免疫系统的相关淋巴组织,通过分泌的细胞因子和抗原共同激活T细胞,活化的T细胞经信号传导启动B淋巴细胞的应答,最终产生抗原特异性的分泌型IgA抗体,对黏膜系统的稳态和抵抗病原的入侵发挥着重要的作用[12-13]。CD103+DCs还可以诱导初始T细胞转化为调节性T细胞,参与黏膜组织的炎症反应及稳态机制建立[14]。目前黏膜免疫应答研究主要集中在人和小鼠,由于种属及组织结构分布等差异使得已有的黏膜应答知识在猪机体不一定适用[15-16]。所以制备猪源DCs表面分子CD103的抗体对近一步研究猪机体的黏膜免疫反应具重要意义。
鉴于CD103+DCs在黏膜免疫应答中发挥着至关重要的作用,本研究为了深入研究猪机体的黏膜免疫应答,利用原核表达系统表达制备了抗猪CD103+DCs表面分子CD103蛋白的多克隆抗体,并对其功能进行了验证。
1 材料与方法
1.1 主要试验材料
原核表达载体pET-30a(+)、真核表达载体pcDNA3.1购自Thermo Fisher,大肠杆菌感受态细胞DH5α、BL21(DE3)购自全式金生物有限公司,DNA Marker、protein Marker以及限制性内切酶EcoRⅠ、XhoⅠ、BamHⅠ和T4 DNA连接酶购自Thermo Fisher公司,质粒提取试剂盒及胶回收试剂盒购自OMEGA公司,IPTG购自SIGMA公司,HRP标记的羊抗鼠IgG抗体购自中杉金桥生物技术有限公司。
1.2 重组CD103蛋白原核表达载体的构建
用TRIzol法提取猪呼吸道淋巴结(MLN)组织的RNA并将其反转录为cDNA,以反转录的cDNA为PCR扩增模板,据NCBI基因库公布的猪CD103基因序列(XM_021067683.1)设计特异性引物,因CD103分子蛋白分子量较大,导致后期在原核表达过程中表达困难,本研究分2段扩增了CD103分子基因,分别为CD103分子基因的1~1 494 bp和1 435~2 931 bp。其引物分别为CD1031-1 494-F:5′-CGGAATTCATGGGTGCTCCC TACGTGCTC-3′;(酶切位点为EcoRⅠ);CD1031-1 494-R:5′-CCCTCGAGTTACGGAGCTGC CACCAGCAAGAG-3′(酶切位点为XhoⅠ);CD1031 435-2 931-F:5′-CGGAATTCATGGA CCTCTTGCTGGTGGCAGCT-3′(酶切位点为EcoRⅠ);CD1031 435-2 931-R:5′-CCCTCGAGTTAGAGCTGGAAACCTTGCAATTTAACC-3′(酶切位点为XhoⅠ)。用上述引物以及cDNA进行PCR扩增获得CD1031-1 494和CD1031 435-2 931目的基因,经限制性内切酶EcoRⅠ、XhoⅠ对目的基因以及pET-30a(+)空载体进行双酶切,用T4 DNA连接酶连接目的基因以及pET-30a(+)载体,将连接成功的原核表达重组质粒pET-30a-CD1031-1 494和pET-30a-CD1031 435-2 931分别转化入感受态细胞DH5α,将PCR、酶切及测序验证正确的重组质粒留存备用。
1.3 CD103蛋白的原核表达
将上述经验证正确的重组质粒pET-30a-CD1031-1 494和pET-30a-CD1031 435-2 931分别转化入大肠杆菌感受态细胞BL21(DE3),将感受态细胞培养于具有卡那霉素抗性的LB固体培养基上,挑取单克隆菌落于LB液体培养基,于37 ℃摇床220 r/min培养10~12 h后,待菌液的吸光度OD600值达到0.6~0.8时,加入IPTG诱导蛋白表达,在诱导表达10~12 h后,经离心收集菌体,将菌体经超声破碎释放出蛋白,取超声上清液及沉淀,进行SDS-PAGE,鉴定蛋白表达以及蛋白表达形式。
1.4 重组CD103蛋白纯化
将适量可结合HIS标签的树脂倒入亲和层析柱中,用5倍体积柱缓冲液(20 mmol/L Tris-HC1,100 mmol/L NaCl,2 mmol/L CaCl)平衡树脂后,将适量上述已表达的蛋白样品加入纯化柱,于4 ℃旋转结合2 h后,使纯化柱内的液体自然流出并收集。用12倍于柱体积的缓冲液洗涤树脂柱后,加入适量洗脱液,颠倒混匀后使洗脱液缓慢流出并收集,经SDS-PAGE检测其洗脱效率,将含有目的蛋白的洗脱液汇集,测定其蛋白浓度并分装保存备用。
1.5 CD103蛋白多克隆抗血清的制备
将纯化后的CD1031-1 494和CD1031 435-2 931蛋白与弗氏佐剂混合后,于背部皮下多点免疫6周龄雌性BALB/c小鼠,免疫剂量为每只小鼠200 μg,共进行3次免疫,免疫间隔周期为14 d,在第3次加强免疫后一周,通过眼球毛细管采血收集小鼠多克隆抗血清。将纯化后的CD1031-1 494和CD1031 435-2 931蛋白包被于ELISA板,依次孵育稀释度为1∶5 000的鼠血清和羊抗鼠IgG,以间接ELISA的方法分析每次免疫后小鼠血清抗体滴度的变化趋势、最终制备的多克隆血清的反应性及抗体效价。
1.6 CD103蛋白真核表达载体的构建
为验证上述所制备多克隆血清的反应性,将CD1031-2 931基因通过PCR、酶切及连接将目的基因克隆入真核表达载体pcDNA3.1,其克隆引物如下,CD1031-2 931-F:5′-CGGAATTCATGGGTGCTCCCTACGTGCTC-3′(酶切位点为EcoRⅠ);CD1031-2 931-R:5′-CGGATCCCTTAATGGTGATGGTGATGATGGAGCTGGAAACCTTGCAATT-3′(酶切位点为BamHⅠ,添加标签蛋白His),将目的基因与真核表达载体构建成功的重组质粒转化入感受态细胞DH5α,挑取单克隆菌落于LB培养基中培养12 h后提取真核表达重组质粒,进行PCR、酶切及测序验证,将测序正确的重组质粒命名为pcDNA3.1-CD1031-2 931并留存备用。
1.7 CD1031-2 931蛋白的真核表达及鉴定
复苏HEK-293T细胞于细胞培养瓶中,待细胞数目达到试验要求后将细胞铺于6孔板中,细胞密度达到80%左右时,用转染试剂PEI分别将空载体质粒pcDNA3.1和重组质粒pcDNA3.1-CD1031-2 931转染HEK-293T细胞,转染后48 h后弃去细胞培养上清液,并用NP-40裂解液裂解细胞收集细胞表达产物。将所收集表达产物经SDS-PAGE后转印于PVDF膜,加入5%脱脂奶粉于室温封闭2 h。之后,以抗His标签抗体(1∶5 000)作为一抗,以HRP标记的羊抗鼠IgG(1∶5 000)抗体作为二抗,用Western blot的方法检测目的蛋白的表达。
1.8 CD103蛋白多克隆抗体的功能验证
对CD103多克隆抗体的功能性验证包括Western blot验证和间接免疫荧光验证(indirect immunofluorescence assay, IFA)。
Western blot验证:将空载体质粒pcDNA3.1和重组质粒pcDNA3.1-CD1031-2 931转染HEK-293T细胞(转染步骤按试剂说明书进行操作),转染48 h后收集细胞表达产物并经SDS-PAGE电泳后转印于PVDF膜,加入5%脱脂奶粉于室温封闭2 h后,以His标签抗体(1∶5 000)或CD103多克隆血清(1∶5 000)作为一抗,以HRP标记的羊抗鼠IgG(1∶5 000)抗体作为二抗,经Western blot的方法检测多克隆抗体的反应性。
IFA验证:将空载体质粒pcDNA3.1和重组质粒pcDNA3.1-CD1031~2931转染HEK-293T细胞,48 h后弃去细胞上清液并用PBS清洗细胞3次,用4%多聚甲醛于室温固定细胞30 min,洗涤细胞后用0.5% TritonX-100对细胞透膜30 min,分别以His标签抗体(1∶5 000)或CD103多克隆抗体(1∶5 000)作为一抗室温孵育1 h,PBST洗涤3次后,避光加入Alexa Flour488羊抗鼠IgG抗体(1∶2 000),37 ℃孵育1 h,洗涤后加入DAPI于室温孵育5 min,洗涤后于荧光显微镜下观察荧光信号。
2 结果
2.1 CD103蛋白的基因扩增和原核表达载体的构建及验证
用CD1031-1 494和CD1031 435-2 931特异性引物经PCR扩增得到CD1031-1 494和CD1031 435-2 931基因片段,将PCR扩增产物经1%琼脂糖凝胶核酸电泳鉴定。结果显示,成功获得CD1031-1 494和CD1031 435-2 931基因片段,且分子量大小符合预期,结果如图1所示。

M.DNA Marker;1. pET-30a(+)空载体;2. pET-30a空载体酶切(EcoRⅠ、XhoⅠ);3. CD1031-2 931;4. pET-30a-CD1031-2 931;5. pET-30a-CD1031-2 931PCR鉴定;6. pET-30a-CD1031-2 931酶切鉴定;7. CD1031-1 494;8. pET-30a-CD1031-1 494;9. pET-30a-CD1031-1 494 PCR鉴定;10. pET-30a-CD1031-1 494 酶切鉴定;11. CD1031 435-2 931;12. pET-30a-CD1031 435-2 931;13. pET-30a-CD1031 435-2 931 PCR鉴定;14. pET-30a-CD1031 435-2 931酶切鉴定图1 重组质粒pET-30a-CD103的构建
将CD1031-1 494和CD1031 435-2 931基因片段以及pET-30a(+)空质粒酶切后,经T4 DNA连接酶连接后转化入感受态细胞DH5α,提取重组质粒pET-30a-CD1031-1 494和pET-30a-CD1031 435-2 931后,经PCR、酶切及测序鉴定。PCR鉴定结果显示CD1031-1 494和CD1031 435-2 931基因片段大小在1 000~2 000 bp之间,与预期结果相符。酶切鉴定结果显示,重组质粒pET-30a-CD1031-1 494和pET-30a-CD1031 435-2 931经酶切后存在两条特异条带,大小分别为1 500 bp和5 000 bp左右,pET-30a(+)空载体质粒经酶切鉴定,结果显示存在一条特异性条带,大小为5 000 bp左右,符合预期。将经PCR、酶切及测序验证正确的重组质粒pET-30a-CD1031-1 494和pET-30a-CD1031 435-2 931留存备用。
2.2 CD103蛋白的原核表达及纯化
将验证正确的重组质粒pET-30a-CD1031-1 494和pET-30a-CD1031 435-2 931分别转化入大肠杆菌感受态细胞BL21(DE3),经IPTG诱导蛋白表达,将表达蛋白的菌体超声裂解释放蛋白,SDS-PAGE鉴定蛋白表达形式。鉴定结果显示所表达的CD1031-1 494和CD1031 435-2 931蛋白大小均约为70 kDa,与预期蛋白分子量大小一致,且目的蛋白均在沉淀中以包涵体形式表达,结果如图2A所示。
将上述以包涵体形式表达的目的蛋白溶解于8 mol/L尿素中,经浓度逐级降低的尿素溶液透析出目的蛋白中尿素,最终获得可溶性的目的蛋白,将溶解后的目的蛋白通过Ni-NTA亲和层析的方式纯化,并经SDS-PAGE的方法检测蛋白纯化效果,结果显示成功纯化CD1031-1 494和CD1031 435-2 931蛋白,结果如图2B所示。Western blot验证结果显示,纯化后的CD1031-1494和CD1031435-2931蛋白条带特异,大小正确,结果如图2C所示。
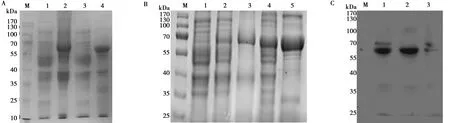
M. 蛋白Marker;A. 表达蛋白的SDS-PAGE;1为CD1031-1 494蛋白上清液,2为CD1031-1 494蛋白上清液,3为CD1031 435-2 931蛋白上清,4为CD1031 435-2 931蛋白沉淀;B. 蛋白纯化后SDS-PAGE;1为PET-30(a)空载体蛋白,2为CD1031 435-2 931蛋白纯化前,3为CD1031 435-2 931蛋白纯化后,4为CD1031-1 494蛋白纯化前,5为CD1031-1 494蛋白纯化后;C. Western blot分析;1为CD1031 435-2 931蛋白,2为CD1031-1 494蛋白,3为pET-30(a)空载体蛋白图2 CD103蛋白的原核表达
2.3 CD103多克隆抗体的制备
将纯化后的CD103蛋白与弗氏佐剂混合并充分乳化,于背部皮下多点免疫BALB/c小鼠,收集每次免疫前后的小鼠血清,用纯化后的CD103蛋白包被ELISA板,以间接ELISA的方法检测小鼠血清抗体效价的变化。结果显示,小鼠血清抗体效价随着CD103蛋白免疫次数的上升而上升(见图3A、图3B)。在第3次免疫后第7天,用毛细管在小鼠眼球采血收集多克隆体,取适量血清,经梯度稀释后用间接ELISA的方法检测血清抗体滴度。结果显示,分段表达的CD103蛋白免疫小鼠制备的多克隆抗体在稀释度达25 600倍时仍具有良好的反应性(见图3C、图3D)。
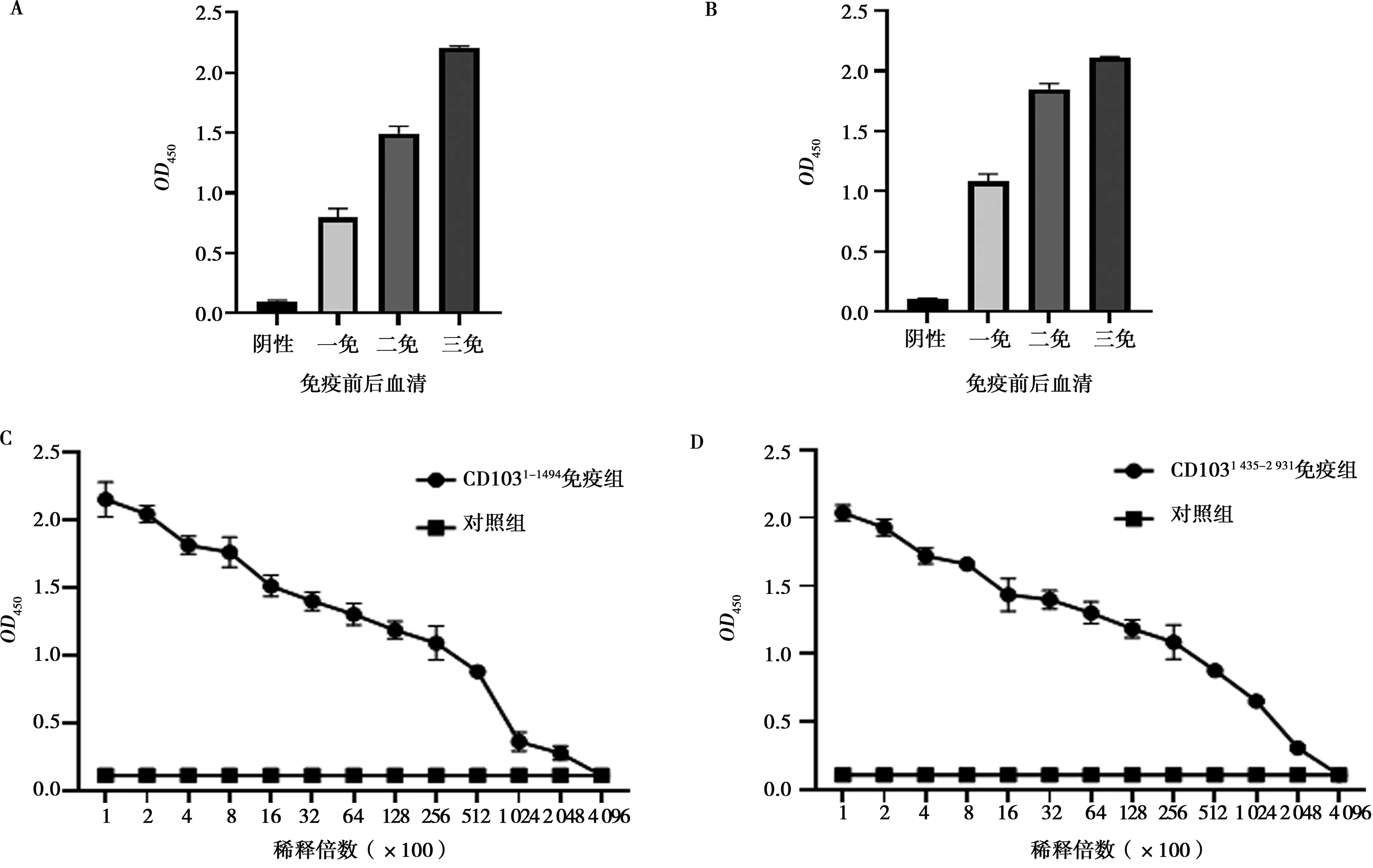
A.免疫前后CD1031-1 494抗体;B.免疫前后CD1031 435-2 931抗体;C.CD1031-1 494抗体效价滴定;D.CD1031 435-2 931抗体效价滴定;数据为“平均值±标准差”图3 CD103多克隆抗体的制备及滴定
2.4 CD103多克隆抗体的功能验证
为验证所制备的CD103多克隆抗体的反应性,将CD1031-2 931基因片段克隆入真核表达载体pcDNA3.1。经PCR扩增得到CD1031-2 931目的基因,通过酶切、连接将目的基因克隆入真核表达载体pcDNA3.1,重组质粒经PCR、酶切及测序鉴定,结果显示成功构建pcDNA3.1-CD1031-2 931真核表达重组质粒,结果如图4A所示。为验证pcDNA3.1-CD1031-2 931真核表达重组质粒的蛋白表达,将验证正确的重组质粒pcDNA3.1-CD1031-2 931和pcDNA3.1空质粒分别转染HEK-293T细胞,于转染后48 h收集细胞并经NP-40裂解,经Western blot方法检测CD1031-2 931蛋白的表达。结果显示CD1031-2 931蛋白在HEK-293T细胞中成功表达,结果如图4B所示。

A.重组质粒pcDNA3.1-CD1031-2 931的构建;M为DNA Marker,1为pcDNA3.1空载体,2为pcDNA3.1空载体酶切(EcoRⅠ、BamHⅠ),3为pcDNA3.1-CD1031-2 931,4为pcDNA3.1-CD1031-2 931 PCR鉴定,5为pcDNA3.1-CD1031-2 931 酶切鉴定;B.重组质粒pcDNA3.1-CD1031-2 931表达鉴定;1为pcDNA3.1-CD1031-2 931,2为pcDNA3.1图4 CD1031-2931真核重组载体的构建及Western blot鉴定
将上述验证表达的重组质粒pcDNA3.1-CD1031~2 931转染HEK-293T细胞,于48 h后收集细胞样品,经SDS-PAGE后转印于PVDF膜上,分别以小鼠多克隆抗体、小鼠抗His标签抗体以及小鼠阴性血清作为一抗进行孵育,之后以一抗所对应的HRP标记二抗孵育,经Western blot的方法检测小鼠多克隆抗体的反应性,结果显示,抗CD1031-1 494蛋白小鼠多克隆抗体反应性良好,抗CD1031 435-2 931蛋白小鼠多克隆抗体不具有反应性,结果如图5A所示。同样,将上述验证已表达的重组质粒pcDNA3.1-CD1031-2 931转染HEK-293T细胞后进行IFA检测,于转染48 h后弃去细胞培养上清液,固定透膜后分别以小鼠抗His标签抗体以及小鼠多克隆抗体作为一抗孵育,以一抗相对应的荧光二抗孵育,DAPI染色后于荧光显微镜下观察荧光信号。结果显示,抗CD1031-1 494蛋白小鼠多克隆抗体反应性良好,抗CD1031 435-2 931蛋白小鼠多克隆抗体不具有反应性,结果如图5B所示。
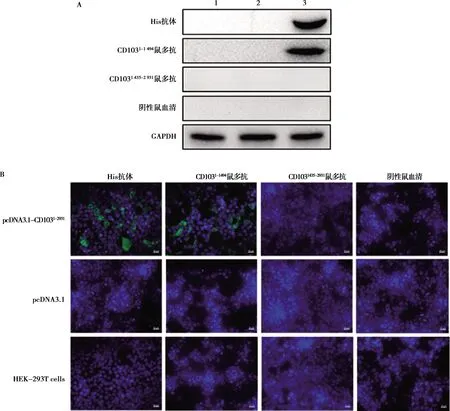
A. Western blot验证;1为空细胞对照,2为pcDNA3.1,3为pcDNA3.1-CD1031-2 931;B. 间接免疫荧光验证图5 CD103蛋白多克隆抗体反应原性验证
3 讨论
本研究应用原核表达系统表达CD1031~2 931蛋白,经过反复的优化温度、IPTG浓度和诱导时间,CD1031-2 931蛋白在原核表达系统中仍旧不表达,分析其原因认为,可能是因为目的片段分子量过大,导致蛋白表达困难。经网站http://sysbio.unl.edu/SVMTriP/预测,CD1031-2 931基因片段中可能存在抗原表位区域,在统计所有可能的抗原表位区域后,将CD1031-2 931分为了交叉重叠的两个基因片段进行分段表达。将CD1031-1 494和CD1031 435-2 931两段基因片段分别克隆入原核表达载体pET-30a(+),经过优化蛋白表达条件,最终两段蛋白以包涵体的形式表达,解决了全长蛋白在原核载体中不表达的问题。在原核表达过程中,重组蛋白在大肠杆菌表达系统中的表达形式是决定蛋白结构以及活性的主要因素[17]。在本研究中两段蛋白以包涵体的形式表达,通过利用尿素溶解包涵体蛋白对蛋白进行变性,再用浓度逐级减小的尿素溶液透析,得到具有一定活性的目的蛋白。免疫小鼠后收集血清,ELSA检测结果显示CD1031-1 494和CD1031 435-2 931蛋白均具有较好的免疫原性,可以有效刺激小鼠机体产生抗体。为验证本研究所制备多克隆抗体的应用性,构建了CD1031-2 931基因的真核表达载体,在293T细胞中表达CD1031-2 931蛋白。真核表达系统可以更好表达真核外源基因,蛋白质的折叠以及糖基化修饰更为完善,具有自然状态下的空间结构[18]。在293T细胞中表达的CD1031-2 931蛋白,经IFA与Western blot检测,只与CD1031-1 494蛋白制备的多抗隆抗体有反应性,而与CD1031 435-2 931蛋白制备的多克隆抗体不具有反应性。这和CD1031 435-2 931自身的氨基酸组成有关,可能因为CD1031-2 931蛋白在293T细胞中表达时经过了更为完整的修饰,而经原核表达系统表达的CD1031 435-2 931蛋白都缺乏修饰,使得制备的多克隆抗体不能与修饰后的蛋白结合并产生反应。
DCs因其捕获以及递呈抗原的优异性成为了抗原递呈细胞家族中最重要的一类。在免疫反应过程中,DCs捕获抗原后以MHCⅠ类分子和MHCⅡ类分子将加工处理后的抗原肽呈给T细胞,继而活化B细胞激发免疫应答[4, 19]。CD103+DCs作为一类具有迁移功能特性的DCs,其在黏膜上皮细胞下层可将突触伸入黏膜表面摄取抗原,之后迁移至相关淋巴组织活化T细胞启动黏膜免疫应答[20-21]。已有研究报道,小鼠呼吸道的CD103+DCs可使肠道产生黏膜免疫应答分泌sIgA,有效地将呼吸道和肠道黏膜组织联系起来[22]。当前CD103+DCs的研究集中于人与小鼠,对于猪机体CD103+DCs研究甚少。本研究成功克隆出猪树突状细胞表面分子CD103的编码基因,经蛋白表达免疫小鼠成功制备了CD103蛋白的多克隆抗体。该研究为后续制备猪树突状细胞表面分子CD103单克隆抗体奠定了前期基础,为深入研究猪机体CD103+DC在黏膜免疫应答中的功能提供了试验材料。
