热应激对大鼠肠上皮细胞增殖和凋亡的影响
2022-01-27殷启润李冰熊永洁贺绍君
殷启润,李冰,熊永洁,贺绍君
(安徽科技学院动物科学学院,安徽 凤阳 233100)
热应激(heat stress,HS)是高温条件下畜禽通过克服不利于自身生长发育的生理状态而产生的非特异性反应,当前畜牧业的集约化发展现状,畜禽在生长发育阶段不断面临多种应激的挑战,热应激是不可忽略的应激原之一[1-2]。夏季高温高湿环境使动物生产性能降低,免疫机能下降[3],诱发动物疾病直至死亡,对畜禽养殖业造成重要经济损失。恒温动物普遍存在等热区[4],畜禽可以通过外界环境调节及能量的消耗达到机体的平衡状态,维持正常体温与代谢,一旦环境温度过高,动物机体无法恢复体内平衡,内分泌紊乱,机能代谢与生产性能受到威胁,则会产生热应激[5]。肠道作为动物体内最重要的微生物屏障体系,存在大量的肠道菌群微生物,动物对水、离子及有机分子的吸收与运输都受到肠道上皮屏障的控制,肠上皮细胞的顶端质膜与细胞间紧密连接是维持肠道上皮细胞结构的方式[6]。紧密连接是多蛋白复合物,具有固定上皮细胞维持细胞间极性及通透性屏障的作用,其中Occludin负责调节紧密连接蛋白正常功能的运行,主要分布位置在细胞膜上;Claudins是构成紧密连接复合体的主链,能够影响细胞信号传导、增殖、分化、受体功能和迁移的屏障功能[7]。Claudins通过其屏障和通道功能阻止腔内抗原的入侵,调节细胞连接渗透性;Zo-1具有维持上皮细胞极性的作用。肠道内环境的稳定可以保证机体对营养物质的吸收,肠道菌群结构变化导致肠道黏膜损伤[8]。冯跃进[9]研究发现,热应激对机体十二指肠、盲肠、回肠以及空肠都造成不同程度的损伤,其中对十二指肠的损伤尤为显著。热应激降低肠道胰蛋白酶及淀粉酶活性、微生物菌群发生紊乱,增加沙门氏菌数量[10]。李洁蕾等[11]研究发现,43 ℃热应激条件下大鼠直肠温度显著高于对照组,热应激导致大鼠平均日增重降低。刘晓曦等[12]研究表明,热应激条件下大鼠回肠构成免疫球蛋白A的能力下降、细胞因子免疫功能减弱,使大鼠肠系膜淋巴结结构受到损伤,降低树突状细胞呈递抗原的能力,导致肠道细胞免疫功能低下。
本试验以大鼠小肠隐窝上皮(IEC-6)细胞为研究对象,其来源于大鼠小肠隐窝上皮细胞,在体外能够长期传代培养,稳定增殖,具有肠隐窝上皮细胞特质,通过体外培养IEC-6细胞,运用CCK-8方法筛选热应激温度、流式细胞术检测热应激对IEC-6细胞凋亡率及周期的影响以及Western blot检测相关凋亡及紧密连接蛋白的表达,从分子水平上探究热应激对肠道细胞的损伤机制,为生产中防治热应激对动物造成损伤提供理论依据。
1 材料与方法
1.1 试验材料
IEC-6细胞系购自中国北京协和资源中心;Cell Counting Kit-8(1016Z013),购自Solarbio,中国;ANNEXIN V-FITC/PI凋亡检测试剂盒(20200629),购自Solarbio,中国;细胞周期与细胞凋亡检测试剂盒(082219200521),购自Beyotime,中国;鼠抗β-actin(10004156),购自Proteintech,美国,1∶2 000;兔抗Bcl-2(00084007),购自Proteintech,美国,1∶500;兔抗Bax(00082363),购自Proteintech,美国,1∶1 000;兔抗Cleaved Caspase-3(00085676),购自Proteintech,美国,1∶1 000;兔抗Occludin(ab167161),购自Abcam,英国,1∶500;兔抗Claudin(ab180158),购自Abcam,英国,1∶500。
1.2 IEC-6细胞培养与分组
于5%二氧化碳培养箱中37 ℃条件下培养IEC-6细胞,当IEC-6细胞密度达到80%~90%时消化处理,随后加入1 mL含FBS的完全培养液终止消化,分皿并进行后续细胞培养。
试验分为对照组与热应激组,每组至少3个重复。热应激组的温度设置为37 ℃、38 ℃、39 ℃、40 ℃、41 ℃、42 ℃进行后续试验。
1.3 细胞活性检测
制备IEC-6细胞悬液并计数,调整细胞密度至6×104个/mL,向96孔板每孔加入100 μL细胞悬液,将96孔板转移至37 ℃培养箱预培养24 h后,分别于37 ℃、38 ℃、39 ℃、40 ℃、41 ℃、42 ℃培养箱中进行热应激处理24 h。当细胞密度达到90%时,每孔加入10 μL CCK-8溶液后孵育2 h,使用酶标仪450 nm处检测各孔吸光度并计算细胞活力。
细胞活力=[A(加药)-A(空白)]/[A(0加药)-A(空白)]×100%。
1.4 热应激对细胞凋亡率的影响
对IEC-6细胞进行传代培养,根据CCK-8试验结果筛选出试验温度,分别设置对照组(37 ℃)与热应激组(41 ℃),每组3个重复。当细胞生长密度达到70%时,将对照组与热应激组分别转移至对应培养箱中24 h。按照Annexin V-FITC Apoptosis Detection Kit说明书处理细胞,流式细胞仪进行检测,试验结果通过FLOWJO V10软件分析。
1.5 热应激对细胞周期的影响
对IEC-6细胞进行传代培养,根据CCK-8试验结果筛选出试验温度,分别设置对照组(37 ℃)与热应激组(41 ℃),每组3个重复。当细胞生长密度达到70%时,将对照组与热应激组分别转移至对应培养箱24 h。按照Cell Cycle and Apoptosis Analysis Kit说明书处理细胞,流式细胞仪进行检测,试验结果通过FLOWJO V10软件分析。增殖指数(PI)=DNA合成期(S)+DNA合成后期(G2)/细胞分裂期(M)。
1.6 热应激对IEC-6细胞凋亡蛋白及紧密连接蛋白表达的影响
1.6.1 细胞全蛋白的提取及测定
向对照组与热应激组细胞沉淀中加入配制好的细胞裂解液,涡旋震荡后冰上裂解30 min,4 ℃条件下12 000 r/min离心5 min,上清液即为全蛋白提取物。
根据BCA说明书要求测定每组细胞内蛋白含量,将上样蛋白浓度统一调整为50 μg/μL,加入上样缓冲液后,放入95 ℃水浴锅中进行煮沸15 min,蛋白充分变性后进行冷却,-80 ℃条件下将蛋白样品进行分装保存。
1.6.2 Western blot检测凋亡及紧密连接蛋白表达水平
配制12%SDS-PAGE凝胶进行电泳,恒压90 V条件下电泳30~40 min,调整电压至120 V,直至条带跑出凝胶,时间约为1 h;半干转膜法,调整电流为150 mA,转膜1 h;PVDF膜置于5%脱脂奶粉进行孵育,室温,1.5 h;将封闭后的PVDF膜放入对应的一抗中,4 ℃,过夜;使用1×TBST洗膜4次,每次10 min;将PVDF膜放入对应的二抗中进行孵育,室温,2 h;使用1×TBST洗涤PDVF膜4次,每次10 min;按比例添加显影液后上机进行曝光操作。内参蛋白为β-action。
曝光后条带后用ImageJ分析条带灰度值,蛋白相对表达量依据如下公式计算:
Ratio比值=IOD目的蛋白/IOD内参。
1.7 数据处理
每种试验至少进行3次重复,利用SPSS 18.0软件统计分析,GraphPad Prism软件进行图片制作,多组数据间差异性使用Duncan进行比较,两组数据比较使用独立样本t检验。结果以“平均值±标准差”表示,以P<0.05为差异显著性标准。
2 结果与分析
2.1 热应激对细胞活性的影响
由图1可知,随着温度的提高,IEC-6细胞活性逐渐降低,与对照组相比,41 ℃、42 ℃可以显著降低细胞活性(P<0.05)。
2.2 热应激对细胞凋亡及周期的影响
运用流式细胞术检测IEC-6细胞凋亡率,结果由图2可知,与对照组相比,热应激组细胞凋亡率极显著升高(P<0.01)。
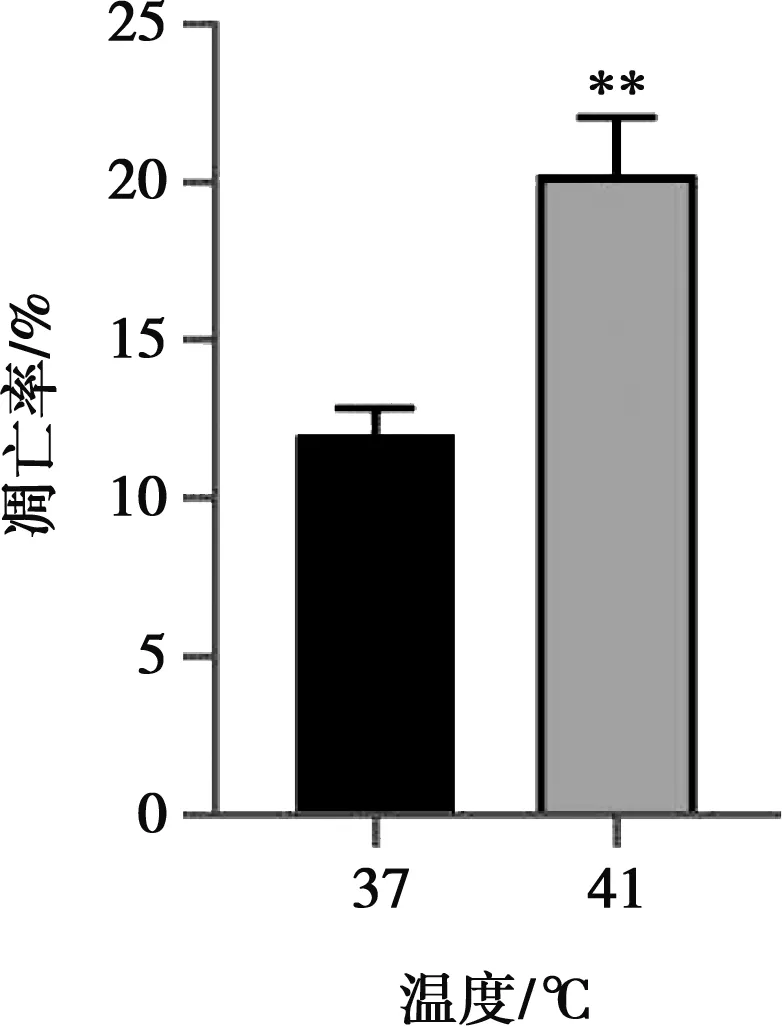
图2 热应激对IEC-6细胞凋亡率的影响
每管样品收集20 000个细胞,运用流式细胞术对IEC-6细胞周期进行检测。与对照组相比,热应激组DNA合成前期(G0/G1)期峰值极显著升高(P<0.01)(图3);热应激组S期(图4)以及G2/M期峰值极显著低于对照组(P<0.01)(图5),热应激与细胞增殖指数呈正相关,热应激时细胞增殖指数显著降低(P<0.05)(图6)。
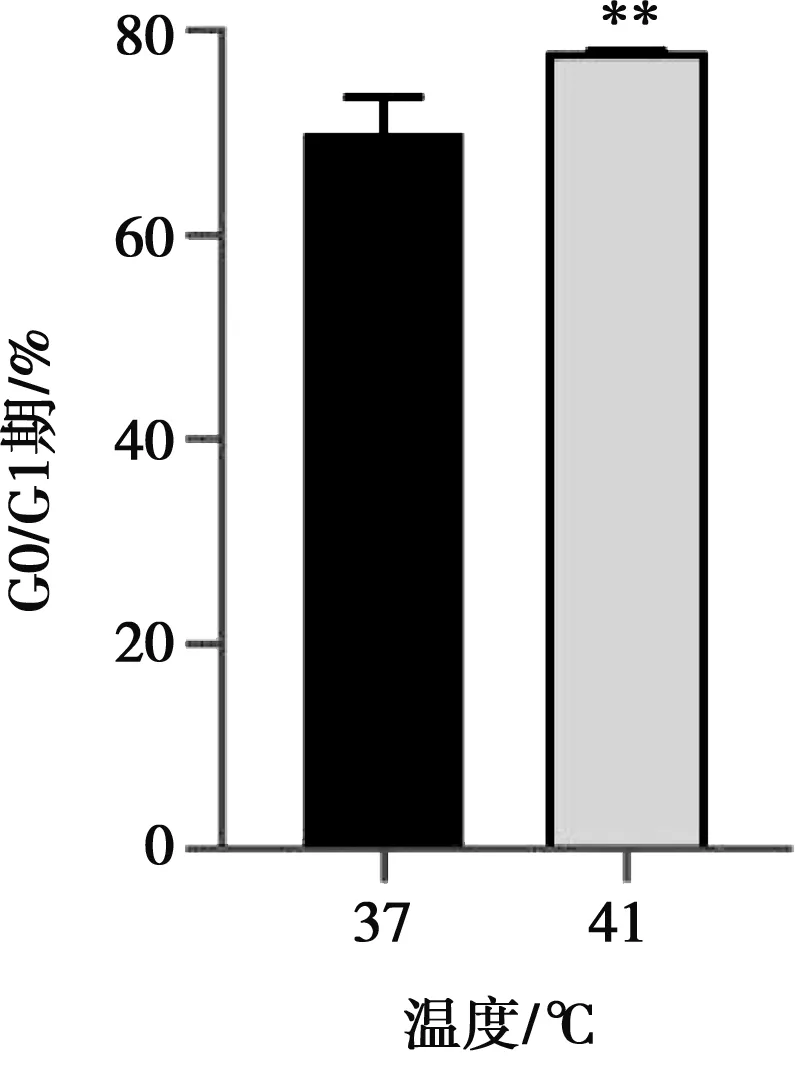
图3 热应激对IEC-6细胞G0/G1期的影响

图4 热应激对IEC-6细胞S期的影响

图5 热应激对IEC-6细胞G2/M期的影响
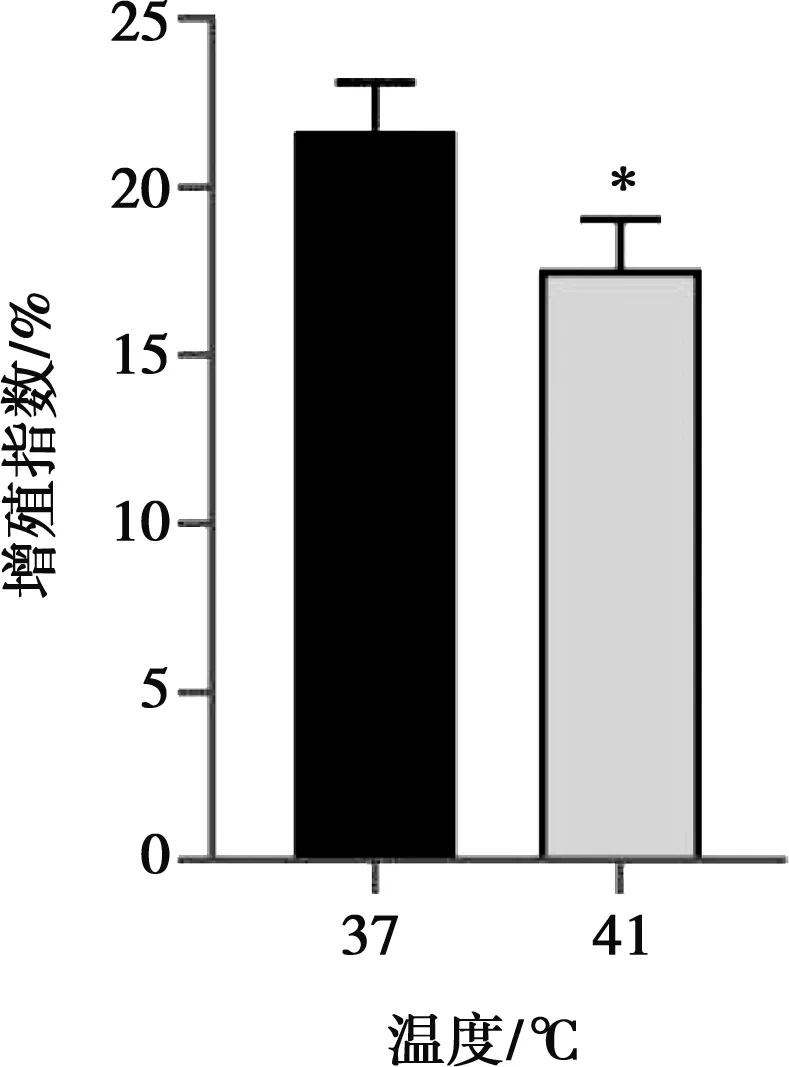
图6 热应激对IEC-6细胞增殖指数的影响
2.3 热应激对IEC-6细胞凋亡蛋白表达的影响
运用Western blot法检测凋亡相关蛋白表达,结果如图7所示,与对照组相比,Bcl-2蛋白表达量极显著降低(P<0.01);与对照相比,热应激组Bax蛋白表达量极显著升高(P<0.01);热应激组Caspase-3蛋白表达量极显著升高(P<0.01)。细胞内Bcl-2/Bax一般为固定值,在外界条件刺激下Bcl-2与Bax蛋白表达量会有所改变,结果如图8所示,与对照组相比,热应激组内Bcl-2/Bax的值极显著降低(P<0.01)。
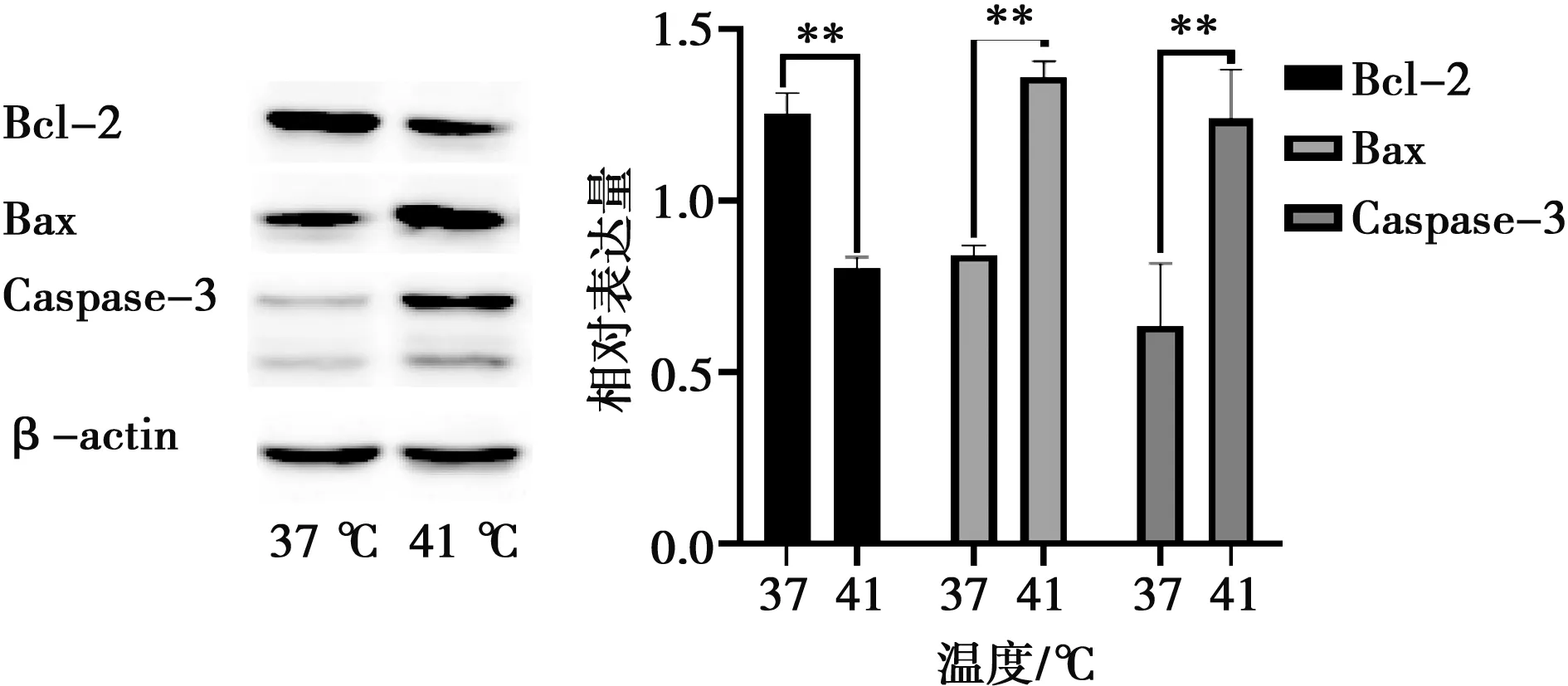
图7 热应激对IEC-6细胞凋亡蛋白表达的影响

图8 热应激对IEC-6细胞中Bcl-2/Bax的影响
2.4 热应激对IEC-6细胞紧密连接蛋白的影响
运用Western blot法检测紧密连接相关蛋白表达,结果如图9所示,与对照组相比,热应激组Occludin、Claudin-1蛋白表达量极显著降低(P<0.01)。
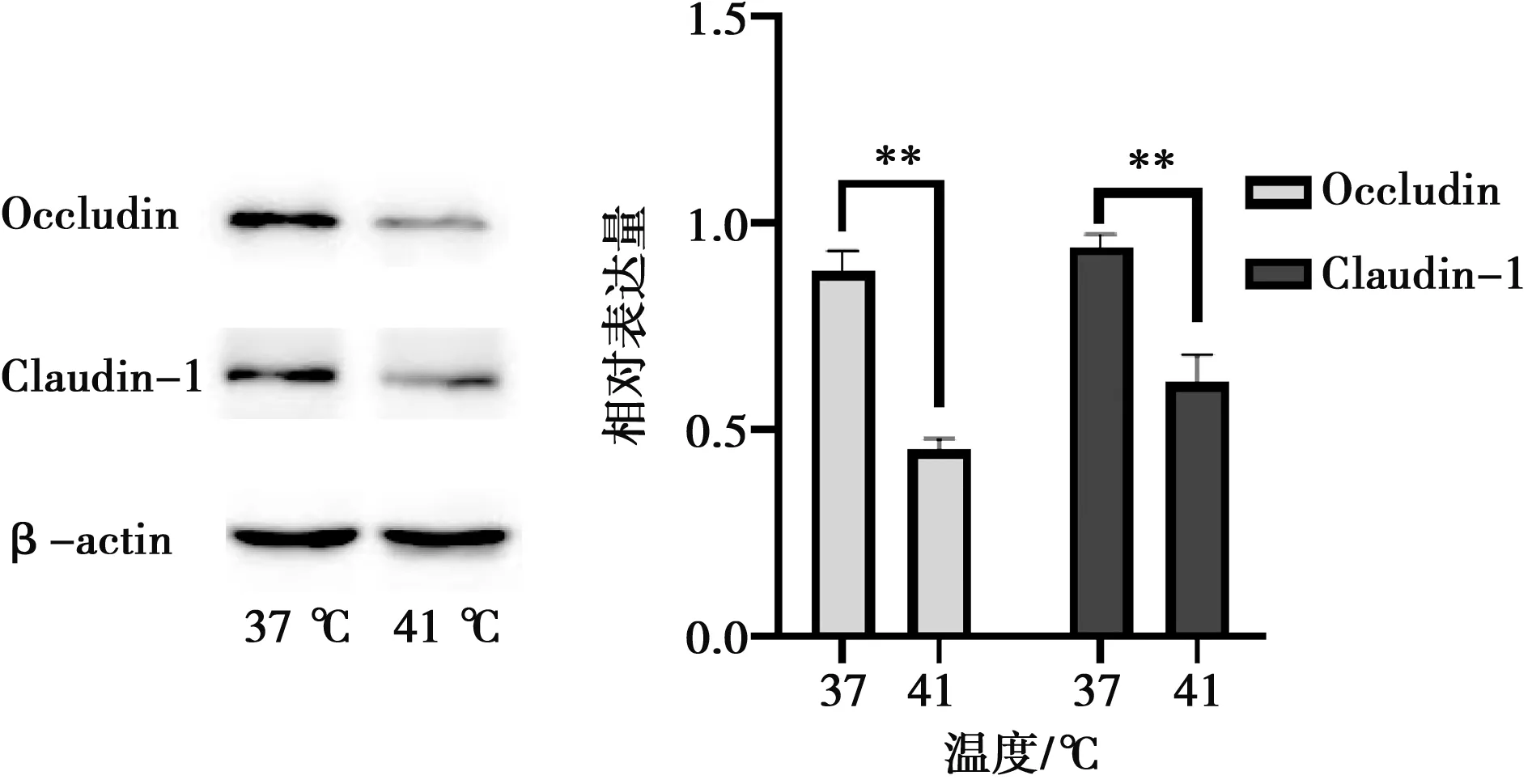
图9 热应激对IEC-6细胞紧密连接蛋白表达的影响
3 讨论
3.1 热应激对细胞活性的影响
较高的环境温度能够诱导动物机体发生一系列生理变化,了解热应激引起动物损伤的机制,有助于采取有效的措施减少热应激带来的不良反应。热应激能够引发动物体内ROS的产生,ROS的产生和有效抗氧化防御之间的不平衡诱导氧化应激[13]。宋学立等[14]研究发现氧化应激是对细胞造成损伤的主要原因之一。本试验中,与对照组相比,热应激时IEC-6活细胞数量随温度升高而减少,说明热应激可能诱导氧化应激产生,导致了细胞活性的丧失。
3.2 热应激对细胞凋亡及周期的影响
本试验中,与对照组相比,热应激组细胞凋亡率极显著上升。凋亡是一种进化保存形式的程序化细胞死亡,在维持多细胞生物体正常组织和细胞生理学中起着重要作用,与细胞坏死是两种不同的细胞死亡途径,凋亡不会引起炎症反应[15]。细胞坏死是细胞死亡的被动形式,而凋亡是一种高度调控的细胞自毁形式,包括细胞的有序脱离、细胞质的凝聚、核的降解、细胞成分结构和功能的破碎以及细胞的收缩[16],最后,细胞转化为“凋亡体”。热应激显著促进细胞的凋亡,通过对细胞周期分析,热应激时IEC-6细胞G0/G1期受到阻滞,抑制IEC-6细胞中DNA的复制与合成,延缓细胞增殖过程,抑制细胞的分裂与合成。
3.3 热应激对IEC-6细胞凋亡蛋白表达的影响
本试验IEC-6细胞中Bax、Caspase-3蛋白表达量显著上升,说明细胞凋亡通路被诱导激活,正常的细胞凋亡有助于维持细胞数量和正常细胞更替[17],但异常的细胞凋亡往往对机体正常的生理功能造成损伤。细胞凋亡受到内源性或外源性途径的调控,凋亡调控因子包括Bax、Bcl-2、Caspase-3和Caspase-9等,在外源性通路中,在外部信号通路刺激下引发凋亡,包括死亡受体、补体配体、死亡区域和Caspase-3,一些重要的补体配体的例子包括FasL/FasR、tnf-a/tnfr1、Apo3L/DR3、Apo2L/DR4和Apo2L/DR5也参与了调节过程,当配体与死亡受体结合时触发了凋亡信号,进而激活死亡域,将procaspase-3激活为Caspase-3,最终诱导细胞凋亡[18]。热应激显著下调抗凋亡蛋白Bcl-2的表达,原因是热应激时内源性凋亡发生,Bax蛋白由于刺激向线粒体外膜移动,在线粒体膜上形成一个开口,使细胞色素C从线粒体膜间迁移到细胞质中[19],与线粒体膜上另一凋亡蛋白Bak蛋白相互作用诱导线粒体片段化,从而与Bcl-2蛋白发生拮抗作用,抑制Bcl-2蛋白表达。细胞凋亡受到Bcl-2与Bax蛋白比例的调控,本试验热应激时Bcl-2与Bax比值显著降低,说明热应激诱导了细胞的凋亡机制。
3.4 热应激对IEC-6细胞紧密连接蛋白表达的影响
紧密连接由多种跨膜蛋白和胞质蛋白组成,包括Occludins、Claudins以及ZO-1,它们与细胞肌动蛋白骨架相互作用对维持上皮屏障的完整性至关重要。屏障完整性的丧失往往会导致炎症性肠病、肥胖和代谢性疾病[20]。本试验结果表明,热应激可以显著下调Occludin与Claudin-1蛋白的表达,降低肠道细胞的完整性,同时会扩大细胞间通透性,能够改变紧密连接结构,这一现状已被证明对机体有害,热应激的产生抑制肠上皮细胞间紧密连接作用,削弱肠道的机械屏障,调控肠道黏膜通透性的开放,Claudin-1蛋白表达量下调降低肠道的黏膜免疫力,减弱肠道的屏障功能。
4 结论
综上,与37 ℃培养温度相比,41 ℃时IEC-6细胞活性显著降低,细胞凋亡率显著上升;高温导致细胞G0/G1期阻滞,抑制DNA复制及合成,延缓细胞增殖过程;热应激上调凋亡蛋白表达,降低Bcl-2与Bax比值,下调Occludin与Claudin-1蛋白表达,抑制细胞间紧密连接作用。
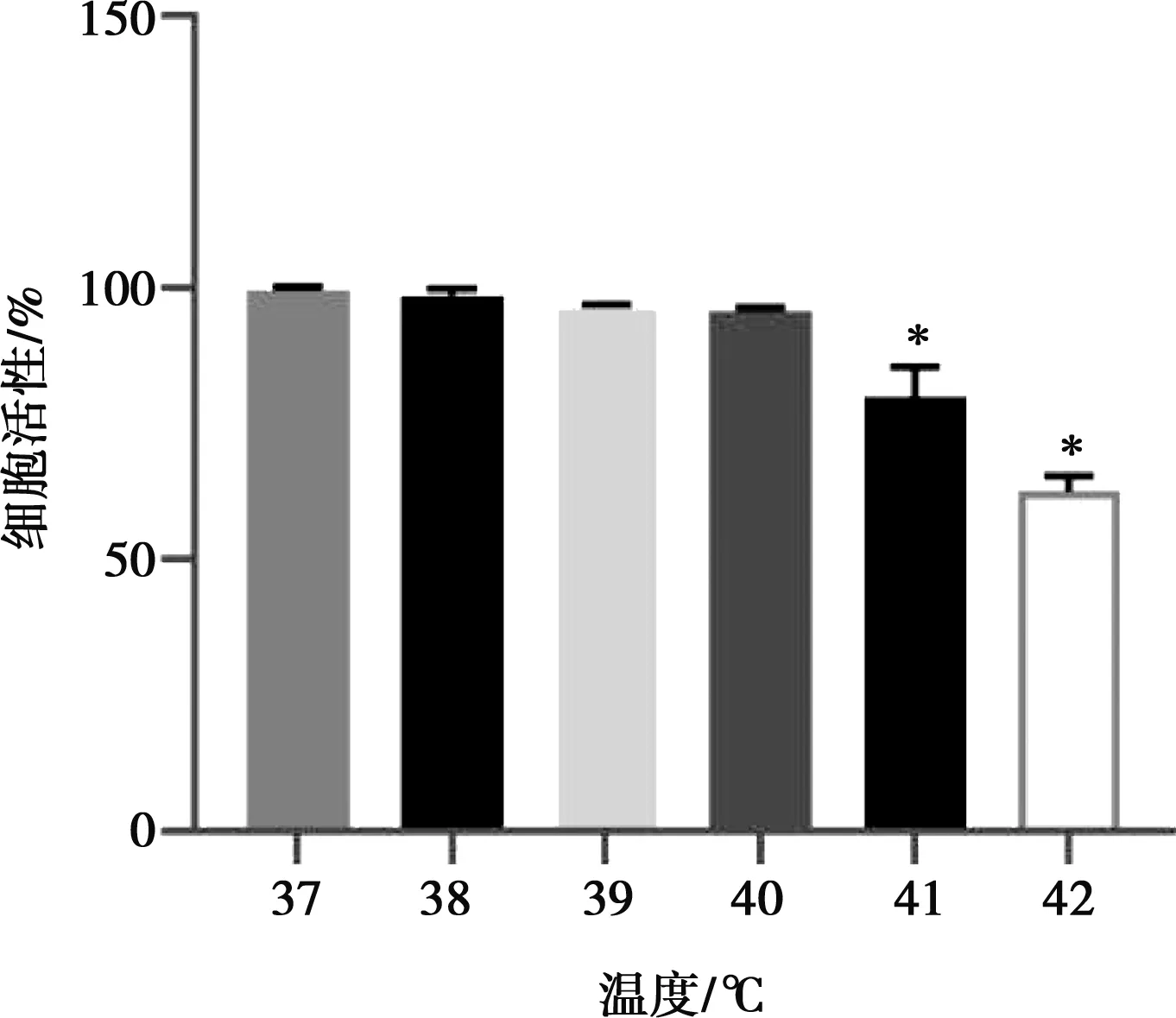
与37 ℃对照组相比,*表示差异显著(P<0.05),**表示差异极显著(P<0.01)。下同图1 热应激对细胞活性的影响
