顺铂诱导的急性肾损伤中肾脏组织m6A甲基化水平的变化
2022-01-27沈剑箫王万鹏邵兴华吴晶魁车霞静倪兆慧
沈剑箫,王万鹏,邵兴华,吴晶魁,李 舒,车霞静,倪兆慧
1.上海交通大学医学院附属仁济医院肾脏科,上海 200127;2.江苏省涟水县人民医院肾脏科,涟水 223400
顺铂是一种常用的治疗实体肿瘤的药物,通过与细胞中的DNA相结合,干扰DNA与线粒体功能,发挥抗肿瘤作用,但其也具有肾毒性。在代谢过程中,顺铂逐渐汇聚于肾小管细胞,导致细胞凋亡或坏死,引起急性肾损伤(acute kidney injury,AKI)[1-3]。已有研究[4-6]发现凋亡、坏死、炎症等均与顺铂诱导的急性肾损伤(cisplatin-induced AKI,CI-AKI)有关。
N6-甲基腺嘌呤(N6-methyladnosine,m6A)甲基化修饰是mRNA 常见的调控方式。新的测序技术使人们可以深入研究m6A 对细胞生理功能的调控作用。目前的研究[7-8]发现m6A 修饰主要发生在“RRACH”序列中的腺嘌呤上(其中R=A 或G,H=A、C 或U),其功能由“编码器(writer)”“读(reader)”与“消码器(eraser)”决定。编码器也就是甲基转移酶,是由甲基转移酶3(methyltransferase 3, METTL3)、 甲基转移酶 14(methyltransferase 14, METTL14)、 WT1 相关蛋白(WT1 associated protein WTAP)、KIAA1429 等蛋白组合而成的复合物。读码器则是由具有YTH 结构域的蛋白(包括YTHDF1、YTHDF2、YTHDF3)及核不均一蛋白HNRNP 家族蛋白(包括HNRNPA2B1 和HNRNPC)组成。消码器则是ALKB 同源染色体5(alkB homolog 5,ALKBH5)及FTO蛋白为代表的去甲基酶[9-10]。
部分研究分析了m6A 甲基化与AKI 间的关系。有研究[11]报道过Mettl3基因可有效抑制抗黏菌素诱导的小鼠肾小管上皮细胞氧化应激和细胞凋亡。另一项研究[12]发现顺铂可诱导小鼠肾小管上皮细胞凋亡,细胞中FTO 蛋白表达降低。在AKI 患者中,血清METTL14 水平升高[13]。但是,目前尚无研究通过高通量测序的方式检测m6A 甲基化在顺铂诱导的AKI 中的变化。m6A 甲基化在CI-AKI 发生、发展中的作用机制值得进一步探讨。本研究建立了一种有效的CI-AKI小鼠模型,采用甲基化RNA免疫共沉淀技术(methylated RNA immunoprecipitation,MeRIP)检测小鼠肾脏组织中m6A 甲基化水平的变化,采用RNA-seq 测序技术检测mRNA 水平的变化,探索m6A甲基化在CI-AKI中的作用。
1 材料与方法
1.1 动物与主要试剂、仪器
实验用小鼠为C57bL/6小鼠,购自上海斯莱克实验动物有限责任公司[生产许可证:SCXK (沪) 2017-0005]。RNA 分离剂、RNA 质量检测紫外分光光度计、血液离心机购自美国赛默飞公司;线粒体RNA 分离试剂盒、RNA 裂解液、高通量测序仪(Hiseq) 购自美国Illumina 公司;mRNA 分离提取试剂盒购自美国Arraystar公司;NEBNextR Ultra II RNA 建库试剂盒购自美国New England生物实验室;m6A-RNA免疫共沉淀试剂盒购自上海云序生物科技有限公司;血液成分检测机购自德国罗氏诊断有限公司。
1.2 实验方法
1.2.1 动物饲养与取材 8 只雄性8 周龄C57bL/6 小鼠随机分至对照组与损伤组(每组4 只),统一饲养于上海斯莱克实验动物有限责任公司所属动物房[使用许可证:SYXK (沪) 2017-0008]。小鼠饲养于环境温度20~22 ℃,相对湿度为40%~50%,恒温、恒湿、独立通气鼠笼中,使用经灭菌处理后的全价营养饲料与饮用水,给予昼夜明暗交替(12 h/12 h)光照。饲养14 d后,损伤组小鼠尾静脉注射顺铂20 mg/kg,对照组尾静脉注射等量生理盐水,继续常规饲养。72 h 后断颈处死所有小鼠,剥除小鼠眼球,采集外周血;切开腹腔,取出双侧肾脏。研究获得上海交通大学医学院附属仁济医院动物伦理委员会批准。
1.2.2 血清肌酐与血尿素氮检测 收集小鼠外周血,1 500×g离心10 min,收集上清液,运用标准分光光度法检测血清肌酐与血尿素氮。
1.2.3 组织病理学分析 用生理盐水清洗肾组织,10%福尔马林固定,再用10%石蜡制片,切片5 片(厚度5 μm)后运用苏木精-伊红染色,光学显微镜分析皮质-髓质交界肾小管受损情况。每组随机选取8个标本,在放大倍数为400倍的显微镜下观察是否存在肾小管扩张、刷状缘丢失、肾小管坏死等变化,并评分[14]。评分标准:0分为正常;1分为轻度(损伤小管占视野内小管百分比≤10%);2 分为中度(损伤小管占比>10%且≤25%);3 分为严重(损伤小管占比>25%且≤50%);4 分为非常严重(损伤小管占比>50%且≤75%);5 分为最严重(损伤小管占比>75%)。
1.2.4 肾组织中m6A 检测与分析 运用TRIzol 溶解肾脏组织提取总RNA,使用线粒体RNA分离试剂盒从总RNA中去除线粒体RNA。用RNA 裂解液将RNA 分裂成约100 个核苷酸长度的片段。运用紫外分光光度计检测RNA 的质量,变性琼脂糖凝胶评估RNA 完整性。使用mRNA 分离试剂盒从总RNA 中分离mRNA,再运用m6A RNA 共沉淀试剂盒将m6A 与RNA 共沉淀。运用NEBNextR Ultra ⅡRNA 工具包构建转录组文库。运用高通量测序仪检测所有样本,质控要求为Q30(碱基质量值错误率小于0.1%)。运用Cutadapt 软件(v1.9.3)适配3'端并去除低质量数据。使用Hisat2 软件(v2.0.4)校准及读取参考基因组文库。使用MACS(model-based analysis of ChIP-Seq)软件分析确定RNA 上的m6A 甲基化位点。使用motif 富集软件对m6A 甲基化位点进行富集分析,并使用R-package MetaPlotR 软件对m6A 甲基化位点在基因及染色体上的分布进行分类[15]。运用DREME 软件评估位点所修饰的碱基序列。将不同组间差异m6A 甲基化表达变化倍数≥2 且P<0.05 的位点作为显著差异的界限。运用diffReps 差异分析软件分析这些位点甲基化水平变化。最后使用基因本体论(gene ontology,GO)及京都基因和基因组数据库(Kyoto Encyclopedia of Genes and Genomes,KEGG)进行结果可视化和综合研究。
1.2.5 肾组织RNA 测序与分析 使用TRIzol从肾脏样本中提取总RNA,变性琼脂糖凝胶电泳法检测总RNA 完整性。用mRNA 分离试剂盒分离mRNA。使用BGISEQ-500平台将mRNA 碎片适配为50 bp 单链。使用SOAPnuke 软件去除低质量碎片,使用bowtie2 软件将这些数据与软件自身参考基因组比对。使用cuffdiff 软件分析2 组小鼠之间差异表达基因。
1.3 统计学方法
2 结果
2.1 小鼠CI-AKI模型的建立
本研究成功构建了顺铂诱导的小鼠AKI 模型。结果显示:在损伤组中,给予小鼠尾静脉注射顺铂20 mg/kg可使血清肌酐与血尿素氮水平显著升高(图1A、B)。肾脏病理分析结果提示顺铂可显著诱导肾脏结构损伤:损伤组小鼠的肾脏中可见广泛的肾小管空泡化变性,上皮细胞剥脱,肾小管坏死等病理改变(图1C、D)。血清肌酐、血尿素氮及肾脏病理结果均提示AKI造模成功。
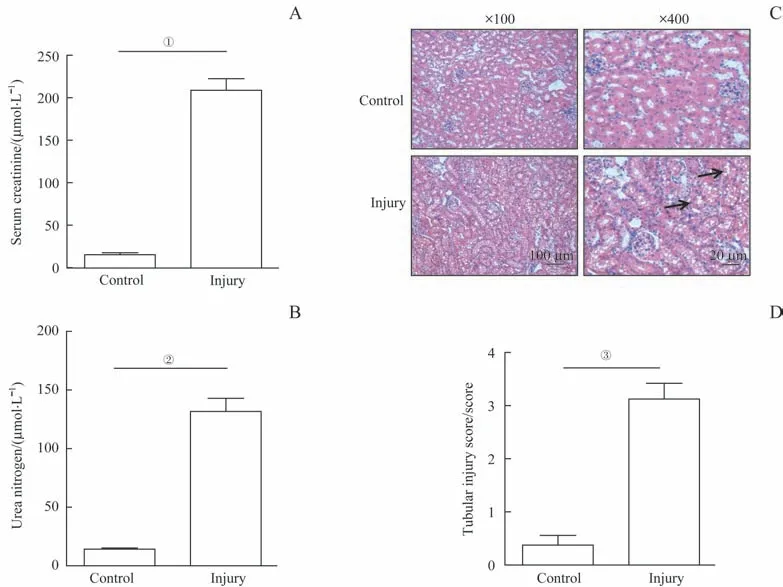
图1 顺铂诱导的C57bL/6小鼠AKI模型建立Fig 1 Establishment of CI-AKI model in C57bL/6 mice
2.2 对照组与损伤组之间m6A甲基化水平变化的比较
对照组4 个样本中共有7 942 个mRNA 含13 284 个m6A 位点,损伤组4 个样本共有7 422 个转录本含11 846个m6A 位点。损伤组与对照组相比,9 008 个位点一致(图2A)。从2组中各随机选择1份样本,并从2份样本中各选择1 000 个甲基化水平最高的位点,2 组中m6A 甲基化修饰的常见序列均为“RRACH”保守序列(图2B)。
进一步研究发现,含有1个m6A甲基化位点的基因只占对照组全部含甲基化位点基因的16.6%,在损伤组中这一比例为21.2%;超过75.0%的含有甲基化位点的基因含有2个或以上的m6A甲基化位点(图2C)。
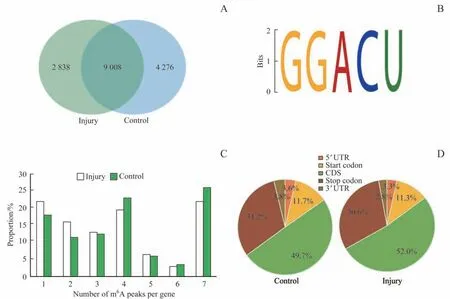
图2 对照组和损伤组mRNAs中m6A变化情况Fig 2 Overview of m6A methylation within mRNAs in the control group and the injury group
为了分析甲基化位点在基因上的分布区域,将基因按结构分为5 个区域,即5′端、启动编码区域、编码序列(coding sequence,CDS)区域、终止编码区域与3′端。结果显示,m6A在CDS区域最丰富,其次是终止编码区域。损伤组中m6A甲基化位点在终止编码区域更多(图2D)。
进一步将损伤组与对照组甲基化位点进行比对后,共有2 227 个基因中的2 981 个甲基化位点存在差异表达。损伤组相比对照组,在2 981 个差异化位点中48.2%的位点甲基化水平升高。表1展示了m6A甲基化水平变化最大的20 个位点。将这些差异表达位点进行染色体归类后发现:4 号、2 号、7 号与11 号染色体含有最多的差异m6A甲基化位点(differentially methylated m6A site,DMMS)(图3A)。将位点数除以染色体平均长度后,发现11 号、19号、7号及4号染色体含有的DMMS密度最高(图3B)。同时,CDS区域含有大部分DMMS(图3C);5′端甲基化位点上调倍数较高,3′端甲基化位点下调幅度较大(图3D)。这些数据揭示了不同基因甲基化与去甲基化的趋势。
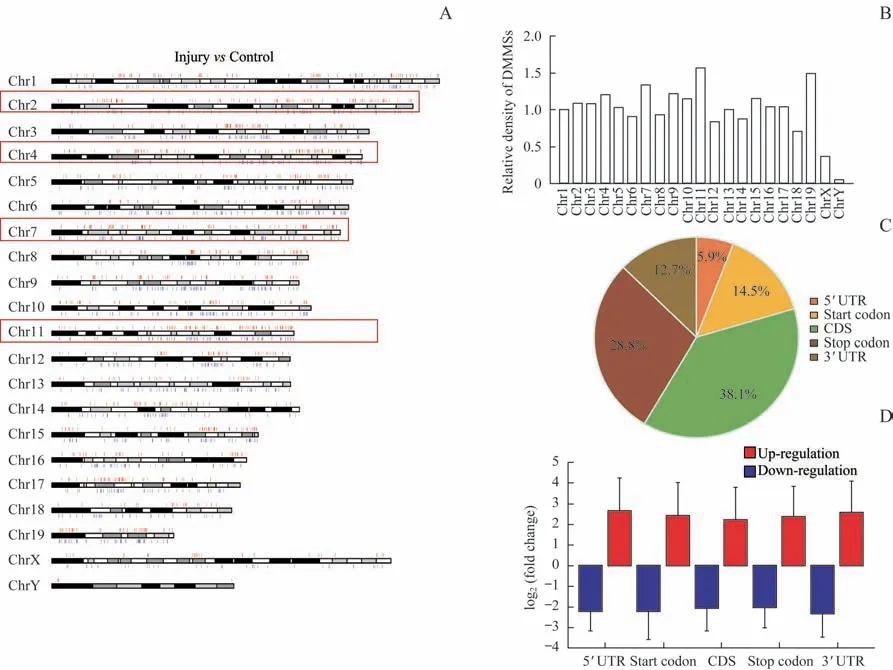
图3 DMMS在染色体上分布情况Fig 3 Distribution of DMMSs in chromosomes
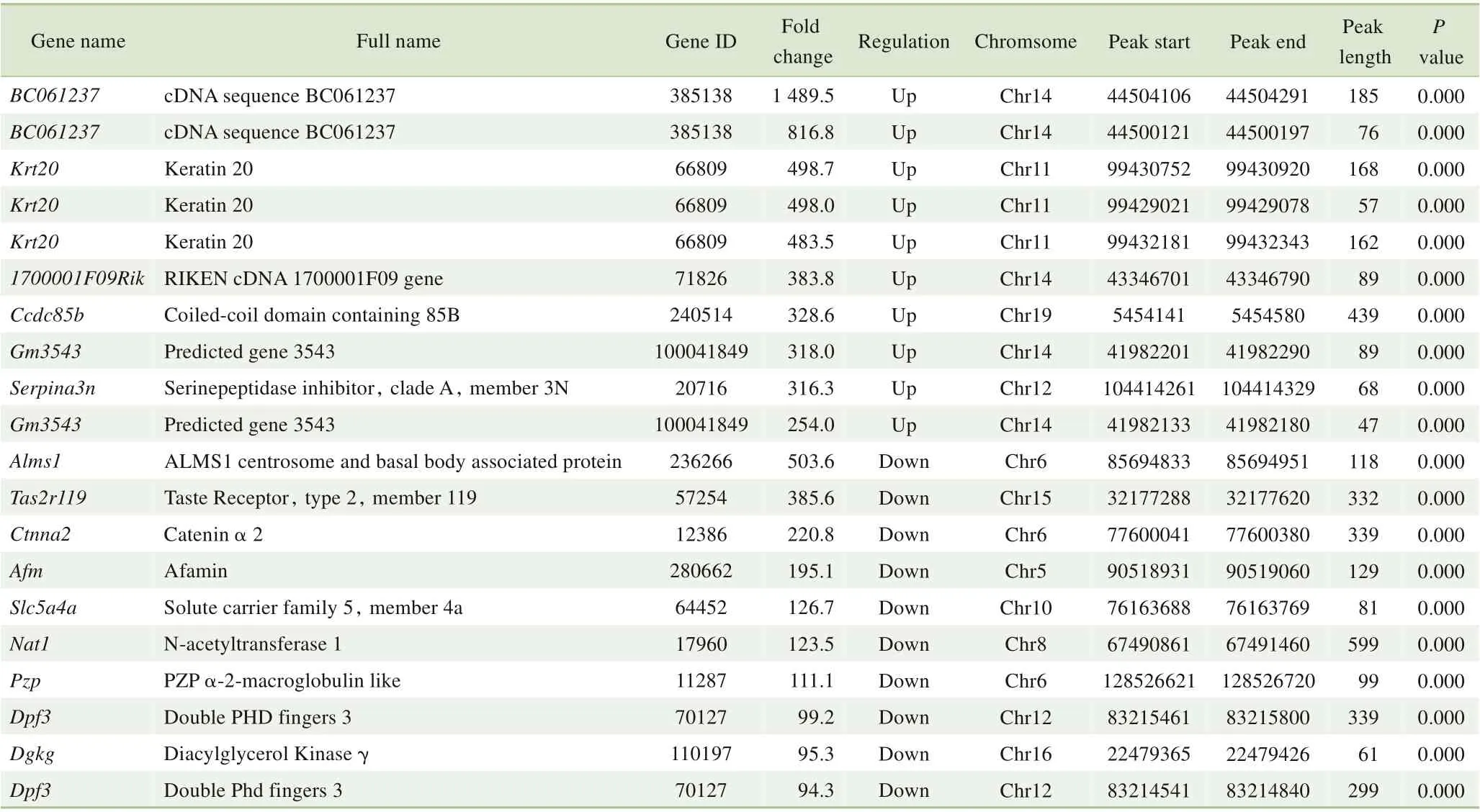
表1 甲基化水平变化差异最大的20个m6A甲基化位点Tab 1 Top 20 differentially methylated m6A peaks
2.3 含有DMMS的基因的重要通路
运用GO 富集分析和KEGG 通路分析探索了2 组中含有DMMS 的基因的生物学功能。从生物过程角度来看,含有m6A 甲基化上调位点的基因多富集于细胞代谢与死亡进程,比如大分子代谢、细胞代谢、凋亡、细胞死亡过程等(图4A)。而含有m6A 甲基化下调位点的基因富集于细胞代谢、氧化、转运、跨膜转运过程(图4B)。KEGG 通路分析则提示相关基因参与了包括肿瘤坏死因子(tumor necrosis factor,TNF)、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)、P53等凋亡相关通路中(图4C)。含有m6A 甲基化下调位点的基因富集于增殖、碳代谢、氧化磷酸化等过程(图4D)。通路分析提示基因主要富集于催化活性、离子结合、辅酶结合、辅因子结合等通路。这些结果提示m6A在CI-AKI 发生、发展中参与了代谢、细胞死亡、氧化等多种进程。
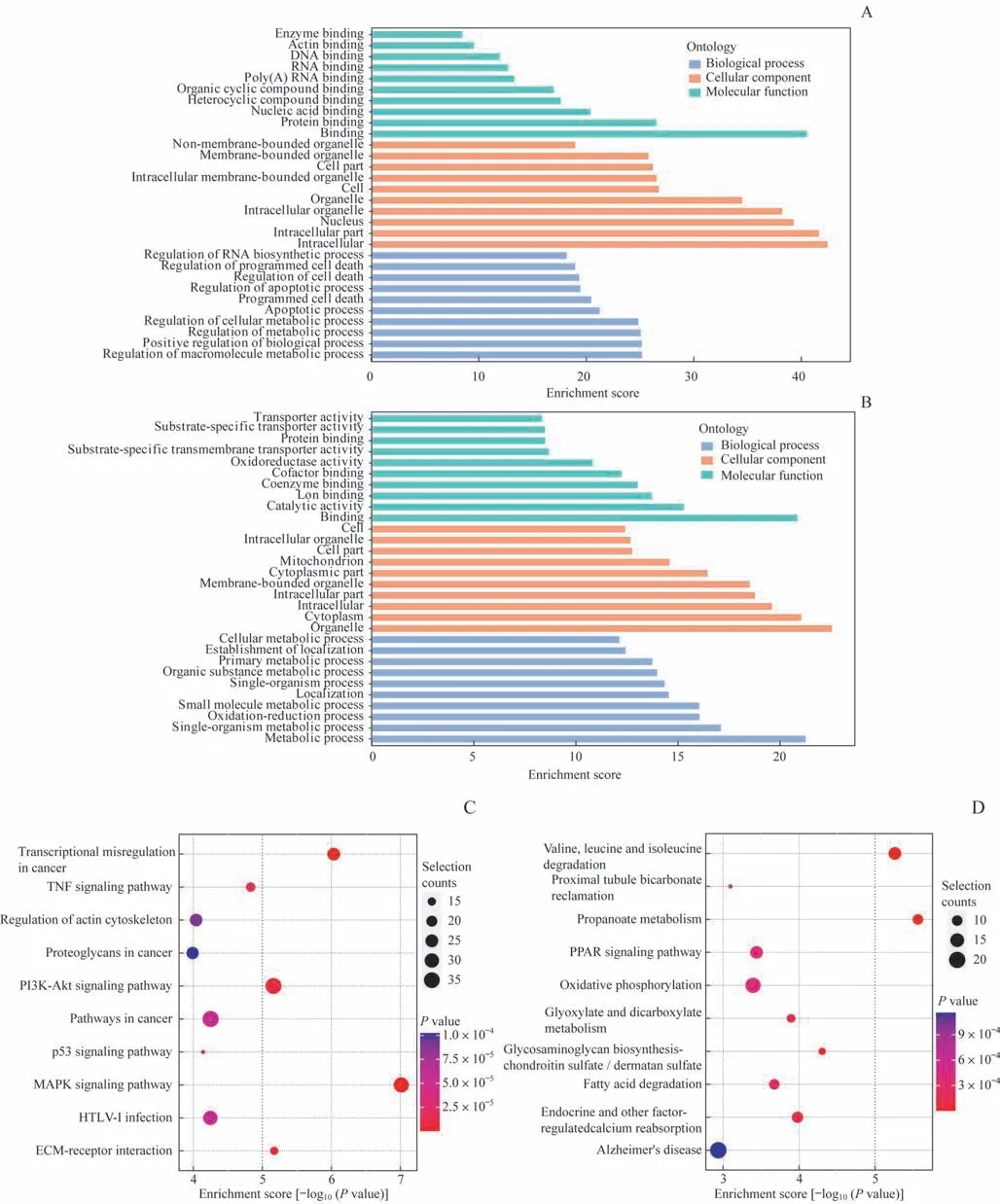
图4 GO与KEGG分析包含DMMS的编码基因Fig 4 GO and KEGG analyses of coding genes containing DMMSs
2.4 m6A修饰与基因调控的联合分析
应用RNA-seq 技术检测对照组和损伤组间差异表达基因。共发现差异表达的基因4 469 个(表达变化倍数≥2,P<0.05),其中下调基因1 655 个,上调基因2 814 个。将含有DMMS 的基因与差异表达基因取交集,共得出1 002 个基因。这些基因可分为4 类,包括576 个甲基化水平升高且RNA 表达上调的基因,422 个甲基化水平降低且RNA 表达下调的基因,1 个甲基化水平升高且RNA表达下调的基因和3 个甲基化水平降低且RNA 表达上调的基因(图5A)。
深入分析甲基化与基因表达趋势相同的基因后,发现部分基因含有生理学功能。如顺铂可促进编码纤维蛋白原的纤维蛋白原α 链(fibrinogen α chain,Fga)基因中甲基化位点变化趋势和mRNA 表达趋势均升高(图5B)。介导Na+与K+离子跨膜运动的溶质载体12家族成员1(solute carrier family 12 member 1,Slc12a1)基因受顺铂刺激后mRNA 甲基化位点变化趋势和mRNA 表达趋势均降低(图5C)。顺铂也可诱导甲肝病毒细胞受体1(hepatitis A virus cellular receptor 1,Havcr1)基因mRNA中m6A甲基化水平升高,mRNA高表达(图5D)。
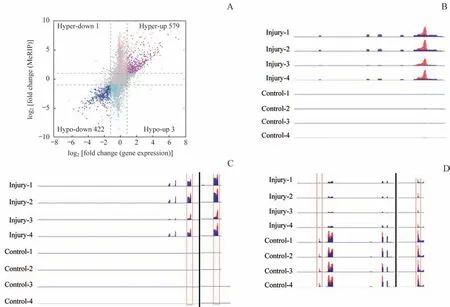
图5 差异甲基化基因和差异表达基因的联合分析Fig 5 Conjoint analysis of differentially methylated genes and differentially expressed genes
3 讨论
m6A 甲基化在许多物种中被认为是一种可逆的动态修饰。既往研究[16-18]表明,m6A 修饰可以通过影响mRNA 的转录、剪接、定位、翻译、稳定性以及RNA 水平上的转录后调节应答各种生理刺激。也有证据[11-13]提示m6A 修饰与肾损伤之间存在密切关系,揭示了m6A 在肾损伤调节中的重要生物学作用。
本研究建立了一种稳定可靠的CI-AKI 小鼠模型,并通过血清肌酐、血尿素氮检测和肾组织病理分析证实了建模成功。不同的外界刺激可导致肾脏中m6A 的动态修饰和基因的表达。本研究结果显示,顺铂诱导小鼠肾组织中mRNA 甲基化水平和基因表达量均发生变化,且m6A 甲基化修饰的常见序列为“RRACH”保守序列。这一结果与其他研究一致[19-20]。同时,超过75.0%的含有甲基化位点的基因含有2个或以上的m6A甲基化位点,这一结果与前期在脑[19]和肝[20]等脏器中的研究结果不一致,提示肾脏组织有一定特殊性。2组中m6A 甲基化含量丰富的区域均位于基因的CDS 区域,这与部分已有研究结果一致[18-20]。进一步运用GO 和KEGG 分析含有DMMS 的基因发现:甲基化水平升高(含有m6A 甲基化上调位点)的基因主要富集在代谢和细胞死亡相关的通路中,如大分子代谢、细胞代谢、TNF 信号通路和MAPK 信号通路;甲基化水平降低(含有m6A 甲基化下调位点)的基因主要集中在代谢、氧化和转运通路中,说明顺铂导致了复杂的m6A 甲基化变化。所涉及的通路中已有多条通路被证实是CI-AKI 的影响因素。其中,代谢相关通路的变化可能是构成CI-AKI 病理生理变化的基础。
最后,本研究结合m6A 修饰和基因调控探索了CIAKI 的可能发生机制。将转录组的数据与表观遗传学数据整合分析得到的1 002 个基因中,绝大部分基因中m6A甲基化趋势与基因表达趋势一致,这与文献报道相同[19-21],提示顺铂可能通过影响这些基因的m6A 甲基化水平进而影响转录组水平变化。这为进一步研究CI-AKI机制提供了新的思路。同时,有几个变化的基因引起了我们的注意。例如,顺铂诱导小鼠肾脏中Fga基因甲基化水平和表达水平均上调,且Fga是编码纤维蛋白原的关键基因。顺铂可引起肾脏血管内皮损伤和广泛的炎症反应,激活凝血级联反应[22-24]。本研究结果则提示顺铂对m6A 甲基化水平的影响可能是Fga基因表达水平变化的重要原因。Slc12a1 是袢利尿剂的分子靶点[25-27]。Sc12a1 介导Na+和K+的跨膜运动,顺铂破坏小管转运Na+和K+等离子的功能。在本研究中,Slc12a1在顺铂的刺激下甲基化水平下调并低表达,这提示顺铂对离子转运功能的破坏可能部分通过影响关键基因Slc12a1mRNA 上的m6A 甲基化水平实现。Harvc1 已被证实可作为肾损伤预测的标志物[28-30]。有报道[31]表明,Harvc1通过介导吞噬作用减轻急性肾脏损伤。本研究结果表明顺铂诱导Harvc1mRNA 的m6A 甲基化水平升高,提示m6A 甲基化可能也是Harvc1 发挥作用的机制之一,这为进一步研究Harvc1在肾脏疾病中的功能提供了思路。
综上,本研究通过比较正常小鼠与CI-AKI 小鼠模型中肾脏组织的m6A 甲基化及RNA 表达差异,表明m6A 甲基化与CI-AKI 之间存在重要关联。此外,获得的候选基因揭示了m6A 甲基化与CI-AKI 之间可能存在的关联。但本研究仍存在一些不足。目前尚无法确定观测到的m6A变化是由顺铂直接导致,还是在AKI 过程中细胞生理活动变化后发生,这也是我们今后的研究方向。课题组拟在下一步研究中结合其他研究中的数据和体内、体外实验明确顺铂对m6A甲基化的影响。
