阿托伐他汀对肝纤维化的改善作用及其机制
2022-01-27郝风节王俊青
汪 楠,陆 晔,郝风节,王俊青
上海交通大学医学院附属瑞金医院普外科,上海 200025
他汀类药物是肝脏合成胆固醇的限速酶——羟基甲基戊二酰辅酶A (3-hydroxy-3-methyl glutaryl coenzyme A reductase,HMG-CoA)还原酶的抑制剂,不仅能有效抑制胆固醇和低密度脂蛋白合成,还能轻度降低三酰甘油和升高高密度脂蛋白含量,是临床上广泛使用的调脂药物[1]。肝纤维化是临床常见的进展期肝病,常由多种基础肝病如病毒性肝炎、脂肪性肝病、酒精性肝病、胆汁淤积性肝炎等慢性疾病发展而来。每年全球有超过100 万人死于重度肝纤维化,其中约11%的患者来自中国[2]。在临床工作中,他汀类药物常用于脂肪肝的治疗。然而,近年来多项研究揭示他汀类药物在肝脏中具有缓解肝内脂肪堆积之外的保护作用[3]。Schierwagen 等[4]证实,他汀类药物可通过抑制GTP 蛋白酶RhoA 及Ras 蛋白异戊二烯化缓解非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)导致的肝内炎症。此外,他汀类药物在多种动物模型中具有缓解纤维化形成、保护肝脏功能的作用。既往研究[5]表明,在严重NASH 导致的肝纤维化中,他汀类可抑制肝细胞对星状细胞的旁分泌,以及星状细胞的激活。在胆源性肝纤维化中,他汀类药物可激活孕烷X 受体(pregnane X receptor,PXR)及过氧化物酶体增殖物激活受体α (perixisome proliferation-activated receptor α,PPARα)通路,降低肝内胆汁酸浓度[6]。在本研究中,首先通过meta 分析探讨他汀类药物在多种慢性肝病中是否可缓解肝纤维化进展及门脉高压症;再通过腹腔注射四氯化碳(CCl4)构建小鼠肝纤维化模型,进一步明确他汀类药物在肝纤维化这一严重肝脏病变中的作用和机制。
1 资料与方法
1.1 检索策略
检索PubMed 上相关文献,起止时间为2010 年1 月—2020 年6 月。 检索策略为(statin OR statins OR simvastatin OR pravastatin OR lovastatin OR atorvastatin OR fluindostatin OR rosuvastatin) AND (liver diseases OR hepatitis B OR hepatitis C OR alcoholic liver disease OR fatty liver OR liver cancer OR hepatocellular carcinoma OR HCC)。
1.2 文献的纳入和排除
文献纳入标准:英文语言;存在使用他汀类药物与不使用他汀类药物的组间比较;患者存在明确基础肝病;患者具有明确肝功能失代偿及肝纤维化;其他并发症如静脉曲张、腹水、肝性脑病等有明确定义;队列中患者年龄均>18 周岁。文献排除标准:基础研究;病例分析;综述;实验设计存在明显缺陷;临床数据缺失。
所有文献的纳入和排除分别由2 位研究者独立完成。当两人意见不一时,则由第三位研究者协调直至达成一致意见。
1.3 实验材料
1.3.1 实验动物 健康的雄性SPF 级C57BL/6 小鼠共16只,周龄8 周,体质量为20~25 g,由上海交通大学医学院实验动物科学部提供。实验动物生产许可证号为SCXK(沪) 2018-0007,使用许可证号为SYXK(沪) 2018-0027。动物饲养于12 h 循环光照/黑暗、恒温、恒湿的环境下,提供标准饲料及饮水。本研究中动物实验经上海交通大学医学院附属瑞金医院动物伦理委员会批准[2020动伦审第(102)号]。
1.3.2 主要试剂与仪器 阿托伐他汀(杭州昊鑫生物科技股份有限公司,中国),CCl4、TRIzol 试剂(Sigma-Aldrich,美国),反转录酶、dNTPs、高保真DNA聚合酶(Invitrogen,美国),氯仿、异丙醇、无水乙醇(国药集团化学试剂有限公司,中国),DEPC 水、甘油醛-3-磷酸脱 氢 酶 (glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(上海翊圣生物科技有限公司,中国),反转录试剂盒及实时荧光定量PCR 试剂盒(TaKaRa,日本),聚氰基丙烯酸正丁酯(bicinchonininc acid,BCA)蛋白定量试剂盒(上海碧云天生物技术有限公司,中国),蛋白裂解液(ThermoFisher,美国),collagen Ⅰ抗体、Smad4 抗体(Abcam,英国),辣根过氧化物酶标记的抗兔二抗(Jackson ImmunoResearch,美国),ECL 发光试剂盒(ThermoFisher,美国)。
主要实验仪器包括高速离心机(Eppendorf,德国)、紫外分光光度计(ThermoFisher,美国)、实时荧光定量PCR 仪(Roche,瑞士)、Odyssey 红外荧光扫描仪(LICOR,美国)。
1.4 实验方法
1.4.1 小鼠肝纤维化模型的建立及分组 将16 只小鼠随机分为对照组、阿托伐他汀组、 CCl4注射组、CCl4注射联合阿托伐他汀组,每组4只。CCl4注射组小鼠以20%体积分数的CCl4按1 mL/kg 的剂量,每周行2 次腹腔注射;对照组使用同剂量玉米油进行腹腔注射;阿托伐他汀组小鼠每日以15 mg/kg剂量的阿托伐他汀灌胃1次;CCl4注射联合阿托伐他汀组联合采用上述CCl4和阿托伐他汀的处理方式。
动物每周固定时间称重。饲养4周后对所有小鼠进行安乐死处理,记录体质量后开腹游离腹腔大血管和肝脏。从下腔静脉抽取血液约1.5 mL,12 000×g离心5 min,获得的血清于-80 ℃冰冻保存。离断相关韧带及血管,完整取出小鼠肝脏。将肝脏按肝叶解剖切成小片,分别置于4%多聚甲醛(制备石蜡切片)及冻存管(-80 ℃超低温冰箱)中,以备后续使用。检测小鼠血清谷丙转氨酶(glutamic pyruvic transaminase,GPT)、谷草转氨酶(glutamic oxaloacetic transaminase,GOT)浓度。
1.4.2 天狼星红染色观察肝组织纤维化 将小鼠肝脏制备石蜡切片,厚度为4 μm,二甲苯脱蜡至水洗;将切片置0.1%天狼星红染液中1 h 后,蒸馏水洗涤2 次(每次4 min);将Harris's 苏木素染料滴于切片上,于37 ℃孵育20 min,蒸馏水洗涤2 次(每次4 min);使用95%、70%的乙醇脱水,二甲苯通透5 min 后,中性树胶封片;使用显微镜观察、拍照。
1.4.3 免疫荧光染色观察collagenⅠA 的表达 取小鼠肝脏切片,磷酸盐缓冲液洗涤10 min,重复2 次;5%胎牛血清室温封闭1 h 后,使用0.2%Triton X-100 通透10 min;随后加入抗collagen ⅠA 的一抗,4 ℃孵育过夜;次日,磷酸盐缓冲液清洗,重复2次;荧光二抗室温孵育1 h,使用4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)室温染细胞核10 min;于倒置荧光显微镜下观察、拍照。
1.4.4 实时定量PCR TRIzol 法提取小鼠肝组织RNA;将小块肝组织在1 mL 的TRIzol 中匀浆,随后加入0.2 mL氯仿使蛋白与RNA分离;待分层后吸取含RNA的水相部分,与0.5 mL 异丙醇充分混匀使RNA 沉淀;以75%乙醇洗涤3 次后干燥,得到肝组织RNA,并利用紫外分光光度计进行浓度和纯度测定。
以所获样本的RNA 添加反转录酶进行反转录PCR,得到cDNA。利用Syber Green 试剂盒及目标基因序列引物进行实时定量PCR,检测肝组织α平滑肌肌动蛋白(αsmooth muscle actin,α-SMA)、collagen Ⅰ、collagen Ⅲ,以及白介素(interleukin,IL)-1b、IL-6、转化生长因子β(transforming growth factor-β,TGF-β)的表达。
1.4.5 免疫印迹法检测肝组织α-SMA 蛋白和磷酸化Smad4 的表达 将小块肝脏组织在预先配制好的含有蛋白酶抑制剂的组织裂解液中碾磨,直至云雾状后于冰上放置30 min;随后,11 000×g高速离心并吸取上清;最后,采用BCA 法测定小鼠肝脏组织的蛋白浓度。蛋白质加热变性后进行SDS-PAGE 电泳,随后以湿转法将蛋白由凝胶上转印至PVDF膜上;5%脱脂牛奶封闭1 h后加入稀释后的抗α-SMA 抗体(1∶1 000)、抗pSmad4 抗体(1∶1000)或抗GAPDH抗体(1∶2 000),4 ℃振荡孵育过夜;TBST 洗膜,加入辣根过氧化物酶标记的二抗室温孵育1 h,再次用TBST 洗膜;最后以ECL 法将膜上蛋白显色,经显影处理后,采用凝胶成像分析系统对胶片进行拍照。
1.5 统计学分析
采用逆方差加权评估入组研究的异质性,若I2>50%则认为不同研究间存在异质性。采用Stata software 15.0软件进行统计学分析。相对危险度(RR)和各研究的权重均在结果中显示。实验数据采用SPSS 19.0 软件进行统计学处理,数据比较应用Studentt检验及χ2检验。P<0.05表示差异有统计学意义。
2 结果
2.1 文献筛选及数据提取
通过初步检索,筛选了2 705 篇英文文献。经过阅读题目及摘要初筛后,排除不达标的2 469 篇文献,剩余236篇文献。精读文献全文后,根据设定的纳入和排除标准,排除了48篇文献,剩余188篇文献。经过2名研究者反复评估,最终选取9篇文献[7-15],见图1、表1。

表1 纳入文献的相关数据Tab 1 Associated data of the selected literatures
图1 文献筛选流程Fig 1 Flow chart of literature inclusion
2.2 文献统计结果分析
2.2.1 肝纤维化进展风险 纳入4 篇文献[9-10,12,14],共106 947例患者,其中试验组38 770例,对照组68 177例。分析结果显示RR=0.32,95%CI为0.31~0.33(图2)。与对照组比较,他汀类药物组能显著降低肝纤维化发生率;但异质性检验结果显示I2=0.989,P<0.01,表明纳入的文献具有较强异质性。
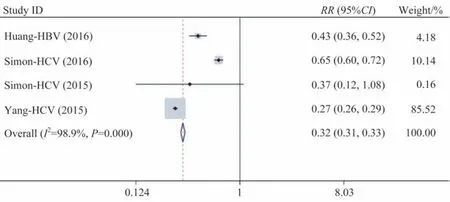
图2 他汀类药物对于肝纤维化发生风险的影响Fig 2 Effect of statins on the risk of hepatic fibrosis
2.2.2 肝功能失代偿风险 纳入4 篇文献[7,12-13,15],共17 374 例患者,其中试验组7 973 例,对照组9 401 例。分析结果显示RR=0.53,95%CI为0.46~0.62(图3)。异质性检验结果显示I2=0.357,P=0.169,表明纳入的文献同质性较好。与对照组比较,他汀类药物能显著减缓肝硬化患者肝功能失代偿的进展。

图3 他汀类药物对于肝功能失代偿风险的影响Fig 3 Effect of statins on the risk of liver decompensation
2.2.3 总体死亡率 纳入5篇文献[7-8,11,13,15],共59 329例患者,其中试验组3 600 例,对照组55 729 例。分析结果显示RR=0.55,95%CI为0.48~0.63(图4)。异质性检验结果显示I2=0.156,P=0.311,表明纳入的文献同质性较好。与对照组比较,他汀类药物组患者总体死亡率显著降低。

图4 他汀类药物对于总体死亡风险的影响Fig 4 Effect of statins on the overall risk of death
2.3 阿托伐他汀对小鼠体质量及肝脏损伤的影响
4周处理后,与对照组比较,CCl4注射组和CCl4注射联合阿托伐他汀组小鼠体质量均显著下降(均P=0.000);而CCl4注射联合阿托伐他汀组小鼠体质量与CCl4注射组比较,下降程度较轻,组间差异有统计学意义(P=0.040),见图5A。与对照组比较,CCl4注射组和CCl4注射联合阿托伐他汀组小鼠GPT、GOT 浓度均显著上升(均P=0.000);而CCl4注射联合阿托伐他汀组小鼠与CCl4注射组比较,GPT、GOT 上升程度均较小,组间差异有统计学意义(均P=0.020),见图5B、C。

图5 阿托伐他汀对CCl4注射导致的小鼠肝脏损伤及体质量的影响Fig 5 Effect of atorvastatin on liver injury and weight of mice caused by CCl4 injection
2.4 阿托伐他汀对小鼠肝纤维化的影响
天狼星红染色结果显示,CCl4 注射组肝内纤维过度沉积,以小叶中央区为主(图6A);而CCl4 注射联合阿托伐他汀组小鼠中肝脏纤维化情况有所缓解。免疫荧光染色结果同样显示,collagen ⅠA 在CCl4 注射组高表达(图6B)。
进一步通过实时荧光定量PCR、免疫印迹法检测纤维化相关标志物α-SMA、collagen Ⅰ、collagen Ⅲ的表达情况,结果显示:与对照组比较,CCl4注射组中α-SMA蛋白表达升高,α-SMA、collagen Ⅰ、collagen Ⅲ的mRNA 表达升高(均P<0.05);而CCl4注射联合阿托伐他汀组与CCl4注射组比较,上述指标均有所下调,差异均有统计学意义(均P<0.05),见图6C~F。
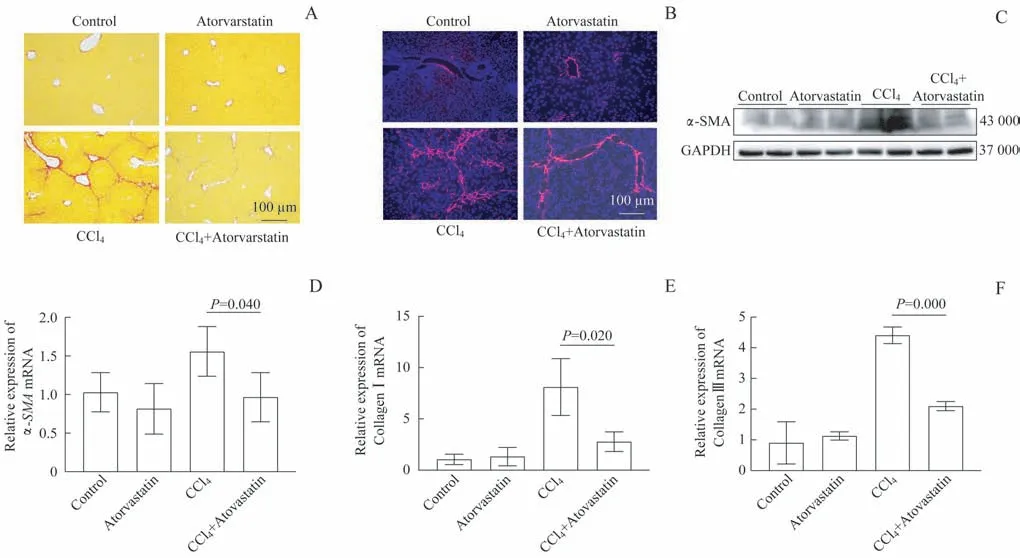
图6 阿托伐他汀对CCl4注射导致的小鼠肝纤维化的缓解作用Fig 6 Mitogenic effect of atorvastatin on hepatic fibrosis in the mice after CCl4 injection
2.5 阿托伐他汀对肝内炎症因子表达及TGF-β 通路的影响
实时荧光定量PCR 检测结果显示:与对照组相比,CCl4注射组中IL-1b、IL-6的mRNA 表达轻微上升,TGFβ的mRNA 表达显著升高(均P<0.05);而CCl4注射联合阿托伐他汀组与CCl4注射组比较,IL-1b、IL-6的mRNA表达显著升高,TGF-β的mRNA 表达显著降低,差异均有统计学意义(均P<0.05),见图7A~C。免疫印迹法检测结果显示:与对照组相比,CCl4注射组pSmad4 蛋白表达升高;而CCl4注射联合阿托伐他汀组与CCl4注射组相比,pSmad4蛋白表达较低(图7D)。

图7 阿托伐他汀对肝内炎症因子表达及TGF-β通路的影响Fig 7 Effect of atorvastatin on expressions of intrahepatic inflammatory factors and TGF-β pathway
3 讨论
肝纤维化是肝细胞被反复破坏后再生,胶原、糖蛋白、蛋白多糖等细胞外基质在肝内过度沉积并异常分布形成的病理变化。在肝病慢性病程中,肝纤维化往往由早期病变如脂肪肝、肝炎发展而来。全球范围内,肝纤维化发生率居全球致死疾病第11 位[16]。重度肝纤维化患者因肝功能严重受损、生活质量低下,生存率很低。目前,药物治疗虽然可延缓疾病发展进程,但是对于已形成肝纤维化的肝组织缺乏保护作用;而作为现阶段根治性手术方案的肝移植等,也只能满足少量患者的治疗需求。
他汀类药物的主要作用是减少胆固醇和低密度脂蛋白合成,目前已作为一线治疗及预防用药在心血管疾病中得到大量应用。该类药物在调整血脂的同时,可有效改善局部脂肪肝症状。此外,既往研究[17-18]已经揭示,他汀类具有包括抗炎、抗增殖、抗氧化、抗纤维化在内的多重药理作用。在本研究的meta 分析中,通过对9 篇入选文献的研究,同样发现他汀类药物对不同病因导致的肝纤维化均具有保护作用。基于meta 分析的结果,本研究构建了肝纤维化小鼠模型并予以阿托伐他汀治疗。通过组织染色、实时荧光定量PCR、免疫印迹法等方法,检测肝纤维化标志物α-SMA 及胶原蛋白的分布和表达,验证了他汀类药物对肝纤维化的保护作用。
肝纤维化是肝内多种细胞、生物因子和信号通路长期协同作用形成的复杂的病理性改变。目前认为,多种病因导致的肝内炎症激活肝星状细胞(hepatic stellate cell,HSC)是肝纤维化的经典机制,其中TGF-β 通路的激活是其中的重要环节[19]。本研究通过实时荧光定量PCR、免疫印迹法等方法,检测IL-1b、IL-6、TGF-β的mRNA 表达以及pSmad4 蛋白的表达量,提示他汀类药物可能通过调控TGF-β 通路,延缓肝纤维化的发生及发展。有研究者已尝试利用他汀类药物的作用机制,使肝脏疾病患者在临床治疗中获益。Huang等[12]及Simon 等[9]分别证实,使用他汀类药物可显著降低乙型和丙型病毒性肝炎患者的肝硬化发病率,且药物用量与肝硬化风险之间存在剂量-效应关系;其他不良事件如肝功能失代偿、腹水、死亡的发生率均在使用他汀类药物后下降。Trebicka 等[20]在动物模型中发现,阿托伐他汀通过抑制RhoA/Rho 激酶信号,激活一氧化氮合酶,促进一氧化氮的释放,并最终舒张肝内血管,降低肝硬化导致的门脉高压。Pollo-Flores 等[21]在临床研究中证实,使用辛伐他汀后门脉高压患者肝静脉压力梯度平均降低20%以上。肝细胞癌是最常见的终末期肝病。Zhou 等[22]在一项meta 分析中发现,阿托伐他汀及氟伐他汀可显著降低肝癌发生风险。Wu 等[23]则发现,使用他汀类联合非手术治疗,可提高晚期肝癌患者的总体存活率。
综上所述,他汀类这一临床常用药物具有诸多独立于调节脂肪代谢的药理机制,在肝脏疾病的临床治疗中具有广阔的应用前景;但需要进一步明确药物在不同肝脏疾病中的具体作用机制,并在大规模前瞻性临床研究中加以证实,为包括肝硬化在内的多种肝脏疾病的治疗提供思路。
