长链非编码RNA TPT1-AS1促进肝癌细胞增殖、迁移、侵袭的作用研究
2022-01-27王斐斐何婷李炜孙琳曲凯姚忠强
王斐斐,何婷,李炜,孙琳,曲凯,姚忠强
肝细胞癌(hepatocellular carcinoma, HCC)是我国常见恶性肿瘤之一[1]。然而目前,HCC发生的分子机制尚未完全明确。长链非编码RNA(long non coding RNAs,LncRNAs)是长度大于200个核苷酸的非蛋白编码RNA,其在多种细胞的增殖、分化、转移等生物学行为中均发挥着重要作用[2-3]。研究表明,多种lncRNAs异常表达在HCC发生、进展中发挥了不同作用[4]。最近,一种新的LncRNA肿瘤蛋白翻译调节因子1反义-RNA1 (tumor protein translationally controlled 1 antisense RNA 1, TPT1-AS1)被发现与消化道肿瘤关系密切[5]。然而,目前TPT1-AS1在HCC中的临床意义和功能作用尚未被完全被揭示。基于此,本研究从HCC患者的肿瘤组织和体外肿瘤细胞系两个水平探讨了TPT1-AS1对HCC的影响,以期为进一步了解HCC发生的分子机制、开发HCC治疗新靶点提供理论基础,报道如下。
1 材料与方法
1.1 材料 (1)研究对象:2014年1月—2015年12月西安交通大学附属三二0一医院和附属第一医院对92例HCC患者手术切除治疗,留取肿瘤组织和相应癌旁(≥3 cm)正常肝组织在-80℃液氮中保存作为研究对象。HCC手术患者符合巴塞罗那临床肝癌(Barcelona clinic liver cancer,BCLC)临床分期要求,满足肝癌治疗指南手术切除标准[1];肝癌细胞HepG2和SNU-182、人肝永生化细胞THLE-3购自中科院上海生科院细胞资源中心。(2)试药试剂:RIPA裂解缓冲液、碘化丙锭PI染色液(上海碧云天生物科技有限公司);DMEM培养基(北京天恩泽生物技术有限公司);PrimeScript RT reagent Kit反转录试剂盒(日本Takara公司);周期蛋白依赖性激酶4 (cyclin-dependent kinases4, CDK4)、p21、E-cadherin、N-cadherin、Vimentin和GAPDH抗体 (英国Abcam公司);抗鼠二抗、抗兔二抗及GAPDH(武汉三鹰生物技术有限公司);TPT1-AS1和GAPDH引物(北京赛百盛基因技术有限公司合成)。2种靶向TPT1-AS1的siRNA(si-TPT1-AS1#1和si-TPT1-AS1#2),阴性对照siRNA (si-NC,苏州吉玛基因股份有限公司)。CCK-8细胞计数试剂盒(Sigma-Aldrich公司);转染试剂Lipofectamine 2000(中国赛默飞世尔公司)。(3)仪器设备:Transwell小室(上海索莱宝生物科技有限公司); Multiskan FC多功能酶标仪(美国Thermo Fisher公司),细胞培养箱(美国Thermo Fisher公司),ECLIPSE Ti-U荧光倒置显微镜(日本Nikon公司),流式细胞仪(美国BD FACSCantogo公司)。
1.2 实验方法 2018年9月—2020年6月于西安交通大学实验室进行细胞实验。分别比较HCC患者肝癌组织与癌旁正常肝脏组织,体外肝癌细胞与人肝永生化细胞之间TPT1-AS1表达差异。根据实时荧光定量PCR(qRT-PCR)测得全部患者肝癌组织TPT1-AS1相对表达水平中位数(3.38),将纳入HCC患者分为TPT1-AS1高表达组(≥3.38)和低表达组(<3.38),比较2组患者术后5年生存时间差异。利用qRT-PCR分别检测siRNA、si-NC转染HepG2和SNU-182细胞后TPT1-AS1基因表达情况。比较siRNA、si-NC转染后HepG2和SNU-182细胞的增殖、迁移、侵袭、上皮细胞间质转化(epithelial-mesenchymal transition, EMT)情况差异。
1.3 观测指标与方法
1.3.1 肿瘤组织与癌旁正常肝组织中RNA TPT1-AS1表达差异检测:使用TRIzol法从收集的肿瘤组织和对应癌旁正常肝组织及HepG2、SNU-182、THLE-3细胞中提取总RNA,并使用PrimeScriptTMRT reagent Kit进行反转录。利用ABI 7500 实时荧光定量PCR仪进行qRT-PCR扩增。相关引物序列如下:TPT1-AS1,上游引物:5' -AGCCTTGAGGCTATGCCCATC-3';下游引物:5' -AACAGTGTTTGGAGGCCTGAA-3';GAPDH,上游引物:5' -GCCCTCCGACACCCACTACTT-3';下游引物:5' -TGAATTCTGTAGCCACGTTGTCATA-3'。
1.3.2 CCK-8实验筛选转染HepG2和SNU-182细胞高效的siRNA:常规复苏冻存细胞后,分别将HepG2、SNU-182、THLE-3细胞均匀分散在含10%胎牛血清的DMEM培养基中培养,并在5%CO2、37℃恒温培养箱中培养24 h,至细胞融合率为70%~90%。按照细胞转染试剂盒说明,分别使用siRNA(si-TPT1-AS1#1和si-TPT1-AS1#2)和si-NC转染HepG2、SNU-182细胞。转染48 h后,以每孔3 000个细胞密度接种于96孔板上,分别于24、28、72 h向培养板加入 10 μl细胞悬液,孵育2h后,再加入10 μlCCK-8溶液,再次孵育2 h后使用酶标仪测定450 nm波长处吸光度。选择其中转染高效的siRNA进行后续研究。
1.3.3 细胞集落形成实验观测沉默TPT1-AS1基因对HepG2和SNU-182细胞生长能力: 将转染细胞以每孔500个细胞密度接种于6孔板中,在5% CO2、37℃条件下培养2周。形成的细胞集落用PBS浸洗2次,空气干燥后。使用70%甲醇固定,用0.1%结晶紫染色10 min。在显微镜下对集落数(>50个细胞)进行观察和计数。
1.3.4 沉默TPT1-AS1基因HepG2和SNU-182细胞周期测定:HepG2和SNU-182细胞转染si-TPT1-AS 48 h后,用预冷的PBS清洗细胞2次,并在70%乙醇、4℃条件下固定过夜。之后,清洗细胞离心去除上清液。用 RNase A溶液20 μl和0.2% Triton X-100在37℃孵育10 min,再用碘化丙锭PI染色液400 μl避光孵育。用流式细胞仪测定细胞周期。
1.3.5 划痕实验检测沉默TPT1-AS1基因后HepG2和SNU-182细胞迁移能力: 将转染HepG2和SNU-182细胞以每孔5×105个密度接种于6孔板。细胞单层融合后,用200 μl移液枪头垂直于6孔板制作划痕。分别于0 h和24 h用倒置荧光显微镜拍摄图像,利用Image J软件分别测量划痕区域宽度,并分别记录为H0和H24。根据公式:(H0-H24)/W0×100%计算相对迁移距离。
1.3.6 Transwell实验测定转染si-TPT1-AS1后HepG2和SNU-182细胞侵袭能力: Transwell上室加入Matrigel与无血清DMEM,后分别将5×104个转染后细胞悬液接种于上室每个小室中。在下室的24孔板中各加入DMEM完全培养基500 μl。孵育24 h后,下室细胞用4%多聚甲醇固定15 min,0.2%结晶紫染色30 min。每个Transwell小室随机选择5个区域拍摄并计数进行分析。
1.3.7 Western blot检测法检测CDK4、p21、CDK4、N-cadherin和Vimentin蛋白表达水平: 根据RIPA裂解缓冲液提取转染后HepG2和SNU-182细胞的总蛋白,并用BCA法测定蛋白浓度。经10%SDS-PAGE凝胶电泳分离后转膜,用5%脱脂牛奶封闭1 h,分别用加入CDK4、p21、E-cadherin、N-cadherin、Vimentin和GAPDH一抗体及二抗,TBST缓冲液洗涤后,使用电化学发显影剂显影。使用Image J软件对蛋白条带灰度分析,计算各蛋白相对表达量。
2 结 果
2.1 肝癌组织TPT1-AS1表达水平及其与预后比较 用qRT-PCR检测92例患者的肝癌组织及癌旁组织中TPT1-AS1的相对表达水平。与对应癌旁组织相比,肝癌组织TPT1-A1相对表达水平升高(3.14±0.29 vs. 1.00±0.00,t/P=54.065/0.000)。
根据qRT-PCR测得全部肝癌组织TPT1-AS1相对表达量中位数(3.38),将92例患者分为TPT1-AS1高表达组(n=46)和低表达组(n=46)。高表达组的BCLC分期C期比例、存在淋巴结转移比例高于低表达组(χ2/P=15.187/0.001,7.379/0.007),见表1。Kaplan-Meier生存分析显示,高表达组患者5年生存率低于低表达组 (χ2/P=7.354/0.007),见图1。
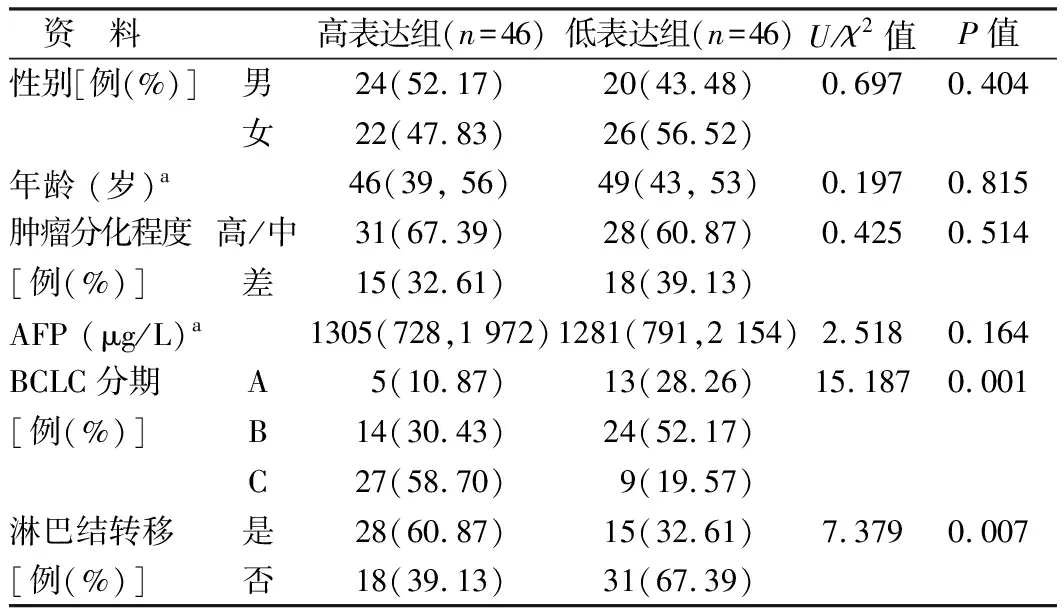
表1 肝癌患者92例不同TPT1-AS1表达水平临床特点比较Tab.1 Comparison of clinical characteristics of differentTPT1-AS1 expression levels in 92 patients with liver cancer

图1 肝癌组织中TPT1-AS1表达与患者结局关系
2.2 沉默TPT1-AS1对肝癌细胞增殖比较 HepG2和SNU-182细胞的TPT1-AS1相对表达水平分别为3.42±0.21和3.15±0.17,显著高于人肝永生化细胞THLE-3(1.00±0.00),差异有统计学意义(t=19.960、21.905,均P=0.000)。分别用siRNA和si-NC转染HepG2和SNU-182细胞后可见,与si-NC相比,si-TPT1-AS1#1和si-TPT1-AS1#2转染均可下调TPT1-AS1的表达。同时,si-TPT1-AS1#1和si-TPT1-AS1#2均对HepG2(图2A)和SNU-182细胞(图2B)的细胞活力均有明显抑制作用。由于si-TPT1-AS1#1比si-TPT1-AS1#2对TPT1-AS1和细胞活力的抑制作用更强,因此选择si-TPT1-AS1#1进行后续实验。使用si-TPT1-AS1#1转染HepG2和SNU-182细胞后,较si-NC转染的对应细胞集落数显著减少(分别为147.35±10.63、114.52±9.52和68.49±7.74、47.36±5.43,t=10.388、10.614,均P=0.000),见图2C。
2.3 沉默TPT1-AS1基因对肝癌细胞周期比较 使用si-TPT1-AS1#1转染HepG2 细胞后,G0/G1期细胞比例为(74.43±1.24)%,S期细胞比例为(12.82±0.76)%;使用si-NC转染后,G0/G1期细胞比例为(56.91±1.32)%,S期细胞比例为(27.15±0.53)%。使用si-TPT1-AS1#1转染SNU-18细胞后,G0/G1期细胞比例为(68.52±1.06)%,S期细胞比例为(31.08±1.27)%;使用si-NC转染后,G0/G1期细胞比例为(56.16±0.94)%,S期细胞比例为(17.85±1.62)%。使用si-TPT1-AS1转染HepG2和SNU-18细胞均较si-NC转染后,G0/G1期细胞比例均升高(t=16.756、15.111,P均=0.000),S期细胞比例均显著降低(t=26.788、11.132,P均=0.000),见图3。

注:A. CCK-8实验检测siRNA转染对HepG2细胞活力影响;B. CCK-8实验检测siRNA转染对SNU-182细胞活力影响;C. si-TPT1-AS1#1和si-NC转染HepG2、SNU-182细胞对细胞集落形成影响。与si-NC组比较,a P<0.05,b P<0.01
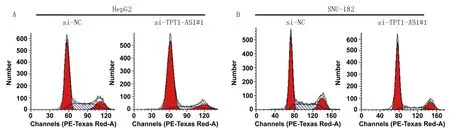
图3 流式细胞分析沉默TPT1-AS1对HepG2和SNU-182肝癌细胞细胞周期影响
2.4 沉默TPT1-AS1基因对肝癌细胞的迁移、侵袭能力比较 细胞划痕实验发现, 使用si-TPT1-AS1#1转染HepG2细胞和SNU-182细胞的相对迁移距离分别为(19.24%±1.36%)和(28.46%±1.63%),相同细胞si-NC转染后分别为(58.51%±1.62%)和(50.83%±1.29%),两者比较差异有统计学意义(t=32.153、18.640,均P=0.000),见图4A。Transwell实验结果可见使用si-TPT1-AS1#1转染HepG2细胞和SNU-18细胞后,较si-NC转染后穿透基底膜的细胞数量减少,见图4 B。
2.5 沉默TPT1-AS1基因对肝癌细胞的G1/S期转换及EMT相关蛋白比较 Western blot检测显示,使用si-TPT1-AS1#1转染HepG2和SNU-182细胞后,较si-NC转染后对应细胞的CDK4、N-cadherin和Vimentin的蛋白相对表达量下降(P均=0.000),而p21和E-cadherin的蛋白相对表达量增加(P均=0.000),见图5,表2。

表2 各组细胞CDK4、N-cadherin、Vimentin、p21和E-cadherin蛋白表达水平比较
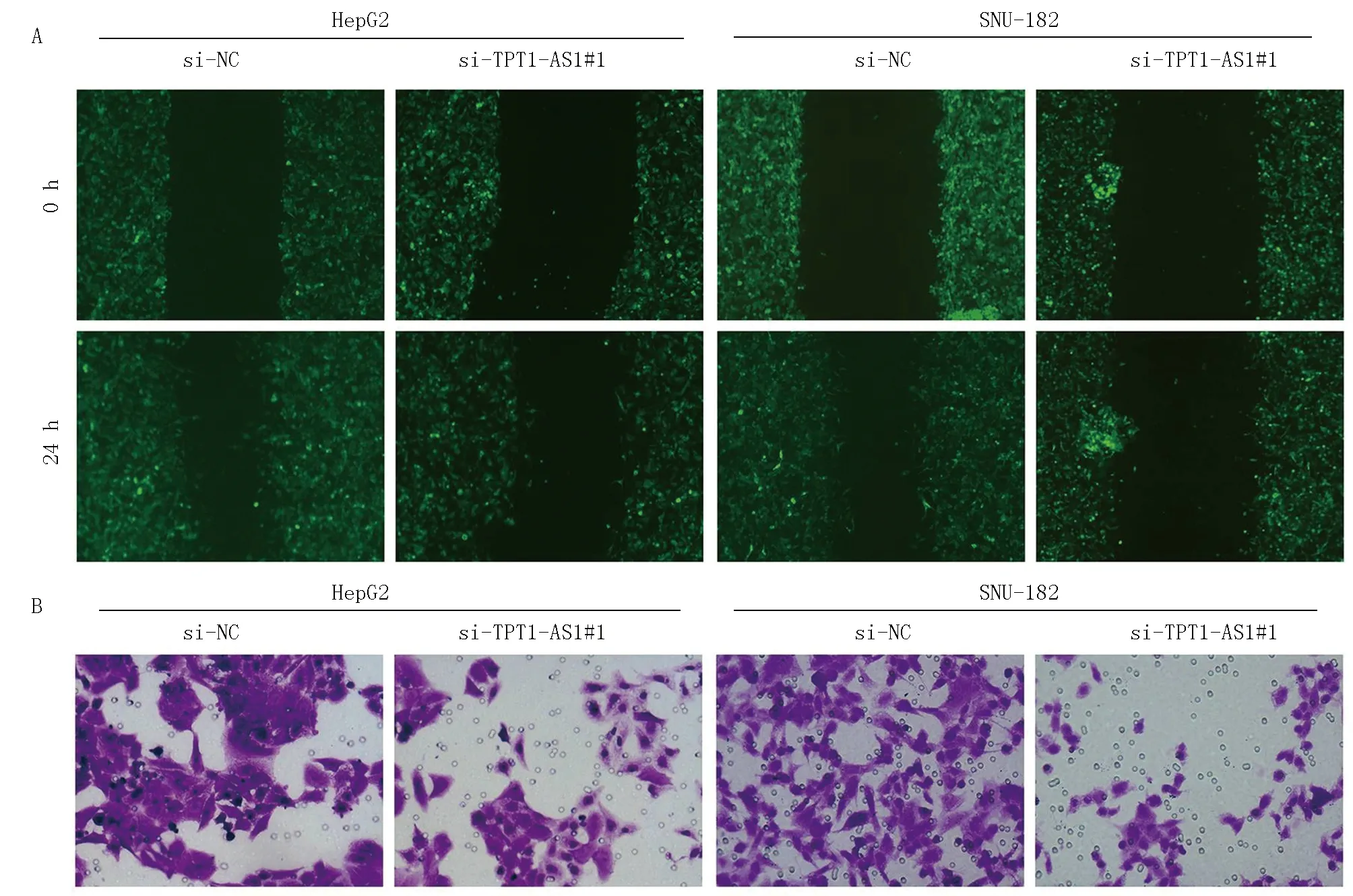
注:A.细胞划痕实验结果; B.Transwell实验分析细胞对侵袭能力(结晶紫染色,×200)

图5 沉默TPT1-AS1基因对HepG2和SNU-182肝癌细胞G1/S转换及EMT相关蛋白表达的影响
3 讨 论
近年来随着对肝癌发生分子机制了解的不断深入,众多lncRNA在HCC的诊断、治疗和预后判断中的作用逐渐被认识[6-7],这对今后进一步改善HCC治疗效果、减少复发、提高患者预后和生活质量具有重大意义。反义RNA对mRNA的稳定性、编码蛋白的翻译等方面发挥着关键的调节作用,它们大多在各种肿瘤细胞中大量表达[8-9]。目前已发现,MCM3AP-AS1、LASP1-AS1和DSCAM-AS1等多个反义RNA可能存在促癌作用[10-12]。反义RNA中的TPT1-A S1也是lncRNA家族中的一员,其在胃癌等许多消化道肿瘤中的功能和诊断作用已被证实[5]。为了探究TPT1-A1在HCC中发挥的具体作用和相关分子机制,本研究分别利用肝癌组织、癌旁组织和2种肝癌细胞进行了实验,以分析TPT1-A S1对于HCC细胞的增殖能力、迁移能力、侵袭能力、细胞周期及EMT影响。
由于lncRNA在HCC的发生、发展中起到的作用越来越受到重视,因此关于lncRNA在HCC中的研究已经成为热点。本结果证明肝癌组织和癌旁组织中lncRNA TPT1-AS1的表达量存在差异, TPT1-AS1高表达与肝癌患者BCLC分期和淋巴结转移存在密切关系,且患者5年生存率更低。既往研究已经证实,BCLC分期和淋巴结转移均是HCC患者预后不良的独立危险因素[13-14]。与TPT1-AS1低表达的患者比较,TPT1-AS1高表达患者的淋巴结转移发生率较高,这可能与TPT1-AS1可促进HCC细胞的转移、侵袭存在一定关系,为了验证这一假说,进行的体外细胞实验亦证明。
本研究发现当沉默TPT1-AS1表达时,可显著降低2种肝癌细胞的增殖、G1/S转换及迁移、侵袭能力。这提示,TPT1-AS1可能是一种癌基因,在HCC的发生、发展中起到一定作用。这与关于TPT1-AS1在卵巢癌、胃癌细胞系等不同的研究,所得结论类似[15-16]。沉默TPT1-AS1基因后肝癌细胞中G0/G1期细胞比例明显升高,G1/S期转换及EMT相关蛋白明显被抑制。
本研究通过使用Western blot技术分析了沉默TPT1-AS1基因影响肝癌细胞恶性行为的可能分子机制。当沉默TPT1-AS1基因表达后,肝癌细胞中的CDK4的表达降低,而p21蛋白表达上调。CDK4和CDK抑制剂p21在细胞周期G1/S转换中起重要作用,是目前反映肿瘤细胞增殖的常用标志物[17]。有国内学者发现[18],敲除胃癌细胞TPT1-AS1基因后细胞的G1/S转化、增殖均受抑制,且与CDK4表达减少、p21表达增加有关。细胞增殖与细胞周期间存在密切关系。本结果表明沉默TPT1-AS1基因后可能通过调节CDK4/p21的表达,进而诱导体外肝癌细胞停留在G0/G1期,从而抑制肝癌细胞的增殖。
细胞上皮细胞间质转化是肿瘤侵袭和转移的关键机制[19]。本研究中也观察到,沉默TPT1-AS1表达后对肝癌细胞的EMT也可产生抑制作用。其中,上皮细胞标志物E-cadherin表达增加,间质细胞标记物N-cadherin和Vimentin表达降低。提示沉默沉默TPT1-AS后可抑制体外肝癌细胞的EMT。近年来有研究报道,敲除或沉默HOXA-AS2[20]和SBF2-AS1[21]等lncRNAs,可通过抑制EMT而抑制肝癌细胞的迁移和侵袭。也有报道体外胃癌细胞中沉默TPT1-AS1基因对E-cadherin和Vimentin的调节作用[5]。上述结果都提示,TPT1-AS1对肝癌细胞增殖和转移起抑制作用。由于本研究受到条件所限,并未开展上调TPT1-AS1对HCC生物学行为的研究,有待进一步的研究。
综上所述, TPT1-AS1与肝癌患者的分期较差、淋巴转移和5年生存率降低相关,可通过影响细胞周期转换和EMT相关指标,促进肝癌细胞的增殖、迁移、侵袭和EMT的发生。本研究结论仍需要更多的在体研究和临床观察以进一步证实,但本研究的结论仍能够为今后肝癌治疗提供一个潜在治疗靶点。
利益冲突:所有作者声明无利益冲突
作者贡献声明
王斐斐:设计研究方案,实施研究过程,进行统计学分析,论文撰写;何婷:提出研究思路,实施研究过程;李炜:实施研究过程,资料搜集整理,论文修改;孙琳:资料搜集整理,论文修改;曲凯:资料搜集整理,论文修改;姚忠强:设计研究方案,进行统计学分析,论文审核
