抗凝血酶Ⅲ活性联合CLIF-C OFs评分对HBV相关慢加急性肝衰竭患者预后的评估价值
2022-01-27张蕾贺建勋范雪松何立娟闫树凤崔颖袁慧
张蕾,贺建勋,范雪松,何立娟,闫树凤,崔颖,袁慧
慢加急性肝衰竭是在慢性肝疾病基础上,短期内肝功能急性或亚急性失代偿的一种临床症候群,乙型肝炎病毒感染是我国慢加急性肝衰竭发生主要原因,乙型肝炎病毒相关慢加急性肝衰竭(hepatitis B virus-acute-on-chronic liver failure,HBV-ACLF)占所有肝衰竭的70%[1-2]。HBV-ACLF起病急、进展快,短期内可出现多器官功能衰竭,早期评估其预后尤为关键。慢性肝功能衰竭联盟—器官功能衰竭评分(Chronic Liver Failure Consortium-organ failure score,CLIF-C OFs)常用于评估慢性肝衰竭的预后,但全球各地慢性肝病的基础和诱因存在差异,关于CLIF-C OFs评分对我国HBV-ACLF的应用价值还需进一步研究。研究表明,凝血功能障碍与肝衰竭患者临床转归密切相关[3]。抗凝血酶Ⅲ是血浆中重要的抗凝血因子,承担人体60%~70%的生理性抗凝活性,有研究报道,抗凝血酶Ⅲ活性与肝移植患者术后肝功能发生障碍及其1年和3年的总生存率相关[4]。但关于抗凝血酶Ⅲ活性与HBV-ACLF患者预后的关系尚不明确。本研究旨在探讨抗凝血酶Ⅲ活性联合CLIF-C OFs评分对HBV-ACLF患者预后的评估价值,以指导临床早期判断患者死亡风险,选择合适的治疗手段,报道如下。
1 资料与方法
1.1 临床资料 选取2019年8月—2021年5月首都医科大学附属北京安贞医院急诊危重症中心收治HBV-ACLF患者243例,其中男173例,女70例;年龄35~85岁,中位数52.00(47.00,57.00)岁;病程2~14年,中位数8.00(6.00,9.00)年;诱因:HBV活动222例,细菌感染75例,情绪/劳累53例,药物/手术26例,其他19例;合并症:上消化道出血7例,腹水146例,感染70例,肝性脑病35例,肝硬化53例;分期:早期107例,中期63例,晚期73例;基础病:糖尿病53例,高血压74例,高脂血症44例;吸烟(≥1支/d,连续吸烟≥6个月) 83例;饮酒47例(男性饮酒折合乙醇量≥40 g/d,女性饮酒折合乙醇量≥20 g/d,连续饮酒≥6个月);乙型肝炎家族史96例。本研究经医院伦理委员会批准(伦审字2020-02-102号),患者或家属均知情同意并签署知情同意书。
1.2 病例选择标准 (1)纳入标准:①符合“肝衰竭诊治指南(2018年版) ”[5]中ACLF诊断标准;②乙型肝炎病毒表面抗原和/或乙型肝炎病毒脱氧核糖核酸阳性>6个月;③年龄18~85岁;④临床资料完整。(2)排除标准:①恶性肿瘤者;②血液系统疾病者;③严重心脑血管疾病者;④慢性、亚急性、急性肝衰竭者;⑤合并人类免疫缺陷病毒、巨细胞病毒、其他肝炎病毒感染者;⑥寄生虫性、中毒性、酒精性、药物性、自身免疫性等其他病因导致的ACLF;⑦妊娠期或哺乳期妇女;⑧入组前接受抗病毒治疗者。
1.3 观测指标与方法
1.3.1 基础资料收集:收集患者基础资料,包括性别、年龄、并发症和入院时白细胞计数、红细胞计数、血小板计数、中性粒细胞百分比、血肌酐、丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、碱性磷酸酶、γ-谷氨酰转移酶、总胆汁酸、总胆红素、乙肝表面抗原(hepatitis B surface antigen,HBsAg)定量。
1.3.2 抗凝血酶Ⅲ活性测定:入院时采集患者肘静脉血2.7 ml,枸橼酸钠抗凝,离心取血浆,采用发色底物法测定抗凝血酶Ⅲ活性。
1.3.3 CLIF-C OFs评分计算:患者入院后行CLIF-C OFs评分,包括肝脏、肾脏、神经、凝血、循环、呼吸共6个器官/系统,各器官/系统分值1~3分,总分6~18分,得分越高器官/系统衰竭越严重[6]。
1.4 病情和预后评估 参考“肝衰竭诊治指南(2018年版) ”[5]评估患者入院后的病情,将其分为早期组107例、中期组63例、晚期组73例,并根据指南进行抗病毒、保肝、退黄、调节免疫、促肝细胞生长等综合治疗,以入院时为起点,将60 d内死亡或病情恶化濒临死亡者纳入死亡组53例,病情稳定或好转出院者纳入存活组190例。

2 结 果
2.1 不同病情HBV-ACLF患者抗凝血酶Ⅲ活性和CLIF-C OFs评分比较 早期组、中期组、晚期组抗凝血酶Ⅲ活性依次降低,CLIF-C OFs评分依次升高(P<0.01),见表1。

表1 不同病情HBV-ACLF患者抗凝血酶Ⅲ活性和CLIF-C OFs评分比较 [M(Q1,Q3)]
2.2 不同预后HBV-ACLF患者抗凝血酶Ⅲ活性和CLIF-C OFs评分比较 死亡组抗凝血酶Ⅲ活性低于存活组,CLIF-C OFs评分高于存活组(P<0.05),见表2。

表2 不同预后HBV-ACLF患者抗凝血酶Ⅲ活性和CLIF-C OFs评分比较 [M(Q1,Q3)]
2.3 不同预后HBV-ACLF患者临床资料比较 死亡组中性粒细胞比值、总胆红素、HBsAg水平高于存活组 (P<0.05),见表3。

表3 不同预后HBV-ACLF患者临床资料比较
2.4 HBV-ACLF患者预后影响因素的多因素Logistic回归分析 以中性粒细胞比值、总胆红素、HBsAg、抗凝血酶Ⅲ活性、CLIF-C OFs评分为自变量(均原值录入),预后情况(不良=1,良好=0)为因变量,多因素Logistic回归分析显示,高中性粒细胞比值、高HBsAg、高CLIF-C OFs评分为HBV-ACLF患者预后不良的独立危险因素,高抗凝血酶Ⅲ活性为独立保护因素(P<0.05),见表4。
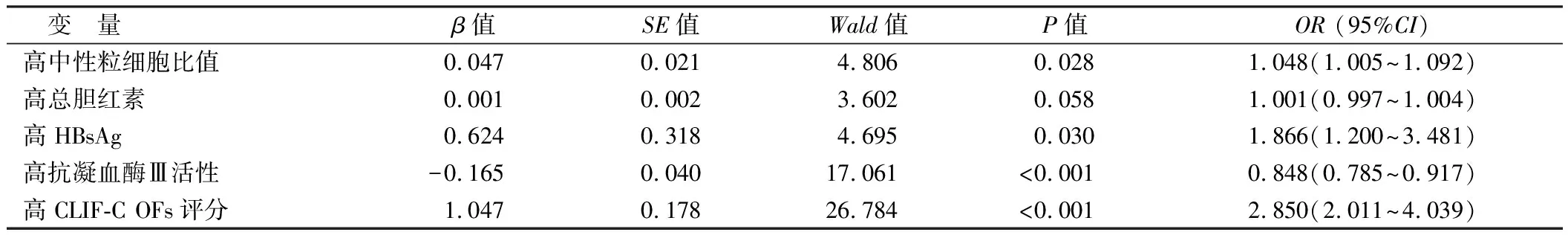
表4 HBV-ACLF患者预后影响因素的多因素Logistic回归分析
2.5 抗凝血酶Ⅲ活性联合CLIF-C OFs评分对HBV-ACLF患者预后不良的评估价值 ROC曲线显示,抗凝血酶Ⅲ活性联合CLIF-C OFs评分评估HBV-ACLF患者预后不良的AUC大于各指标单独预测的结果(Z=3.655、2.912,P=0.000、0.004),见表5、图1。

表5 抗凝血酶Ⅲ活性联合CLIF-C OFs评分对HBV-ACLF患者预后不良的评估价值

图1 抗凝血酶Ⅲ活性联合CLIF-C OFs评分评估HBV-ACLF患者预后不良的ROC曲线
3 讨 论
HBV-ACLF是因乙型肝炎病毒大量复制和/或病毒突变诱导机体产生免疫反应,通过多种免疫细胞活化诱导产生多种细胞因子引起的全身炎性反应[6]。目前关于HBV-ACLF的发病机制尚未完全明确,内科治疗缺乏特效的药物和手段,肝移植仍然是目前最有效的治疗手段之一,但受限于肝源和价格,大多患者病情随着进展最终引起多系统器官衰竭,预后极差,早期评估预后及时给予治疗,可促使疾病进入稳定平台期或缓解,改善患者生活质量。
为评估慢加急性肝衰竭预后,2013年欧洲肝脏研究学会—慢性肝衰竭联盟基于12个欧洲国家1 343例肝硬化急性失代偿患者的CANONIC队列研究(多中心临床注册研究),在序贯器官衰竭评估评分基础上建立了CLIF-序贯器官衰竭评估,并证实该评分可作为慢加急性肝衰竭患者病情进展和死亡的评估指标[7]。但CLIF-序贯器官衰竭评估较为复杂,不能快速进行评估,故2014年欧洲肝脏研究学会—慢性肝衰竭联盟又基于CLIF-序贯器官衰竭评估建立了简化的CLIF-C OFs评分,简单易行并能较好地评估各器官的情况[6]。目前已有多项国内外研究报道,CLIF-C OFs评分升高是HBV-ACLF患者死亡的独立危险因素[8-10]。本研究亦证实,CLIF-C OFs评分会增加HBV-ACLF患者预后不良风险,但单独CLIF-C OFs评分评估HBV-ACLF患者预后不良的AUC不足0.80,较高于国内Chen等[9]报道的0.674和苗静等[10]报道0.662,可能与各研究对预后时间定义不同和病例选择差异有关,但总体而言CLIF-C OFs评分对HBV-ACLF患者预后不良的评估价值并不理想。考虑原因是CLIF-C OFs评分是基于欧洲国家患者建立,可能存在种族差异,同时HBV-ACLF可以发生于伴或不伴有肝硬化慢性肝病患者中,而CLIF-C OFs评分是基于肝硬化急性失代偿患者建立,也可能影响CLIF-C OFs评分准确度,因此,考虑通过联合其他危险因素提升预后评估价值。
肝脏是合成凝血因子和抗凝血因子的主要器官,HBV-ACLF患者因肝脏损伤,凝血因子合成减少可引起凝血功能障碍,主要表现为凝血时间延长[11]。抗凝血酶Ⅲ是肝脏合成的糖蛋白,能作为天然抗凝剂和凝血酶及Ⅸa、Ⅹa、Ⅺa、Ⅻa等其他凝血级联成分的主要抑制剂,抗凝血酶Ⅲ的缺乏或活性降低会降低抗凝作用,增加血栓形成或栓塞风险[12]。临床中肝功能障碍和严重肝病患者抗凝血酶Ⅲ活性明显降低,常需使用肝素加速抗凝血酶Ⅲ与凝血因子Ⅱ结合形成抗凝血酶Ⅲ凝血酶复合物,以发挥凝血酶失活作用[13]。乐华文等[14]研究发现,抗凝血酶Ⅲ活性随着慢性乙型肝炎病情的进展而逐渐下降。Hoefer等[15]研究报道,抗凝血酶Ⅲ活性降低是终末期心力衰竭并发急性肝衰竭的危险因素。Logston等[16]研究报道,补充抗凝血酶Ⅲ具有保护肝细胞和减轻炎性反应作用。这些研究提示,抗凝血酶Ⅲ活性降低可能影响HBV-ACLF患者预后,本研究结果也证实,HBV-ACLF患者随着病情加重凝血功能障碍加重,考虑是HBV-ACLF因肝脏受损导致抗凝血酶Ⅲ合成减少,同时随着抗凝血酶Ⅲ合成减少和活性降低,不足以抑制凝血酶原及其因子合成,增加凝血酶原及其因子水平,进一步抑制抗凝血酶Ⅲ合成[12-13]。同时本研究发现,预后不良HBV-ACLF患者抗凝血酶Ⅲ活性低于预后良好患者,并证实抗凝血酶Ⅲ活性降低是预后不良的独立危险因素,说明抗凝血酶Ⅲ活性可能成为HBV-ACLF预后不良评估指标。ROC曲线结果亦证实抗凝血酶Ⅲ可以评估HBV-ACLF患者预后不良,且联合CLIF-C OFs评分能提升评估价值。
综上所述,抗凝血酶Ⅲ活性降低和CLIF-C OFs评分升高与HBV-ACLF患者病情加重和预后不良相关,抗凝血酶Ⅲ活性联合CLIF-C OFs评分能提升HBV-ACLF预后不良评估价值。但本研究为单中心小样本研究,同时受时间限制,仅分析了HBV-ACLF患者短期预后,未来还将扩大样本量和延长预后评估时间。
利益冲突:所有作者声明无利益冲突
作者贡献声明
张蕾、贺建勋:设计研究方案、实施研究过程、论文撰写;范雪松:提出研究思路、分析试验数据;何立娟:进行统计学分析、论文修改;闫树凤、崔颖:实施研究过程、资料搜集整理、论文修改;袁慧:论文审核
