脑脉利颗粒对大鼠下肢动脉硬化闭塞症影响的研究
2022-01-26娄雅静秦引林
苏 梅,娄雅静,王 姗,秦引林
(江苏柯菲平医药股份有限公司,江苏 南京 210016)
动脉硬化闭塞症(Arteriosclerosis obliterans,ASO)是在动脉粥样硬化基础上发展而来的慢性动脉闭塞疾病,多见于下肢动脉,可引起间歇性跛行、静息痛、溃疡、坏疽[1-2]。ASO 多发生于50 岁以上人群,发病率约0.74%,严重威胁着人们的健康生活[3],迫切需要寻找一种安全有效的治疗方法。ASO 的病因尚未明确,目前普遍认为脂质代谢紊乱、血管内皮损伤及炎症反应激活是ASO 发生发展过程中最基本的病理环节,能够促进动脉硬化、加剧管腔狭窄[4-6]。针对性的进行内皮保护、抗炎和降血脂治疗是目前ASO 干预的主要靶点。因此,寻找一种具有内皮保护、抗炎和降脂作用的药物来治疗ASO 可能是一种有效的策略。同时,《下肢动脉硬化闭塞症诊治指南》的中医中药治疗指出[7],中医以辨证论治为主,活血化瘀法贯穿始终,配合活血化瘀药物,以建立侧支循环,改善肢体血运。
脑脉利颗粒是以三七、黄芪、川穹、红花、丹参、当归、益母草等组成的中药复方制剂。组方中三七、姜黄、丹参、川芎、红花等具有很好的抗炎、活血祛瘀的作用,白芍、三七、丹参、益母草等对血管内皮有一定的保护作用,其抗炎、活血祛瘀和改善血管内皮功能的作用与治疗ASO 的策略较为契合[8]。目前脑脉利颗粒在临床上用于治疗气虚血瘀型脑卒中病中经络急性期,改善半身不遂、偏身麻木、口舌歪斜、语言蹇涩等症状[8-9]。但是关于脑脉利颗粒在治疗ASO 方面的研究尚未见报道。因此,本研究建立了高脂饲料喂养加隐动脉内膜损伤的药效模型,通过检测下肢动脉血流情况、下肢动脉狭窄情况以及血清中血脂水平、炎症因子和血管内皮相关指标来研究脑脉利颗粒治疗ASO 的药理作用,为临床提供更有价值的数据支持。
1 材料与方法
1.1 材料
1.1.1 实验药物 脑脉利颗粒( 批号:11-191010,南京柯菲平盛辉制药有限公司);西洛他唑片(批号:200704P,浙江大冢制药有限公司)。
1.1.2 实验动物 SPF 级成年雄性SD 大鼠,体质量为(200 ± 20)g,购自杭州医学院,实验动物生产许可证号:SCXK(浙)2019-0002。
1.1.3 试剂 甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)、一氧化氮(NO)检测试剂盒,肿瘤坏死因子α(TNF-α)、白介素1β(IL-1β)、白介素6(IL-6)、血管内皮生长因子(VEGF)和内皮素(ET-1) 酶联免疫检测试剂盒均购自索莱宝生物科技有限公司。
1.1.4 仪器 LEGEND Micro 21R 型微量离心机(美国赛默飞世尓科技公司);Heracell 型150i CO2培养箱 (美国赛默飞世尓科技公司);CX21 型奥林巴斯显微镜(日本奥林巴斯医疗公司);moorFLPI-2 型激光散斑血流成像系统(英国摩尔仪器)。
1.2 方法
1.2.1 建立大鼠ASO 模型 采用高脂饮食加隐动脉内膜损伤的方法制作大鼠ASO 模型。SD 大鼠适应性喂养1 周后,1%戊苯巴比妥钠(1 mL/200 g)腹腔注射麻醉,麻醉成功后,固定于手术台上。每只大鼠均取左后肢消毒。从腹股沟中点向膝下纵行切开皮肤,分离并暴露股动脉至膝部腘动脉分叉处,用小动脉夹阻断股动脉远、近端共1.5 ~ 2.0 cm,取0.1 mL 注射器1 支,接特制玻璃穿刺针沿股动脉血管长轴从近端刺入,将0.2 ~ 0.3 mL 注射用无菌蒸馏水缓慢注入阻断部位血管,至血管充盈为止。5 min后取下针头和动脉夹,止血、缝合。同时给予维生素D3(30 万U/kg),右后肢肌肉注射,1 次/月,共计12 周。
1.2.2 实验分组 24 只成年雄性SD 大鼠被随机分为:假手术组、ASO 模型组、脑脉利颗粒低剂量组(100 mg/kg)、脑脉利颗粒高剂量组(300 mg/kg)和西洛他唑组(10 mg/kg)。假手术组:大鼠麻醉后,切开下肢皮肤,分离并暴露隐动脉,不进行隐动脉内膜损伤手术,缝合手术伤口。每天灌胃蒸馏水1 次,喂食正常基础饲料12 周。ASO 模型组:大鼠麻醉后,切开下肢皮肤,分离并暴露隐动脉,进行隐动脉内膜损伤手术,缝合手术伤口,喂食高脂饲料4 周后,开始每天灌胃蒸馏水1 次,并继续喂食高脂饲料8 周。脑脉利颗粒低剂量组:大鼠麻醉后,切开下肢皮肤,分离并暴露隐动脉,进行隐动脉内膜损伤手术,缝合手术伤口,喂食高脂饲料4 周后,开始每天灌胃脑脉利颗粒药液1 次(给药量:100 mg/kg),并继续喂食高脂饲料8 周。脑脉利颗粒高剂量组:大鼠麻醉后,切开下肢皮肤,分离并暴露隐动脉,进行隐动脉内膜损伤手术,缝合手术伤口,喂食高脂饲料4周后,开始每天灌胃脑脉利颗粒药液1 次(给药量:300 mg/kg),并继续喂食高脂饲料8 周。西洛他唑组:大鼠麻醉后,切开下肢皮肤,分离并暴露隐动脉,进行隐动脉内膜损伤手术,缝合手术伤口,喂食高脂饲料4 周后,开始每天灌胃西洛他唑药液1 次(给药量:10 mg/kg),并继续喂食高脂饲料8 周。
1.2.3 检测下肢动脉平均血流速度 喂食12 周后,使用异氟烷麻醉大鼠,大鼠麻醉后,对大鼠左后肢进行脱毛处理。完成脱毛后,使用激光散斑血流成像系统检测各组大鼠下肢动脉血流情况。
1.2.4 检测下肢动脉血管狭窄 喂食12 周后,使用戊苯巴比妥钠麻醉大鼠,大鼠麻醉后,处死大鼠,并取出左后肢动脉,固定于多聚甲醛中,通过HE 染色和EVG 染色观察各组大鼠下肢动脉狭窄。
1.2.5 检测脂质水平 喂食12 周后,使用戊苯巴比妥钠麻醉大鼠,大鼠麻醉后,眼眶取血,离心,收集血清,并将血清保存在-20 ℃中备用。分别使用TG、TC、LDL 和HDL 试剂盒检测血清中TG、TC、LDL 和HDL 的含量。
1.2.6 检测炎症因子水平 喂食12 周后,使用戊苯巴比妥钠麻醉大鼠,大鼠麻醉后,眼眶取血,离心,收集血清,并将血清保存在-20 ℃中备用。分别使用TNF-α、IL-1β 和IL-6 酶联免疫检测试剂盒检测血清中TNF-α、IL-1β 和IL-6 的含量。
1.2.7 检测血管内皮功能 通过检测血清中NO、VEGF 和ET-1 水平来反应各组大鼠血管内皮功能状况。喂食12 周后,使用戊苯巴比妥钠麻醉大鼠,大鼠麻醉后,眼眶取血,离心,收集血清,并将血清保存在-20 ℃中备用。分别使用NO 含量检测试剂盒、VEGF 和ET-1 酶联免疫试剂盒检测血清中NO、VEGF 和ET-1 的含量。
1.2.8 统计学方法 用GraphPad Prism 8.0.1 软件进行数据分析,计量资料用均数±标准差 (x±s)表示,多组间比较采用方差分析,两组间比较采用t检验。以P<0.05 为差异具有统计学意义。
2 结果与分析
2.1 脑脉利颗粒对下肢动脉硬化闭塞症大鼠的下肢动脉血流速度的影响
与假手术组相比,ASO 模型组血流速度明显降低(P<0.01),表明造模成功。与ASO 模型组相比,脑脉利颗粒组和西洛他唑组大鼠下肢动脉血流速度均明显升高(P<0.01),高剂量的脑脉利颗粒的药效与西洛他唑相比,差异无统计学意义(P>0.05),见图1、表1。

图1 各组动物下肢动脉血流速度图的比较Fig. 1 Comparison of lower limb arterial blood rate in each group
表1 各组动物下肢动脉血流速度比较结果(±s,n = 6)Tab. 1 Comparison of lower limb arterial blood rate in each group(±s,n = 6)

表1 各组动物下肢动脉血流速度比较结果(±s,n = 6)Tab. 1 Comparison of lower limb arterial blood rate in each group(±s,n = 6)
注:模型组与假手术组相比,##P <0.01;各给药组与ASO 模型组相比,**P <0.01。
组别平均血流速度/(mm/s)假手术组254.18 ± 18.88 ASO 模型组 35.29 ± 4.53##脑脉利颗粒低剂量组 140.79 ± 14.20**脑脉利颗粒高剂量组 240.79 ± 20.28**西洛他唑组 214.24 ± 16.33**F 65.260 P 0.000
2.2 脑脉利颗粒对下肢动脉硬化闭塞症大鼠的下肢动脉狭窄症状的影响
与假手术组相比,ASO 模型组大鼠下肢动脉出现严重的狭窄的现象。与ASO 模型组相比,脑脉利颗粒组和西洛他唑组都可以减轻下肢动脉硬化闭塞症大鼠的下肢动脉狭窄,脑脉利颗粒高剂量组的药效与西洛他唑组相当,各组HE 染色和EVG 染色结果,分别见图2、图3。

图2 各组HE 染色结果Fig. 2 The results of hematoxylin-eosin stain in each group
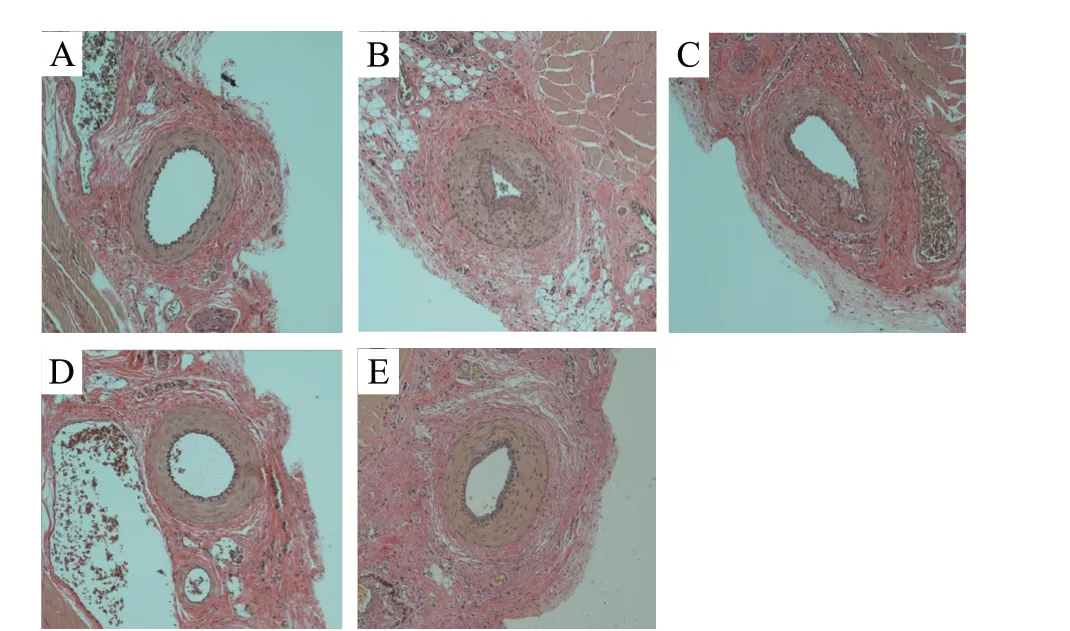
图3 各组EVG 染色结果Fig. 3 The results of elastic van gieson stain in each group
2.3 脑脉利颗粒对下肢动脉硬化闭塞症大鼠的血脂紊乱现象的影响
与假手术组相比,ASO 模型组大鼠的TC、TG 和LDL 均明显升高(P<0.01),而HDL 明显降低(P<0.01),表明造模成功。与ASO 模型组相比,脑脉利颗粒组和西洛他唑组大鼠的TC、TG 和LDL 含量均降低(P<0.05),HDL 含量升高(P<0.05)。脑脉利颗粒高剂量组对ASO 大鼠血脂紊乱改善的药效与西洛他唑组相比,差异无统计学意义(P>0.05),见表2。
表2 各组动物血脂水平比较(±s,mmol/L,n = 6)Tab. 2 Comparison of blood lipid levels in each group (±s,mmol/L,n = 6)

表2 各组动物血脂水平比较(±s,mmol/L,n = 6)Tab. 2 Comparison of blood lipid levels in each group (±s,mmol/L,n = 6)
注:模型组与假手术组相比,##P <0.01;各给药组与ASO 模型组相比,*P <0.05,**P <0.01。
组别TCTGLDLHDL假手术组3.52 ± 0.320.62 ± 0.05162.55 ± 14.4593.97 ± 4.99 ASO 模型组 7.56 ± 0.57## 0.96 ± 0.06## 339.26 ± 23.89## 65.41 ± 5.49##脑脉利颗粒低剂量组 5.85 ± 0.15** 0.76 ± 0.02* 278.21 ± 16.02*77.34 ± 3.16脑脉利颗粒高剂量组 4.63 ± 0.45** 0.67 ± 0.04** 206.42 ± 14.20** 86.35 ± 4.96**西洛他唑组 4.21 ± 0.35** 0.72 ± 0.03** 235.12 ± 15.58** 83.28 ± 5.96*F 33.26019.06064.97010.440 P 0.000 0.000 0.000 0.001
2.4 脑脉利颗粒对下肢动脉硬化闭塞症大鼠血清中炎症因子水平的影响
与假手术组相比,ASO 模型组大鼠的TNF-α、IL-1β 和IL-6 均明显升高(P<0.01),表明造模成功;与ASO 模型组相比,脑脉利颗粒组和西洛他唑组大鼠的TNF-α、IL-1β 和IL-6 含量明显降低 (P<0.01),脑脉利颗粒高剂量组药效与西洛他唑组相比,差异无统计学意义(P>0.05),见表3。
表3 各组动物体内炎症因子水平比较(±s,ng/L,n = 6)Tab. 3 Comparison of inflammatory factors levels in each group (±s,ng/L,n = 6)

表3 各组动物体内炎症因子水平比较(±s,ng/L,n = 6)Tab. 3 Comparison of inflammatory factors levels in each group (±s,ng/L,n = 6)
注:模型组与假手术组相比,##P <0.01;各给药组与ASO 模型组相比,**P <0.01。
组别TNF-α IL-1β IL-6假手术组157.23 ± 11.4189.74 ± 9.2096.83 ± 6.53 ASO 模型组 503.58 ± 18.96## 211.32 ± 12.84## 236.83 ± 10.39##脑脉利颗粒低剂量组 300.12 ± 22.07** 170.66 ± 6.71** 163.50 ± 10.17**脑脉利颗粒高剂量组 260.43 ± 25.85** 117.32 ± 10.29** 128.05 ± 11.30**西洛他唑组 290.21 ± 23.70** 136.89 ± 7.09** 133.89 ± 11.71**F 71.87049.61054.260 P 0.000 0.000 0.000
2.5 脑脉利颗粒对下肢动脉硬化闭塞症大鼠的血管内皮功能紊乱的影响
与假手术组相比,ASO 模型组大鼠的NO 和VEGF 均明显降低 (P<0.01);而ET-1 明显升高(P<0.01),表明造模成功;与ASO 模型组相比,脑脉利颗粒组和西洛他唑组大鼠的NO 和VEGF 含量均升高(P<0.05),ET-1 含量明显降低(P<0.01)。脑脉利颗粒高剂量组对ASO 大鼠血管内皮功能紊乱改善的药效与西洛他唑组相比,差异无统计学意义(P>0.05),见表4。
表4 各组动物血管内皮功能相关指标检测结果(±s,n = 6)Tab. 4 The results of related indexes of vascular endothelial function in each group(±s,n = 6)

表4 各组动物血管内皮功能相关指标检测结果(±s,n = 6)Tab. 4 The results of related indexes of vascular endothelial function in each group(±s,n = 6)
注:模型组与假手术组相比,#P <0.05,##P <0.01;各给药组与ASO 模型组相比,*P <0.05,**P <0.01。
组别NO/ (μmol/L)ET-1/ (ng/L)VEGF/ (ng/L)假手术组21.44 ± 2.6427.10 ± 2.0939.39 ± 1.93 ASO 模型组 12.44 ± 2.10## 82.67 ± 4.46## 20.75 ± 2.50##脑脉利颗粒低剂量组 17.18 ± 1.13* 53.97 ± 7.81**27.81 ± 2.08脑脉利颗粒高剂量组 19.51 ± 0.63** 46.65 ± 4.06** 33.89 ± 3.73**西洛他唑组 18.19 ± 0.45* 49.32 ± 4.36** 31.74 ± 3.56*F 8.58333.09011.950 P 0.003 0.000 0.000
3 讨论
实验结果显示,与假手术组相比,模型组大鼠下肢动脉血管内膜损伤并异常增殖,造成血管狭窄、平均血流速度下降;血清中的NO 和VEGF 含量降低,ET-1 含量升高,炎症水平升高;脂质代谢紊乱,说明造模成功,可用于脑脉利颗粒对于大鼠下肢动脉硬化闭塞症治疗效果的评估。
与模型组相比,脑脉利颗粒组可以升高下肢动脉血流速度,同时HE 和EVG 染色结果显示脑脉利颗粒组均可有效改善下肢动脉狭窄,从而改善血循环和肢体血运,达到舒经活络的目的。临床上,改善下肢动脉硬化闭塞症患者血流速度和血管内径,可提高临床疗效[10]。
研究表明,动脉硬化闭塞症的发展历程为氧化型LDL 沉积于动脉内膜下(损伤处尤为明显),与巨噬细胞及血管平滑肌细胞表面的清道夫受体结合,致使细胞内脂质堆积,形成泡沫细胞,并与内皮损伤相互作用,导致以TNF-α 和IL-6 为代表的炎性因子异常释放,进一步引起平滑肌细胞异常表达及迁移增生,加重动脉硬化闭塞症的症状[11-12],巨噬细胞内的氧化型LDL 堆积,还可以诱发ET-1 大量释放,加速疾病进程[13]。脑脉利颗粒组可以有效降低血清中TC、TG 和LDL 含量,升高血清中HDL 含量,并降低血清中TNF-α、IL-1β 和IL-6 炎症因子水平,提示脑脉利颗粒通过减少动脉血管中的脂质沉积、抑制炎症反应,减缓动脉硬化闭塞症的发展进程。脑脉利颗粒组还可以有效升高血清中NO 和VEGF 含量,降低血清中ET-1 含量。提示脑脉利颗粒组通过对NO、ET-1 和VEGF 含量的调节发挥抗自由基和促进血管新生的作用,进而改善血管内皮功能紊乱的情况。临床上NO、ET-1 的水平对于预测血管再狭窄的发生及判断预后具有重要价值[14-15]。
《下肢动脉硬化闭塞症诊治指南》[7]指出,西洛他唑为治疗间歇性跛行的一线药物,实验结果表明,脑脉利颗粒高剂量组升高血流速度,改善下肢动脉狭窄,降低血清中TC、TG、LDL、TNF-α、IL-1β、IL-6 和ET-1 的含量,升高血清中HDL、NO 和VEGF 水平的药效作用与西洛他唑基本相当或略优,说明其对下肢动脉硬化闭塞症的治疗具有积极的作用。
4 结论
通过大鼠高脂喂养加内膜损伤模型首次验证了脑脉利颗粒改善动脉硬化闭塞症的作用,各剂量组的脑脉利颗粒通过改善下肢动脉狭窄、升高血流速度、调节血脂、抑制炎性反应、改善血管内皮功能紊乱,发挥治疗大鼠下肢动脉硬化闭塞症的作用,且具有一定的剂量依赖关系。但由于人体ASO 病变过程较为复杂,后期尚需进一步探索,为可能开展的临床研究提供实验基础,也为有效开发脑脉利颗粒的生物学功能提供科学依据。
