半枝莲种子质量检验方法的研究
2022-01-26许静远黄冬婷孙含章李贤慧秦民坚
许静远,黄冬婷,孙含章,李贤慧,孔 颖,姜 波,秦民坚
(1. 常熟理工学院 生物与食品工程学院,江苏 苏州 215000; 2. 中国药科大学 中药学院,江苏 南京 210009)
半枝莲Scutellaria barbataD.Don 为唇形科黄芩属多年生草本植物,以干燥全草入药,具有清热解毒、化瘀利尿等功效,临床应用广泛[1]。虽然半枝莲多用种子进行人工栽培,但目前针对半枝莲的研究还主要集中在化学成分分离、药理作用以及栽培技术等方面,有关种子质量检验方法的研究尚未见报道,不利于半枝莲种子生产销售过程中的质量监督检验。中药材种子是中药材人工繁育的基础,是从源头保证中药材品质优良、质量可控的关键[2]。因此,本实验拟对半枝莲种子的质量检验方法进行研究,以期为制定科学合理的半枝莲种子检验标准提供依据。
1 材料与仪器
1.1 实验材料
以2020 年7 月间在河南省确山县收集的半枝莲种子作为实验材料,经中国药科大学秦民坚教授鉴定为唇形科植物半枝莲S. barbata的种子。
1.2 主要试剂
2,3,5-氯化三苯基四氮唑(TTC,BR 级,上海蓝季科技发展有限公司); 溴麝香草酚兰[BTB,BS级,生工生物工程(上海)股份有限公司]
1.3 主要仪器及设备
DHG-9079A 型电热鼓风干燥箱(上海一恒科学仪器有限公司); GZX-250BSH-III 型光照培养箱(上海新苗医疗器械制造有限公司); PR124ZH 型万分之一天平(奥豪斯仪器有限公司); 雷磁DDS-307A 型电导率仪(上海仪电科学仪器股份有限公司)。
2 方法
2.1 扦样
参照《农作物种子检验规程 扦样(GB/T 3543.2-1995)》中的方法[3],采用徒手四分法分取初次样品和实验样品。根据“净度分析”项下实验样品应不少于2 500 粒种子及送检样品为实验样品10 倍量确定半枝莲种子送检样品及净度分析试样的最小质量。
2.2 净度分析
在保证实验样品中半枝莲种子不少于2 500 粒的情况下,选取一定量的实验样品,按照《农作物种子检验规程 净度分析(GB/T 3543.3-1995)》方法[4],随机分取三份规定重量的试样,在不损伤种子的基础上,对试样进行挑选,分开净种子、其它种子和杂质并分别称重记录,计算种子净度,称重至小数位四位,公式如下:
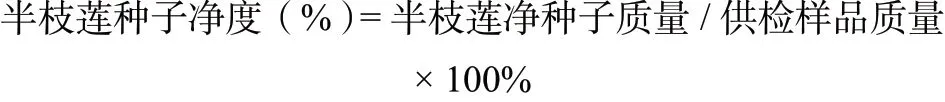
2.3 种子真实性鉴定
从净种子中随机选取100 粒种子作为一个重复,设置4 个重复。采用形态鉴定法对半枝莲种子的形态、大小、颜色及表面特征进行观察记录,并作为半枝莲种子鉴定的依据。
2.4 种子重量测定
取净选后的半枝莲种子,参考《农作物种子检验规程 其他项目(GB/T 3543.7-1995)》[5],分别采用百粒法(8 组重复)、五百粒法 (4 组重复)以及千粒法(4 组重复)估算种子千粒重,并计算各组间的变异系数。
2.5 种子含水量测定
取净选后的半枝莲种子,参考《农作物种子检验规程 水分测定(GB/T 3543.6-1995)》[6],分别考察高温恒温烘干法(131 ± 1)℃和低温恒温烘干法(103 ± 1)℃,以确定半枝莲种子含水量的测定方法。上述实验每次称量种子(1.00 ± 0.03)g,每种烘干方法设置6 次重复。
2.6 种子发芽率测定
2.6.1 种子密度对发芽率的影响 半枝莲种子体积较小,浸泡一定时间后常出现部分种子浮于表面,部分种子沉于水底的情况,因此首先比较不同密度半枝莲种子的萌发率差异。将半枝莲种子在25 ℃、黑暗条件下进行萌发,以双层纱布为发芽床,保证发芽床湿润且无多余水分。每种处理设置6 个重复,每个重复放置50 粒种子。比较不同密度半枝莲种子的发芽率是否有差异。
2.6.2 光照对萌发率的影响 种子培养光照条件分别设置为:光照、黑暗以及光照/黑暗各12 h 交替三种不同光照条件,其余培养条件同“2.6.1”,比较不同光照条件对半枝莲种子发芽率的影响。
2.6.3 浸种时长对萌发率的影响 用蒸馏水分别浸泡半枝莲种子0、3、6、12、24 h,光照条件为光照/黑暗各12 h,其余培养条件同“2.6.1”,考察浸种时长对半枝莲种子发芽率的影响。
2.6.4 适宜发芽床的确定 考察3 种不同的发芽床对半枝莲种子萌发率的影响:(1)在培养皿中铺一层湿滤纸,然后置种;(2)在培养皿中铺双层湿润的纱布,然后置种;(3)在培养皿中放入过60 目筛的高温灭菌细沙20 g,将种子压入沙床表层,与沙床表面持平。其余培养条件同“2.6.3”,比较不同发芽床对半枝莲种子发芽率的影响,以选取适宜的发芽床。
2.6.5 适宜发芽温度的确定 考察不同温度对半枝莲种子萌发率的影响,培养温度分别设置为15 ℃、20 ℃、25 ℃、30 ℃恒温以及20 ℃/25 ℃变温,其余培养条件同“2.6.3”,比较不同温度下半枝莲种子的萌发率。
2.7 种子生活力测定
分别采用2,3,5-氯化三苯基四氮唑(TTC)法[7]、电导率测定法[8]以及溴麝香草酚兰(BTB)法[9]测定半枝莲种子的生活力,探讨半枝莲种子活力测定的最佳方法。
2.8 统计学方法
用SPSS 22.0 软件进行数据分析,计量资料用均数±标准差(±s)表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析。 以P<0.05 为差异具有统计学意义。
3 结果与分析
3.1 扦样
根据半枝莲种子千粒重结果和扦样原则,确定送检的半枝莲种子样品最少为8.0 g,净度分析试样最少为0.8 g。
3.2 净度分析
大多数市售的半枝莲种子在采收后未经过严格的除杂处理,常会夹杂泥土灰尘、其它的植物种子以及碎叶、碎石子等杂质,因此在检验时应对半枝莲种子进行净度分析。由于种子上附带的灰尘泥土量少,同时在样品处理及转移过程中会有损失,因此不纳入种子净度分析范围。净度分析的结果表明:半枝莲种子的净度为(78.44 ± 0.74)%,种子净度较高;样品中碎叶、碎石子等杂质所占比例为(18.85 ± 0.55) %,为市售半枝莲种子中的主要杂质;其它植物的种子所占比例为(1.30 ± 0.82)%,所占比例较低。
3.3 真实性鉴定
半枝莲种子呈不规则卵圆形,一端略尖,一端钝圆,种皮颜色为墨绿色至褐色,种皮表面不平整,密被凸起,见图1。整个种子粒长0.87 ~ 1.85 mm,粒宽0.69 ~ 1.02 mm。

图1 半枝莲种子外观形态特征Fig. 1 The morphological of S. barbata seeds
3.4 重量测定
采用百粒法测定半枝莲种子千粒重时组内变异系数最大,而千粒法测定半枝莲种子千粒重时变异系数最小,因此测定半枝莲种子千粒重时宜采用千粒法,见表1。

表1 半枝莲种子重量测定Tab. 1 The determination of seed weight of S. barbata
3.5 含水量测定
采用高温烘干法测定半枝莲种子含水量时,5 个不同烘干时长下所测得种子含水量结果之间的差异无统计学意义(P> 0.05),说明采用高温烘干法时半枝莲种子在1 h 以内迅速失去水分。采用低温烘干法测定含水量时,烘干0.5、1 、1.5 h 所测得种子含水量均小于烘干2 h的结果,随着烘干时长进一步增加,烘干2.5 h 之后,所测得结果与烘干2 h 结果之间的差异无统计学意义(P> 0.05)。此外,对两种不同烘干方法在相同烘干时长下的结果进行比较,结果表明5 个不同烘干时长下高温烘干法所测得的半枝莲种子含水量均大于低温烘干法所得结果(P< 0.05),说明低温烘干法在较短时间内不能将半枝莲种子完全烘干,烘干效率较高温法低。从能源节省和操作简便性考虑,可选择高温烘干0.5 h 作为半枝莲种子含水量的测定方法,见表2。
表2 不同烘干条件下半枝莲种子含水量(±s, n = 6)Tab. 2 The water content of S. barbata seeds determined by different drying methods(±s, n = 6)
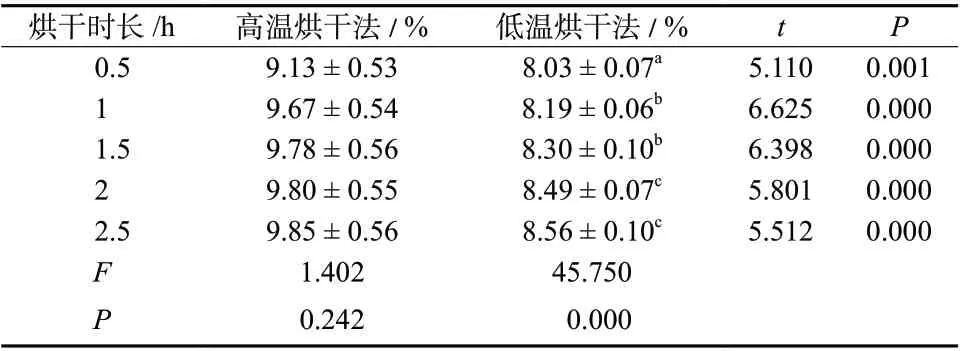
表2 不同烘干条件下半枝莲种子含水量(±s, n = 6)Tab. 2 The water content of S. barbata seeds determined by different drying methods(±s, n = 6)
注:同列不同字母表示差异有统计学意义(P < 0.05),下表同。
烘干时长/h高温烘干法/ %低温烘干法/ %tP 0.59.13 ± 0.538.03 ± 0.07a5.1100.001 1 9.67 ± 0.548.19 ± 0.06b6.6250.000 1.59.78 ± 0.568.30 ± 0.10b6.3980.000 2 9.80 ± 0.558.49 ± 0.07c5.8010.000 2.59.85 ± 0.568.56 ± 0.10c5.5120.000 F 1.40245.750 P 0.242 0.000
3.6 种子萌发率测定
3.6.1 种子密度对萌发率的影响 不同密度的半枝莲种子培养前6 d 萌发率均明显提高,之后萌发率无明显变化;在相同条件下培养14 d 后密度较小的上层种子萌发率明显高于密度较大的下层种子萌发率(P< 0.05),因此密度较小的半枝莲种子萌发率更高,见图2。

图2 不同密度半枝莲种子萌发率比较(n = 6)Fig. 2 The comparison of the germination rate of S. barbata seeds with different densities(n = 6)
3.6.2 光照对萌发率的影响 实验结果表明持续光照、持续黑暗以及光照/黑暗各12 h 交替三种不同条件下半枝莲种子萌发率分别为(92.67 ± 4.13)%、(91.67 ± 1.51)%和(89.33 ± 4.32)%,三种不同光照条件下种子萌发率的差异无统计学意义(P>0.05)。由于黑暗条件下半枝莲种子萌发后子叶较小,颜色为黄白色,不利于萌发初期的观察统计,因此半枝莲种子萌发时的光照条件设置为光照/黑暗各12 h交替。
3.6.3 浸种时长对萌发率的影响 不同浸种时长下半枝莲种子的萌发率结果见表3,提前浸泡0、3、6 以及12 h 的半枝莲种子萌发率差异无统计学意义(P> 0.05);而当浸种时间延长至24 h 时,半枝莲种子的萌发率降低,其萌发率明显低于其余四组(P< 0.05),说明半枝莲种子进行萌发检验前无需提前浸种。
表3 不同浸种时长下半枝莲种子的萌发率(±s, n = 6)Tab.3 The germination rate of S. barbata seeds with different pre-soaking time(±s, n = 6)

表3 不同浸种时长下半枝莲种子的萌发率(±s, n = 6)Tab.3 The germination rate of S. barbata seeds with different pre-soaking time(±s, n = 6)
浸种时长 / h萌发率 / %0 42.67 ± 6.65a 43.67 ± 7.53a 6 38.33 ± 10.54a 3 1239.67 ± 2.66a 2426.67 ± 6.02b F 5.435 P 0.003
3.6.4 适宜发芽床的确定 半枝莲种子在滤纸、纱布和河沙上的萌发率分别为(35.67 ± 8.24)%、(36.66 ± 4.13)%和(27.66 ± 2.66)%。半枝莲种子在滤纸和纱布上的萌发情况一致,差异无统计学意义(P> 0.05);而半枝莲种子在沙子发芽床上的萌发率明显低于使用其它两种萌发床时的发芽率(P<0.05)。由于半枝莲种子体积较小,相较于滤纸发芽床,纱布更容易固定种子,且锁水性较好,考虑试验操作和观察统计的简便性,可选纱布床作为半枝莲种子萌发检验时的发芽床。
3.6.5 适宜发芽温度的确定 不同培养温度下半枝莲种子的萌发率,见表4。半枝莲种子的萌发率在25 ℃恒温、30 ℃恒温以及20/25 ℃变温三种不同培养温度下差异无统计学意义(P> 0.05),而半枝莲种子在15 ℃和20 ℃条件下的萌发率明显低于其它三种温度下的萌发率(P< 0.05)。考虑检验操作的简便性以及对培养设备的要求,选择25 ℃恒温作为半枝莲种子萌发检验时的培养温度。
表4 不同温度下半枝莲种子的萌发率(±s, n = 6)Tab. 4 The germination rate of S. barbata seeds at different germination temperature(±s, n = 6)
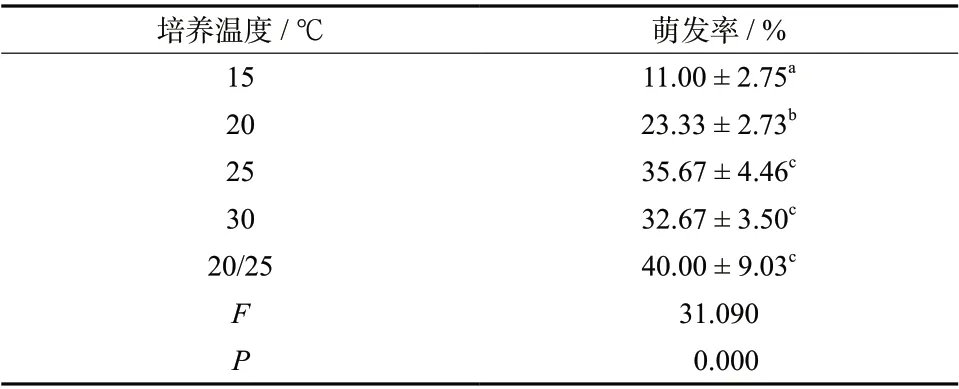
表4 不同温度下半枝莲种子的萌发率(±s, n = 6)Tab. 4 The germination rate of S. barbata seeds at different germination temperature(±s, n = 6)
培养温度 / ℃萌发率 / %1511.00 ± 2.75a 2023.33 ± 2.73b 2535.67 ± 4.46c 3032.67 ± 3.50c 20/2540.00 ± 9.03c F 31.090 P 0.000
3.7 种子生活力测定
本研究首先选取应用最广泛的TTC 染色法测定半枝莲种子的生活力,结果见表5。半枝莲种子在1%浓度的TTC 溶液中浸泡12 h 和24 h 后的染色率明显低于浸泡48 h 和72 h 后的染色率(P< 0.05),而浸泡48 h 的染色结果与浸泡72 h 的结果差异无统计学意义(P> 0.05)。上述结果表明具有生活力的半枝莲种子在1%浓度的TTC 溶液中浸泡48 h 后已基本被染色,可记录染色情况,估算种子生活力。
表5 TTC 法测定半枝莲种子活力(±s, n = 3)Tab.5 The seed vigor of S. barbata seeds determined by TTC method(±s, n = 3)

表5 TTC 法测定半枝莲种子活力(±s, n = 3)Tab.5 The seed vigor of S. barbata seeds determined by TTC method(±s, n = 3)
染色时长 / h染色率 / %12 3.33 ± 2.31a 2438.00 ± 2.00b 4844.00 ± 4.00c 7245.33 ± 3.05c F 135.897 P 0.000
本研究进一步考察了BTB 法和电导率法在半枝莲种子生活力检测中的适用性。半枝莲种子在BTB培养基上连续培养3 d 均无黄色光圈,说明BTB 法不适于测定半枝莲种子活力。采用电导率法测定半枝莲种子活力,所得半枝莲种子相对电导率为(52.23 ±2.51)%,与TTC 染色法所得结果较接近。综合考虑实验结果的稳定性以及可操作性,宜采用电导率法进行半枝莲种子生活力测定。
根据以上实验结果确定半枝莲种子的质量检验方法,见表6。

表6 半枝莲种子质量检验方法Tab. 6 Testing methods for seed quality of S. barbata
4 讨论
种子活力是决定种子和种子批在发芽和出苗期的活性强度和种子特征的表现,种子活力直接影响种子出苗速度以及长成幼苗的潜力[10]。TTC 法是一种结果可靠的测定种子生活力的方法,目前已用于多种中药种子的生活力检验[7,11]。然而采用TTC 法检测种子活力时,需要逐一剥去种皮,观察记录种子染色情况,不易于操作观察体积较小的种子。电导率测定法也可用于检测种子活力,具有简便、可操作性强和时间短等优点[12],如卢魏魏等[8]采用电导率法成功检验了较为细小的白花蛇舌草种子的活力。本研究也考察比较了TTC 法和电导率法在半枝莲种子活力检测中的适用性。结果表明采用电导率法测得的半枝莲种子生活力与TTC 染色法的结果较接近,但TTC 法耗时长且被染色的半枝莲种子不易观察,不利于统计。因此在测定半枝莲种子活力时宜选用电导率法,有利于节省检测时间,提高检测效率。
此外,在本研究中还发现采收初期的半枝莲种子萌发率能够达到80%以上,但由于整个研究周期较长,随着种子贮藏时间增加,在研究后期半枝莲种子的萌发率降低至50%。通常情况下,种子的萌发率会随着贮藏时间的延长而逐渐降低。罗倩等[13]研究发现室温贮藏的独活种子萌发率会随贮藏时间延长而显著降低,在采收后第一年的7 月份降低为0。李青莲[14]研究发现夏枯草种子的发芽率和生活力均随贮藏时间的延长而降低。这说明贮藏时间可能会影响半枝莲种子的生活力和萌发率,今后在开展半枝莲种子质量检验时应尽可能地缩短整个检验周期,以避免因检验过程中种子贮存时间过长导致生活力下降,造成检验结果不准确;同时也提示我们应进一步开展对半枝莲种子贮藏条件的相关研究,从而为半枝莲种子的合理贮存提供技术支持。
5 结论
本研究通过测定扦样、净度、真实性、千粒重、含水量、种子萌发条件以及生活力等指标建立了半枝莲种子质量检验方法,该法操作简便、重复性好,为进一步制定半枝莲种子质量标准提供了技术支持。
