miR-155表达对人前列腺癌DU145细胞增殖及细胞周期的影响
2022-01-26张镜伟马胜利谢程国
张镜伟 马胜利 谢程国
前列腺癌的发病率在全球范围内不断上升,特别是在老年人群中,其发病率和死亡率均较高[1-2]。雄激素剥夺疗法(androgen deprivation therapy, ADT)是目前前列腺癌治疗最有效的策略,尽管早期ADT有效率达90%以上[3-4],但几乎所有患者在治疗2~3年后,均不可避免地出现对ADT耐药,晚期前列腺癌仍然是一种不治之症[5-8]。因此,需要进一步研究前列腺癌的发病机制,开发新的治疗手段。
微小RNA(miRNA)是一类通过与靶基因的3′非编码区(UTR)相结合,在转录水平调控靶基因水平的小RNA分子[9]。目前研究发现,miRNA可以作为细胞周期调控因子[10-11],在肿瘤发生、发展中发挥着重要作用[12-15]。miRNA-155(miR-155)是一个受抑癌基因p53调节的小RNA分子,在多种肿瘤细胞中呈低表达[16-17],且与肿瘤进展相关[18-19]。然而,有关miR-155在前列腺癌中的作用尚未有文献报道。因此,本研究旨在探讨miR-155在前列腺癌中的表达及其与患者预后之间的关系,揭示miR-155对前列腺癌细胞增殖能力的影响,为前列腺癌的靶向治疗提供潜在新靶点。
材料与方法
一、材料和试剂
收集我院临床前列腺癌和相应的癌旁组织标本(2019年1月至2020年1月)各30例,所有参与本研究的患者均给予知情同意,本研究得到广州市第一人民医院伦理委员会的批准。荧光定量PCR反转录和扩增试剂盒均购自Takara公司;MTS细胞增殖定量检测试剂盒购自美国Promega公司;主要使用的抗体包括 cyclin D1(ab16663)、cyclin E2(ab40890)、GAPDH (ab8245)购自美国Abcam公司;ECL荧光底物试剂盒购自美国 Pierce公司。miR-155抑制剂(miR212529133043-1-10)和相应的对照RNAs购自广州锐博公司。
二、细胞培养
人前列腺癌细胞株DU145和正常前列腺上皮细胞RWPE-1购自中国科学院干细胞库,RWPE-1细胞在角质细胞血清游离培养液(Gbico,Grand Island,NY)+1%青霉素和链霉素混合液中培养;DU145在含有10%胎牛血清(Gbico)+1%青霉素和链霉素组合的DMEM (Gbico)中培养。所有细胞在37 ℃标准细胞培养条件下(5% CO2,95%湿度)生长。
三、qRT-PCR检测
取对数生长期细胞,采用Trizol/氯仿/异丙醇法提取细胞总RNA,通过微量核酸蛋白定量仪(NanoDrop 2000)测定所提取RNA的浓度及纯度;然后,参照Takara公司的PrimeScriptTMRT Reagent Kit试剂盒说明书,将总RNA(1 μg)逆转录成cDNA;按照Takara公司的PrimeScriptTMRT Master Mix(Perfect Real Time)试剂盒说明书,以cDNA为模板进行PCR扩增,所需引物序列如表1所示。记录各组CT值并采用公式2-ΔΔCT对数据进行处理分析,得到各个细胞株中基因的相对表达量。

表1 荧光定量PCR所需的各基因引物序列
四、Western blot检测
收集对数生长期细胞,用预冷PBS洗涤细胞3次,然后加入细胞裂解缓冲液裂解细胞,经超声、离心后去掉其他细胞成分,使用微量核酸蛋白定量仪测定各蛋白样品的浓度及纯度;加入5×SDS上样缓冲液在沸水中煮沸10 min以使蛋白充分变性;配液10%的SDS聚丙烯酰胺凝胶进行电泳分离,然后转膜、封闭,并在4 ℃条件下与一抗孵育过夜;二抗室温孵育2 h,采用化学发光法检测目的蛋白表达,并进行灰度值分析。
五、MTS细胞增殖实验
按照MTS细胞增殖定量检测试剂盒实验步骤,将100 μl完全培养液中的2 000个细胞接种到96孔板中,在37 ℃和5% CO2条件下培养1~5 d,然后每隔24 h在培养液中加入10 μl MTS,37 ℃条件下孵育4 h后,在490 nm波长处测定每孔吸光度值,根据结果绘制细胞生长曲线。
六、平板克隆形成实验
将细胞以每孔500个细胞的密度接种于6孔板中,培养7 d。用4%多聚甲醛溶液固定,0.1%结晶紫液染色,于倒置显微镜下计数细胞数在50个以上的克隆形成数目。
七、流式细胞术检测细胞周期
取对数生长期细胞,用 D-Hanks清洗3遍后加入不含胎牛血清的培养液静置过夜,然后用预冷PBS清洗3次,使用预冷75%乙醇固定细胞,放置于4 ℃冰箱内过夜;上机前离心去除乙醇,PBS洗涤3次后,加入100 μl RNase A,于37 ℃水浴条件下放置30 min;然后加400 μl的PI溶液,4 ℃避光染色1 h;在流式细胞仪上,根据测定DNA的含量确定细胞周期各期的百分比。
八、统计学方法
结 果
一、前列腺癌组织及细胞中miR-155的表达水平
采用qRT-PCR检测临床前列腺组织标本中miR-155的表达水平,如图1所示,miR-155在肿瘤组织中的表达水平(0.27±0.03)明显低于癌旁组织(1.02±0.05),差异有统计学意义(P<0.01);且与miR-155高表达组相比,miR-155低表达组患者的Gleason评分、临床分期更高,总体生存情况更差(P<0.05),而年龄、PSA水平差异无统计学意义(P>0.05, 表2)。同样,我们也检测了miR-155在前列腺癌细胞中的表达水平,结果与临床标本相一致,miR-155在前列腺癌细胞DU145、PC-3、LNCaP、C4-2中的表达水平低于正常前列腺上皮细胞RWPE-1中的表达水平,且在DU145细胞中表达最低(图2,P<0.05)。
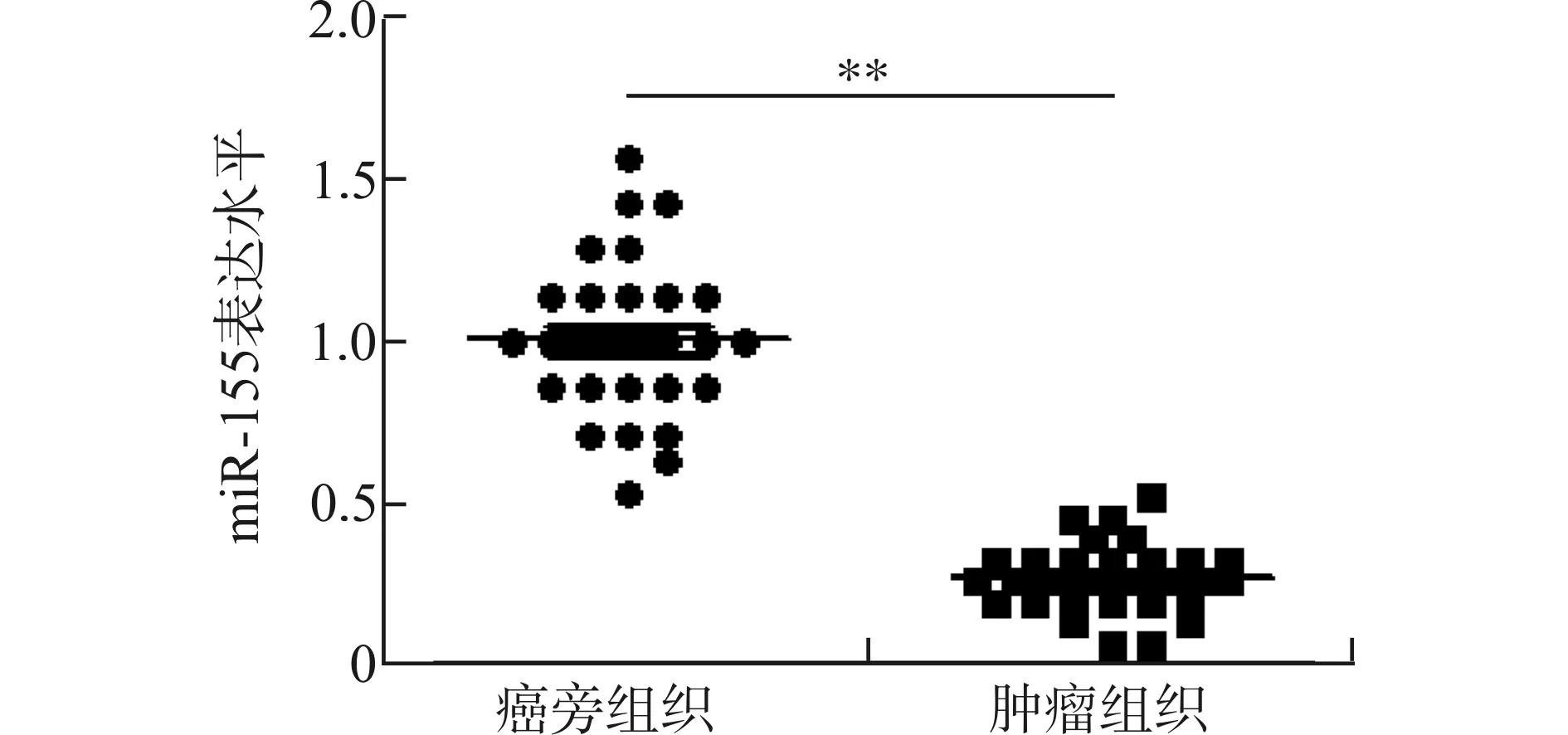
图1 miR-155在前列腺癌组织中的表达 (**P<0.01)
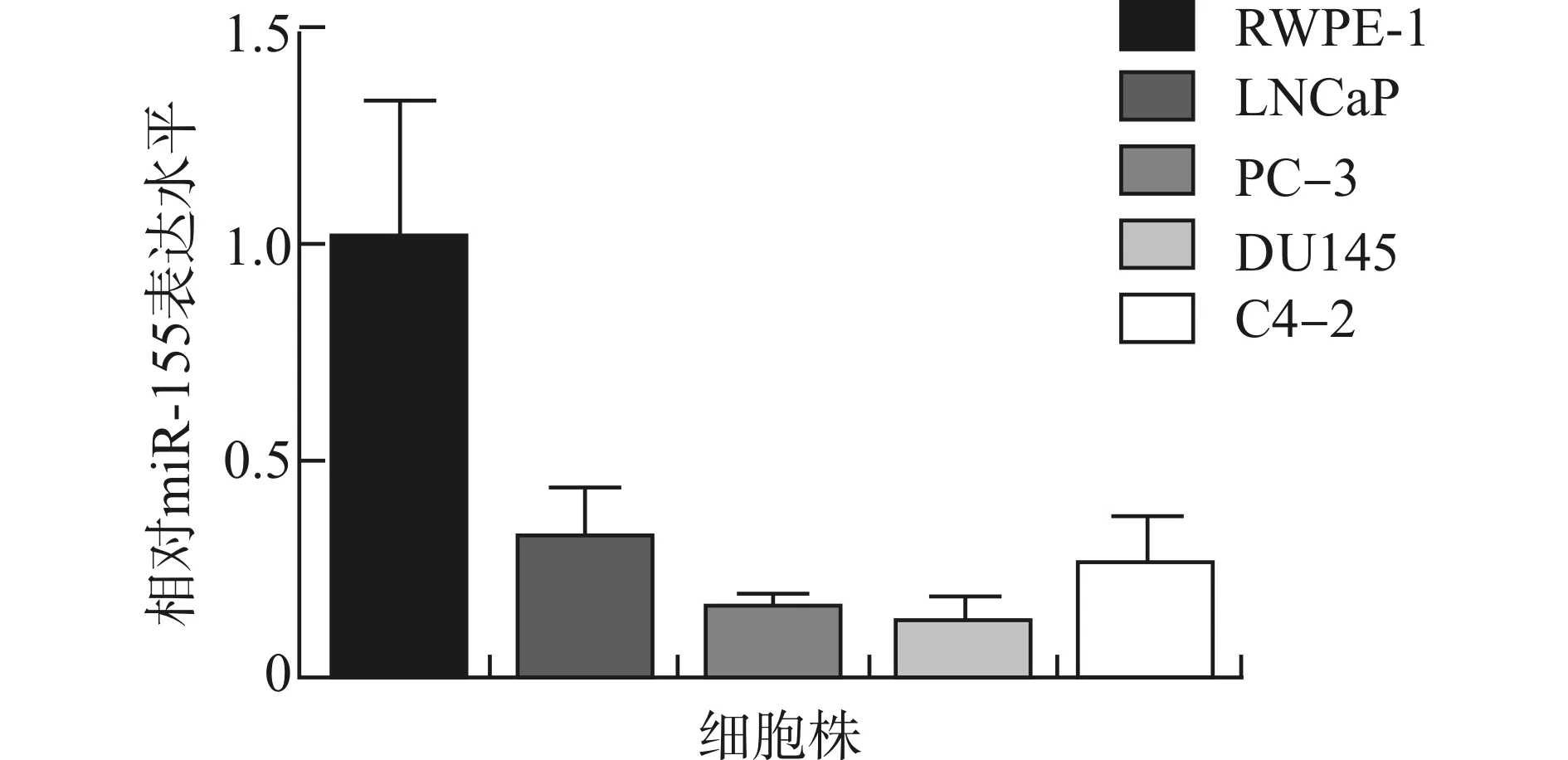
图2 miR-155在前列腺癌细胞中的表达
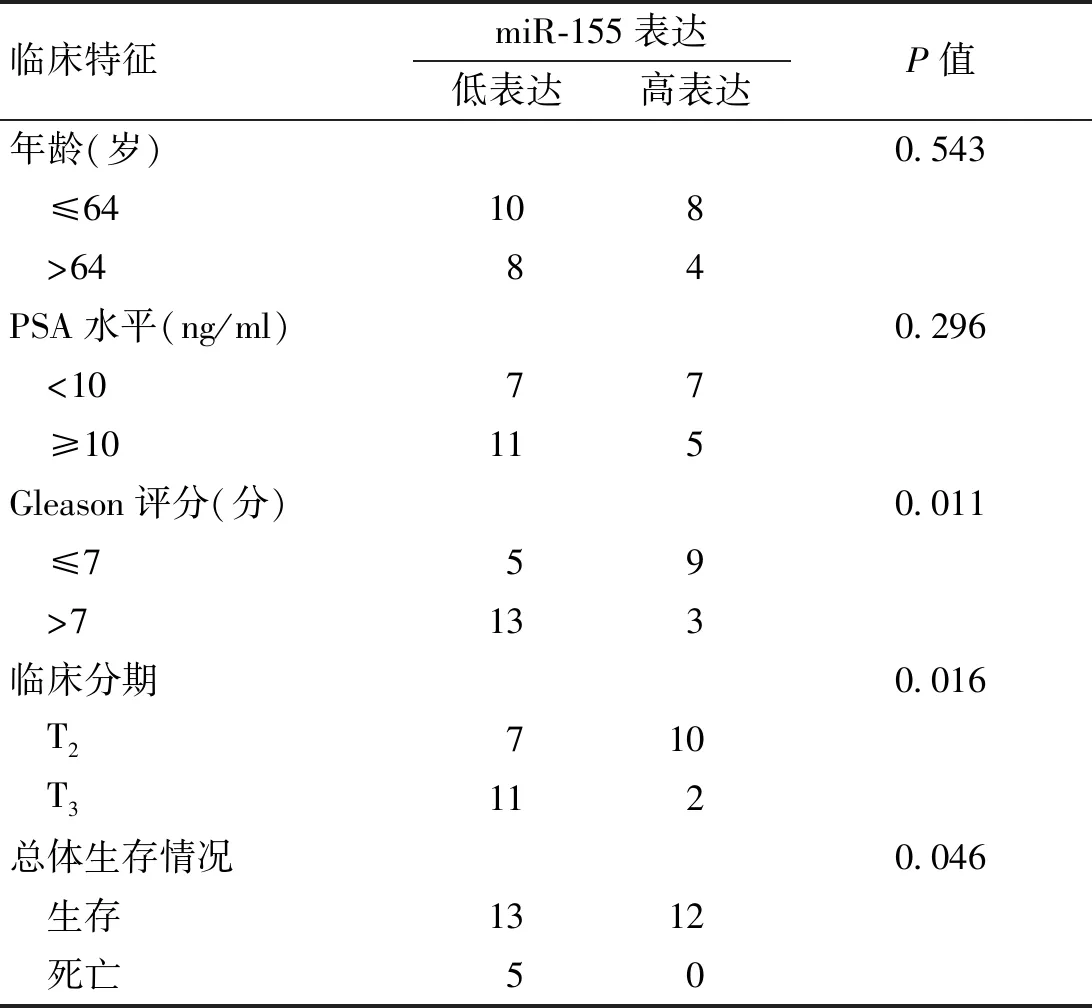
表2 miR-155表达与前列腺癌患者临床特征之间的关系(例)
二、miR-155过表达抑制前列腺癌细胞增殖能力
为了探讨miR-155在前列腺癌细胞中的生物学作用,我们通过转染miR-155 mimics或者加入miR-155抑制剂至DU145细胞培养液中,过表达/沉默miR-155表达。如图3所示,miR-155过表达后,DU145细胞的增殖速率明显减慢,平板克隆形成数目明显减少,结果具有统计学意义(P<0.05);而加入miR-155抑制剂后,则结果相反(P<0.05)。
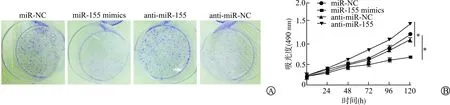
A:平板克隆形成实验检测细胞克隆形成能力;B:MTS细胞增殖实验检测细胞增殖能力(*P<0.05)图3 miR-155抑制前列腺癌细胞增殖能力
三、miR-155过表达诱导细胞周期G1/S期阻滞
我们进一步探讨miR-155对细胞周期分布的影响及其机制。结果如图4A所示,相比miR-NC组细胞,miR-155 mimics组细胞G1期细胞百分比从(46.61±2.45)%增加到(71.92±3.68)%,而S期细胞百分比则由(38.77±4.12)%减少到(25.46±8.57)%,细胞周期G1/S期的进展表现出明显阻滞;而且miR-155过表达后,cyclin D1、cyclin E2蛋白表达水平降低,说明miR-155可能通过下调细胞周期素的表达抑制前列腺癌细胞的增殖(图4B)。
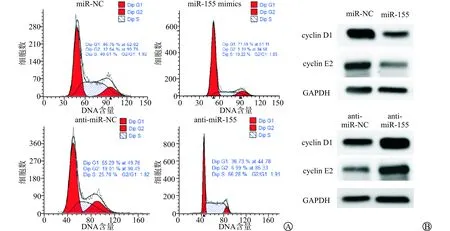
A:流式细胞术检测细胞周期分布情况;B:Western blot检测miR-155表达对cyclin D1、cyclin E2表达的影响图4 miR-155表达诱导前列腺癌细胞周期阻滞
四、miR-155通过靶向MYC抑制前列腺癌细胞增殖
为了探究miR-155下游的生物靶点,通过TargetScan(http://www.targetscan.org/vert_80/)microRNA靶基因预测工具,我们发现原癌基因MYC是miR-155的潜在靶点(图5A);且miR-155可以下调MYC表达水平(图5B)。挽救实验证明,MYC过表达后,可以逆转miR-155介导的前列腺癌细胞生长抑制,以及细胞周期素cyclin D1、cyclin E2的下调(图5C),说明MYC 是miR-155的关键下游靶点。
讨 论
近年来,miRNA作为转录后调控网络中的重要调控因子,在肿瘤的发生、进展和转移中受到越来越多的关注。在许多类型的癌症(如肝癌、结肠癌)中,miR-155能促进肿瘤细胞增殖、迁移和分化,并抑制细胞凋亡[20-21]。然而,在某些类型的癌症(如胃癌)中,miR-155又起到相反的作用——如抑制胃癌细胞的生长[22]。因此,miR-155在不同类型的癌细胞中要么作为肿瘤致癌因子,要么作为肿瘤抑制因子。本研究中,我们发现miR-155在前列腺癌细胞中起肿瘤抑制作用。

A:miR-155与MYC 3′UTR结合位点示意图;B:Western blot检测miR-155表达对MYC表达的影响;C:MTS细胞增殖实验检测细胞增殖能力(*P<0.05);D:Western blot检测cyclin D1、cyclin E2表达水平图5 miR-155通过靶向MYC抑制前列腺癌细胞增殖
有研究报道miR-155在前列腺癌中低表达[23];然而,miR-155在前列腺癌中的作用尚未完全阐明。本研究发现miR-155在前列腺癌中抑制DU145细胞增殖,并诱导细胞周期阻滞。miR-155在结肠癌中抑制细胞的增殖、迁移和侵袭[24],这与本研究结果一致。 细胞周期失控可导致细胞增殖异常,是肿瘤发生、发展的重要组成部分。细胞周期的过程受多个控制点的调控,其中G1/S和G2/M是最重要的调控点[25]。cyclin D1是调节G1/S检测点最关键的蛋白,它与cyclin D1-CDK4结合激活CDK4,导致RB蛋白高磷酸化而失活,进而引起转录因子E2F的释放,从而驱动细胞从G1期进入S期[26]。本研究发现过表达miR-155显著抑制了cyclin D1的表达,提示过表达miR-155可能通过G1/S限制点下调cyclin D1来抑制细胞增殖。对于其机制研究,我们发现miR-155通过碱基互补配对,靶向结合cyclin D1上游蛋白MYC,MYC通过上调cyclin D1和cyclin E2表达,驱动细胞周期进展,在肿瘤中发挥致癌作用。miR-155靶向沉默MYC基因,因此,在前列腺癌中诱导细胞周期G1/S阻滞,抑制前列腺癌细胞的增殖。
综上所述,miR-155在前列腺癌组织及细胞中呈低表达,miR-155过表达可能通过靶向沉默MYC,下调cyclin D1和cyclin E2的表达,从而诱导细胞周期G1/S期阻滞并抑制前列腺癌细胞增殖。因此,miR-155可能在前列腺癌发生、发展过程中发挥了重要作用。但是,本研究中仅采用了一个前列腺癌细胞系,也缺乏体内动物实验,miR-155 影响细胞周期蛋白的潜在机制尚有待进一步深入研究。
