小型猪2型糖尿病模型肠道微生物分析
2022-01-24田威龙綦文晶刘笑笑司景磊陈奎蓉程锋李月月吕冬玲梁靓高九昱奉玲丽莫家远兰干球梁晶
田威龙,綦文晶,刘笑笑,司景磊,陈奎蓉,程锋,李月月,吕冬玲,梁靓,高九昱,奉玲丽,莫家远,兰干球,梁晶
(广西大学动物科学技术学院,南宁 530004)
糖尿病(DM)是当前威胁全球人类健康最重要的慢性非传染性疾病之一,对公共卫生产生严重威胁。2型糖尿病(T2DM)是胰岛素分泌不足或胰岛素分泌受损引起的代谢综合征,是DM的主要类型。据估计,T2DM患者的数量将从2016年的4.5亿增加到2040年的6.42亿[1]。除了遗传因素外,全球T2DM患病率的快速增长与营养环境的快速变化密切相关,环境风险因素可通过改变肠道细菌菌群增加患糖尿病的风险[2]。
得益于测序技术的快速发展,在过去的几年中,有关肠道微生物组的知识有了很大的发展。16S rRNA基因高通量测序发现,哺乳动物在门水平的核心肠道微生物主要是拟杆菌门、厚壁菌门、放线菌门、变形菌门和疣微菌门[3]。肠道微生物组的活动具有重要的代谢功能,这在肥胖症和糖尿病的发生、发展中可能都很重要[4]。将肠道微生物群与宿主健康和代谢性疾病发展联系起来的因果证据大多来自啮齿动物的研究[5-6]。然而,重要的差异仍然存在,人类和老鼠胃肠道的一个重要区别是,老鼠的盲肠相对于整个胃肠道的大小比较大,相比之下,人类的盲肠相对较小且没有明确的功能[6]。此外,盲肠是小鼠体内重要的发酵部位,小鼠发酵能力的增加可显著影响肠道微生物的多样性、组成和功能[7]。因此,必须谨慎地将小鼠研究和人类研究进行直接的借鉴。
猪与人在生理结构和主要器官大小等方面都较为相似,是理想的医学模型,然而其虽然肥胖却不易患T2DM[8]。本研究选用广西巴马小型猪为动物模型,是长期近交培育形成的可用于T2DM模型研究的理想素材[9]。通过高脂高糖饮食诱导产生T2DM,采集新鲜粪便样品,采用16S rRNA基因测序技术比较T2DM组和CN组小型猪肠道微生物组成差异,补充了小型猪肠道微生物与T2DM发生的关联证据,为利用小型猪研究人类T2DM的发病机制提供基础。
1 材料和方法
1.1 材料
1.1.1 实验动物
本研究使用的10头6月龄,体重约为19 kg的雌性广西巴马小型猪(普通级)均来自广西大学巴马小型猪繁育场封闭群【SCXK(桂)2018-0003】。在最初1周的适应期中,对所有个体饲喂标准饮食(表1)。随后,随机选择5只小型猪作为对照组(CN组),继续常规食物饮食,而其余5只小型猪改为高脂高糖饮食诱导6个月直至其患病(T2DM组)。高脂高糖饮食配方为:标准饮食饲料+37%蔗糖+10%油脂。实验经广西大学伦理委员会审批(GXLL2018-006)。

表1 CN组标准饮食营养成分表Table 1 Nutrition composition of standard diet of CN group
1.1.2 主要试剂与仪器
DNA抽提试剂盒E.Z.N.A.® soil DNA kit(Omega Bio-tek,Norcross,GA,U.S.),AxyPrep DNA胶回收试剂盒(Axygen Biosciences,Axygen,U.S)。小型离心机(ABSON MiFly-6,合肥艾本森科学仪器有限公司,中国),电泳仪(DYY-6C,北京市六一仪器厂,中国),PCR仪(ABI GeneAmp® 9700型,ABI,美国),测序仪(Illumina Miseq,Illumina,美国)。
1.2 方法
1.2.1 表型测定和样品采集
在实验进行的0、2、4、6月称量体重,并在空腹16 h后于前腔静脉采血测量血糖水平。建模成功时收集新鲜粪便样品于1.5 mL无菌冻存管中,迅速放入液氮速冻,后保存于-80℃冰箱保存,直至使用。
1.2.2 DNA提取和测序
为了进行16S rRNA测序,将粪便样品根据E.Z.N.A.® soil DNA kit(Omega Bio-tek,Norcross,GA,U.S.)说明书进行总DNA抽提,使用1%的琼脂糖凝胶电泳检测DNA的提取质量。以纯化的细菌基因组DNA为模板,对16S rRNA基因的V3-V4区进行扩增和DNA测序,使用的引物是338F(5’-ACTCCTACGGGAGGCAGCAG-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’)。PCR反应体系20 μL:5×TransStart FastPfu 4 μL,2.5 mmol/L dNTPs 2 μL,上下游引物各0.8 μL,TransStart FastPfu 0.4 μL,模板DNA 10 ng,补ddH2O至20 μL。扩增程序如下:95℃预变性3 min,27个循环(95℃变性30 s,55℃退火30 s,72℃延伸30 s),然后72℃稳定延伸10 min,最后在4℃进行保存,扩增产物经凝胶电泳检测后送上海美吉生物医药科技有限责任公司使用Illumina公司的Miseq PE300平台进行测序。
1.2.3 数据分析
使用fastp软件[10]和FLASH[11]软件对原始测序序列进行质控和拼接;基于默认参数,使用QIIME2流程中的DADA2插件[12]对质控拼接之后的优化序列进行降噪处理,获得ASV(Amplicon Sequence Variant)代表序列和丰度信息。基于Sliva 16S rRNA数据库(v 138),使用QIIME2中的Naive bayes分类器对ASVs进行物种分类学分析。
2 结果
2.1 体重与空腹血糖变化
本研究发现实验进行到4个月和6个月时,T2DM组的体重极显著高于CN组(P<0.01)(图1A)。CN组空腹血糖在整个实验时期变化不明显,而T2DM组的空腹血糖呈上升趋势,在实验进行到6个月(7.7±0.164)mmol/L时空腹血糖显著高于CN组(P<0.05)(图1B)。参考2010年WHO针对人类颁布的糖尿病诊断标准:空腹血糖≥7.0 mmol/L或任意血糖≥11.1 mmol/L即判定为糖尿病患者,结合国家实验动物专家委员会简报(2018年第47期)中对巴马小型猪糖尿病诊断标准应大于现有空腹血糖测定最高值6.77 mmol/L的设定,可以判定本研究广西巴马小型猪T2DM模型构建成功。

注:与CN组相比,干预4,6月后,T2DM组体重具有显著性差异,*P<0.05。与CN组相比,干预6月后,T2DM组空腹血糖具有显著性差异,*P<0.05。图1 体重和空腹血糖变化Note.Compared with the CN group,the weight of T2DM group was significantly different at 4 and 6 months after intervention,*P<0.05.Compared with CN group,fasting blood glucose in T2DM group was significantly different at 6 months after intervention,*P<0.05.Figure 1 Changes in body weight and fasting blood glucose
2.2 样本序列信息
本研究对CN组和HFD组小型猪肠道微生物16S rRNA的v3-v4区进行高通量测序,对原始序列进行质控拼接之后共获得576 918条优化序列,使用QIIME2流程中的DADA2插件对获得的优化序列进行降噪处理共获得1587个ASV,分为17个门、24个纲、47个目、82个科、200个属和330个种。
2.3 Alpha多样性分析
为了评估微生物群落多样性,首先,对单个样本进行归一化处理,通过QIIME2平台将每个样本内的ASVs抽平为29 202条序列。然后,利用抽平后的序列计算计算了细菌物种的多样性指数(Shannon、Simpson)和丰富度指数(Chao1、ACE、Sobs),CN组和HFD组0、7、15、30 d不同时期的Shannon指数、Simpson指数、Chao指数、ACE指数和Sobs指数之间均无显著性差异,但是T2DM组的多样性指数和丰富度指数普遍低于CN组(表2)。

表2 CN组和T2DM组的Alpha多样性Table 2 Alpha diversity of the CN group and the T2DM group
2.4 物种组成及其变化
在门水平上,检测到CN组和T2DM组共17个门,其中两组共有16个门,T2DM组有1个特有的门(图2A)。CN组和T2DM组的优势门分别为厚壁菌门和拟杆菌门,均占据了各组总数的90%以上(图2B)。厚壁菌门和拟杆菌门的在两组的比例不同,其中厚壁菌门在T2DM组的比例显著高于CN组(P<0.05)(图2C),拟杆菌门在两组中虽然无显著性差异,但T2DM组中的比例要低于CN组(图2D)。
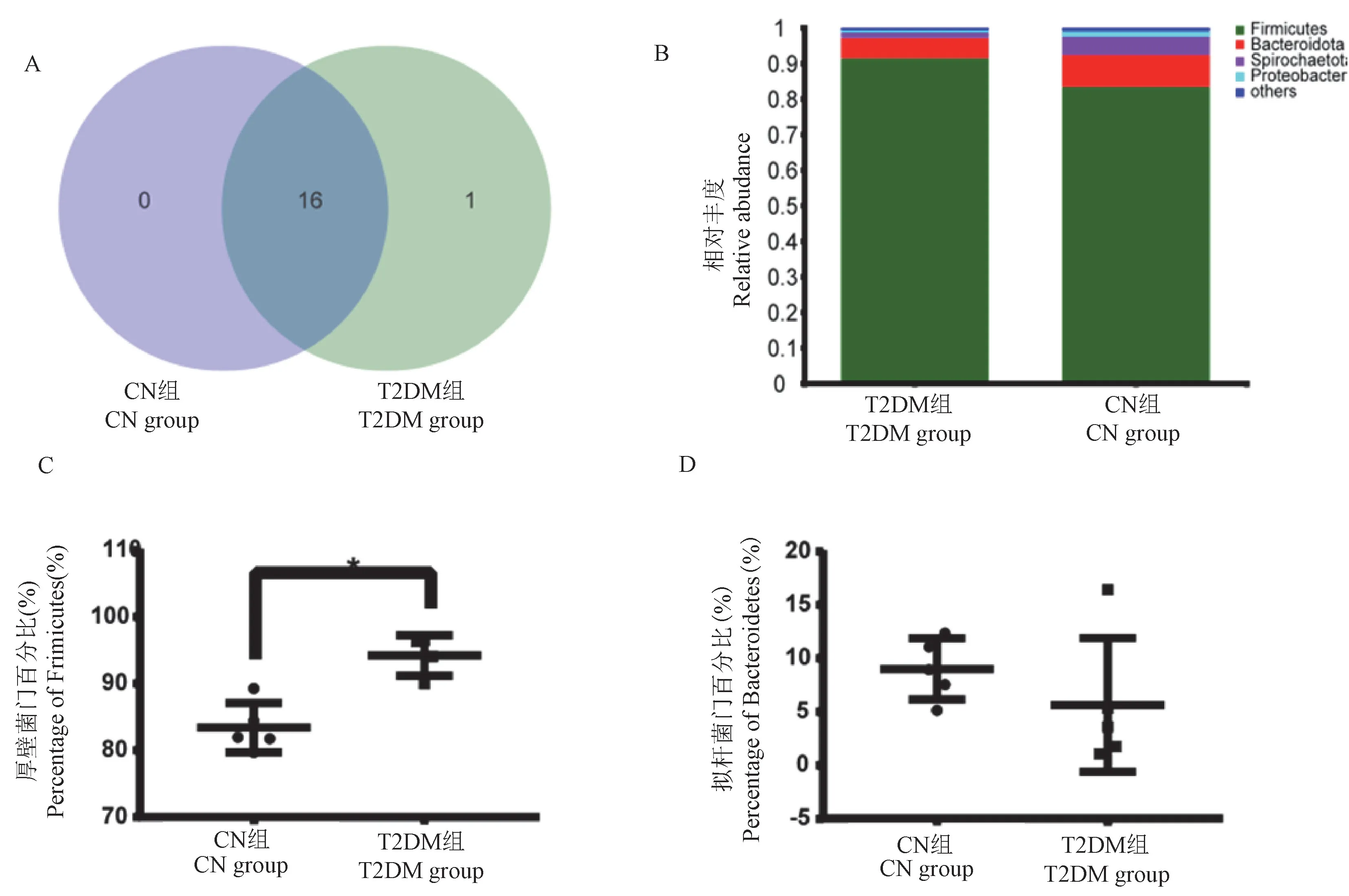
注:A:Venn展示的是T2DM组和CN组共有的门;B:条形图展示是两组物种组成;C:箱型图展示的是厚壁菌门在两组差异;D:箱型图展示的是拟杆菌门在两组差异。图2 T2DM组和CN组肠道微生物在门水平的组成和差异Note.A.Venn shows the common phyla of the T2DM group and the CN group.B.The bar chart shows the species composition of the two groups.C.The box chart shows the differences between Firmicutes in the two groups.D.The box chart shows the differences between Bacteroidetes in the two groups.Figure 2 Composition and difference of intestinal microflora at phylum level between T2DM group and CN group
在属水平上,共鉴定到200个属水平菌,其中CN组和T2DM组共有的属有146个,CN组有25个特有的属,其中排名前3的属分别是Agathobacter、Eubacterium_brachy_group和Solibacillus(见图3A);T2DM组有29个特有的属,其中排名前3的属分别是光冈菌属、g_norank_f_T和Intestinibacter(见图3B)。CN组 和HFD组 的 优 势 均 属 主 要 为Clostridium_sensu_stricto_1和乳杆菌属(见图3C)。此外,发现两组存在显著差异的菌属:普氏菌属、颤螺旋 菌 属、Eubacterium_ruminantium_group和Prevotellaceae_NK3B31_group等8个菌属在CN组的丰度显著高于T2DM组(P<0.05)(图3D)。

注:A:CN组特有菌属;B:T2DM组特有菌属;C:T2DM组和CN组在属水平的物种组成;D:T2DM组和CN组在属水平的物种差异。图3 T2DM组和CN组肠道微生物在属水平的组成与差异Note.A.CN group endemic bacteria.B.T2DM group endemic bacteria.C.The bar chart shows the species composition of T2DM group and CN group at the genus level.D.The bar chart shows the differences of T2DM group and CN group at the genus level.Figure 3 Composition and difference of intestinal microflora at genus level between T2DM group and CN group
2.5 微生物组成差异
为了探讨CN组和T2DM组的微生物组成是否具有差异,利用主坐标(principal co-ordinates analysis,PCoA)分析CN组和T2DM组微生物在门和属水平上的组成。我们发现,在门水平上有部分样品略有交叉(见图4A),但是在属水平上样品可以按照不同分组完全分开(见图4B)。
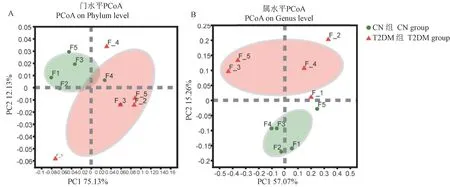
图4 T2DM组和CN组肠道微生物在门和属水平的PCoA分析Figure 4 PCoA analysis of intestinal microorganisms in the T2DM group and CN group at phylum and genus levels
使用LEfSe(Linear Discriminant Analysis Effect Size)分析来识别在门、纲、目、科、属分类水平上负责区分CN组和T2DM组的关键肠道微生物。共发现了27个差异项,其中26个在CN组中富集,1个在T2DM组中富集,CN组中的差异项远远多于T2DM组。LDA分析结果(见图5)显示26个在CN组中富集的菌群分别为:密螺旋体属、颤螺旋菌属、普氏菌属、消化球菌属、螺旋体目、球菌科、普氏菌科、螺旋体科、g__Lachnospiraceae_XPB1014_group、c__Spirochaetiap__Spirochaetota、g__prevotellaceae_NK3B31_group、g__norank_f__p_251_o5、f__p_251_o5、g__norank_f__Ruminococcaceae、g__unclassified_f__prevotellaceae、g__UCG_009、g__Eubacterium_brachy_group、g__Solibacillus、g__unclassified_o__Oscillospirales、f__unclassified_o__Oscillospirales、f__norank_o__Bradymonadales、g__norank_f__norank_o__Bradymonadales、c__Desulfuromonadia、o__Bradymonadales;1个在T2DM组中富集菌群是:g__Intestinibacter。
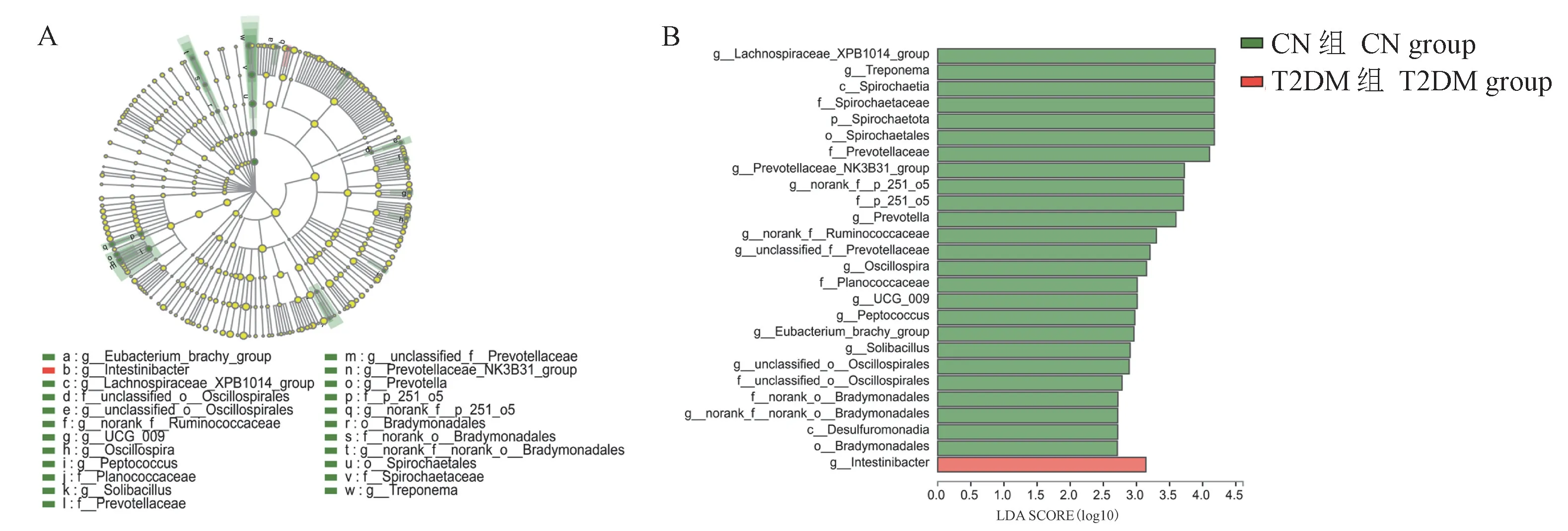
图5 CN组和T2DM组分支图和柱形图Figure 5 Cladogram and column diagram of CN group and T2DM group
2.6 肠道微生物组功能预测分析
由于肠道菌群可调节宿主的代谢途径,使用PICRUSt2(Phylogenetic Investigation of Communities by Reconstruction of Unobserved States)获得样本基因家族的丰度,然后,将基因家族信息与对应的KEGG功能数据库(Kyoto Encyclopedia of Genes and Genomes,http://www.genome.jp/kegg/)进行比对,获得每个样本中对应的功能信息和丰度信息。本研究发现CN组和T2DM组之间功能无显著性差异,均主要富集在氨基酸的生物合成、碳新陈代谢、氨基糖和核苷酸糖代谢以及糖酵解和糖异生等方面(见图6)。
图6 CN组和T2DM组KEGG三级代谢通路热图Figure 6 Heat map of KEGG level 3 metabolic pathway in CN and T2DM groups
3 讨论
在过去的10余年中,肠道微生物群在代谢紊乱(如人类肥胖和2型糖尿病)发展过程中所起的作用备受关注。这在一定程度上是由于新一代测序技术的引入,加上粪便样本可获得性的增加。肠道微生物与T2DM发生有关的证据正在迅速积累。本研究以广西巴马小型猪为动物模型,通过高脂高糖饮食构建T2DM模型,发现与正常饮食组相比,T2DM组肠道微生物的多样性下降并且菌群结构发生改变。此外,还通过LEfSe分析寻找可能与T2DM密切相关的肠道微生物,这些结果补充了猪肠道微生物与T2DM相关的证据。
本研究发现T2DM小型猪肠道微生物的Alpha多样性降低,Li等[13]通过对来自我国北方糖尿病患者的肠道微生物进行分析,发现与健康个体相比,糖尿病患者的肠道菌群多样性显著降低。T2DM患者肠道微生物多样性的降低可引起一定程度的肠道细菌营养不良,并干扰肠道菌群与宿主之间的相互作用。Le等[14]发现肠道微生物组成多样性较低的受试者显示出体重增加更多、胰岛素敏感性降低、血脂异常和炎症标记物增加,而细菌丰度的增加仅仅是反映了健康和多样化的饮食,还是直接有助于抵抗T2DM仍有待确定。此外,CN组和T2DM组微生物PCoA分析发现,CN组和T2DM在门水平和属水平上的组成存在明显差异。Larsen等[15]在2010年首次研究了2型糖尿病患者和对照组患者肠道菌群的差异,结果表明,不同类群的微生物群组成在门水平上存在显著差异。
在门水平,CN组和T2DM组的优势门均为厚壁菌门和拟杆菌门,饮食改变了其在两组中的比例,其中厚壁菌门在T2DM组的比例显著高于CN组(P<0.05),拟杆菌门在两组中虽然无显著性差异,但在T2DM组中的比例低于CN组。自2005年Ley等[16]发现肥胖小鼠中拟杆菌门的丰度低于瘦小鼠,而厚壁菌门比例增加以来,许多研究都发现了类似的结果。这主要是因为厚壁菌门的代谢多样性高于拟杆菌门(分别为348条代谢途径和76条代谢途径),可以从饮食中获取更多能量[17]。拟杆菌门主要通过产生丙酸向宿主提供能量,因此当拟杆菌门比例下降时,不仅降低了微生物多样性,还可能影响能量代谢[18]。此外,拟杆菌门的减少还意味着乙酸和丙酸的产量显著减少,而丙酸可以促进肠道糖异生,影响能量和葡萄糖稳态,因此拟杆菌门的降低可能与糖尿病的发生有关[19]。
在属水平,T2DM组有29个特有的属,其中含量最多的属是光冈菌属。Serena等[20]发现光冈菌属是产生琥珀酸的成员之一。循环中的琥珀酸是一种由微生物群和宿主共同产生的代谢物,体内琥珀酸水平的升高与葡萄糖稳态的损害有关[21]。事实上,高琥珀酸水平与多种人类疾病有关,包括心血管疾病[22]和T2DM[23]相关。还发现了CN组和T2DM组显著差异的菌属,比如:颤螺旋菌属、普氏菌属和norank_f__p-251-o5等在CN组显著富集。颤螺旋菌属是一种从未被培养过的神秘细菌属,人们对其在肠道中的生态作用或生理特性知之甚少,使用16S rRNA测序却发现其是人类粪便微生物群的主要成分之一[24]。Goodrich等[25]发现颤螺旋菌属的成员是高度遗传的,在较瘦的受试者中富集,这与本文的研究一致。此外,颤螺旋菌属是鸟类、鱼类哺乳动物(老鼠)在食期间盲肠中唯一增加的属,因为颤螺旋菌属能够降解宿主聚糖(如唾液酸和葡萄糖醛酸)[26],这在一定程度上解释了为什么颤螺旋菌属常富集在较瘦个体中。
为了寻找与T2DM密切相关的肠道微生物,使用LEfSe分析来识别在门、纲、目、科、属分类水平上负责区分CN组和T2DM组的关键肠道微生物。结果发现密螺旋体属、g__norank_f__Ruminococcaceae、普氏菌属和消化球菌属等26个菌群在CN组显著富集,而仅有1个菌群g__Intestinibacter在T2DM组中富集。说明T2DM组与健康对照之间存在许多明显不同的细菌种类,表明肥胖的T2DM患者中肠道菌群营养不良。尽管目前对于2型糖尿病患者中哪些细菌发生了显着改变尚缺乏共识,但普遍的观察是减少了2型糖尿病患者的细菌数量。g__norank_f__Ruminococcaceae是瘤胃菌科的成员。瘤胃菌科是乙酸盐的重要来源。肠道微生物代谢产物的变化在代谢性疾病发展中比微生物组成本身发挥的作用更大[27]。肠道微生物群会产生大量代谢产物,短链脂肪酸就是其中较为重要的一种代谢产物。短链脂肪酸是由大肠内不可消化膳食纤维细菌发酵产生的,主要由乙酸、丙酸和丁酸组成。对小鼠的研究表明,补充SFCA可以改善胰岛素敏感性和血脂异常,防止体重增加,并增加饮食导致的肥胖小鼠的能量消耗[28]。因此,短链脂肪酸的减少可能导致肥胖和糖尿病患者的炎症性增高。
关于T2DM的病因,医学中已经阐明了许多因素。随着对肠道菌群的深入研究,人们对病因有了新的认识和扩展,也为更好地预防肥胖和糖尿病提供了公共指导。然而种族、宿主遗传学、饮食习惯和药物使用之间的复杂相互作用在塑造微生物群落中都起着重要作用,使其成为一个有趣而又充满挑战的研究领域。此外,目前关于肠道菌群在人类新陈代谢发挥因果作用的结论由于其他混杂因素而变得模糊,例如测序和分析技术的差异以及用于研究的饮食差异,因此,探讨建立的标准化技术准则至关重要。
4 结论
我们发现了T2DM组特有的肠道微生物特征和其与CN组之间存在显著差异的肠道微生物。这为研究肠道微生物对T2DM发挥作用的潜在机制提供了新的证据和理论依据,有利于建立开发基于微生物群的个性化干预措施以应对人类代谢性疾病的方法。
