常用小鼠、大鼠肠道菌群比较研究
2022-01-24黄树武闵凡贵王静罗银珠何丽芳陈梅玲潘金春
黄树武,闵凡贵,王静,罗银珠,何丽芳,陈梅玲,潘金春
(广东省实验动物监测所,广东省实验动物重点实验室,广州 510663)
近年来,随着新一代基因测序技术、生物信息学分析工具和肠道微生物多组学的迅速发展,肠道菌群成为当今科研领域的研究热点之一[1-4]。目前研究已证实,肠道菌群与人体的肥胖和糖尿病代谢性疾病[5-6],炎症性肠病[7],胃肠道癌症[8],心脑血管疾病[9-10]以及自身免疫性疾病[11]等具有密切相关性。而实验小鼠和大鼠作为研究肠道菌群的重要工具动物,因动物来源、品种品系、性别年龄以及不同肠道肠段等多种因素的差异,导致其自身宿主背景的肠道菌群有所区别,况且目前对肠道菌群的影响因素分析不够全面,缺乏相关背景数据,导致对相关肠道菌群研究的动物实验设计或实验结果分析产生一定影响。本研究通过对常用品系的150只大、小鼠肠道菌群的高通量测序分析,剖析其肠道菌群的组成结构与丰度,揭示肠道菌群的多样性与差异性,分析宿主肠道菌群的相关影响因素,为肠道菌群研究提供数据参考。
1 材料与方法
1.1 材料
1.1.1 实验动物
从广东省医学实验动物中心【SCXK(粤)2018-0002】,北京维通利华实验动物技术有限公司【SCXK(京)2016-0006】和南方医科大学实验动物中心【SCXK(粤)2016-0041】三家实验动物生产单位(分别用代号SY、BWL、NFY表示)购买150只SPF级实验小鼠和大鼠,包括小鼠品系KM、C57BL/6J、BALB/c、NIH和大鼠品系SD、Wistar,具体信息见表1。所有实验操作都在实验动物使用设施【SYXK(粤)2016-0122】中进行,设施环境指标满足国家标准GB14925-2010要求,实验经广东省实验动物监测所动物管理和使用委员会审查(编号:IIACUC2020105),遵循动物福利和相关伦理要求。
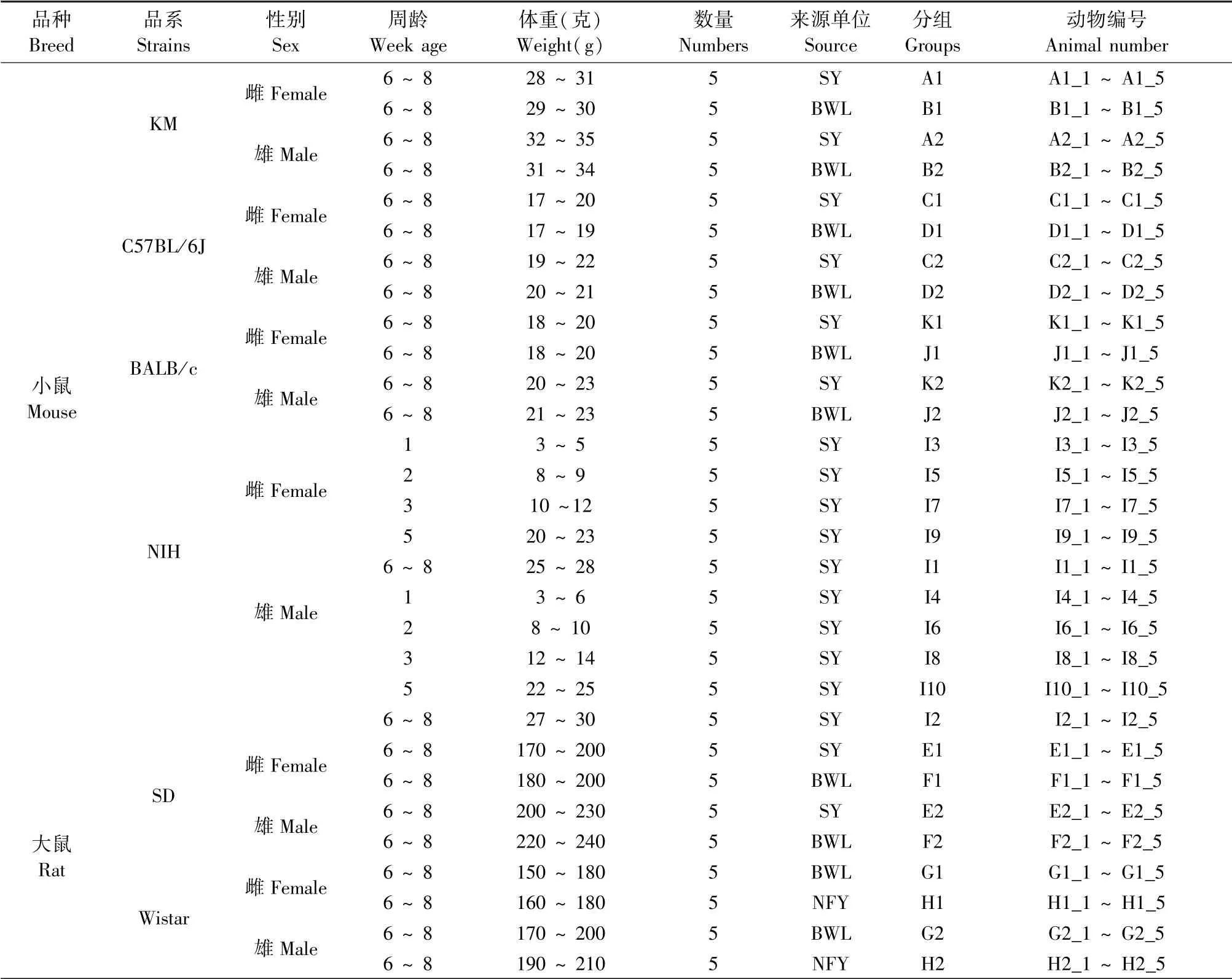
表1 实验小鼠和大鼠的信息Table 1 Information of experimental mice and rats
1.1.2 主要试剂与仪器
QIAamp DNA Stool Mini Kit试剂盒(QIAGEN公司,货号51504),Phusion®Hot Start Flex 2X Master Mix(NEB公司,货号M0536L),DL2000 DNA Marker(TaKaRa公司,货号3427)等,各种试剂均在有限期内使用。生物安全柜(德国,Biometra型),PCR超净工作台(浙江苏净净化设备有限公司,SW-CJ-1F型),L96G梯度型PCR仪(杭州朗基科学仪器有限公司,L96G型),电泳仪(北京六一仪器厂,DYY-6C型)。
1.2 方法
1.2.1 样本采集
在洁净生物安全柜里,对110只6~8周龄的小鼠和大鼠无菌操作采集粪便样本于无菌无DNA酶/RNA酶的1.5 mL EP管中,小鼠粪便重量为50~100 mg,大鼠粪便重量为100~200 mg,并对其中10只NIH品系小鼠安乐死后解剖取十二指肠、空肠、回肠、盲肠、结肠和直肠六段不同的肠段内容物50~100 mg于EP管中。另外,对40只1周龄、2周龄、3周龄、5周龄的NIH品系小鼠,同样采集粪便样本于EP管中,采集完后立即将所有样本冻存于-80℃冰箱里。动物粪便样本编号以动物编号记录,而动物十二指肠、空肠、回肠、盲肠、结肠和直肠的肠道内容物样本分组编号以雌性I1_a、I1_b、I1_c、I1_d、I1_e、I1_f,雄性I2_a、I2_b、I2_c、I2_d、I2_e、I2_f来记录。
1.2.2 样本扩增
根据试剂盒说明书,使用QIAamp DNA Stool Mini Kit对样本进行基因提取,提取的核酸作为DNA模板。根据细菌16S rDNA V3-V4区域设计特异引物序列341F:5’-CCTACGGGNGGCWGCAG-3’,805R:5’-GACTACHVGGGTATCTAATCC-3’,扩增的产物长度为465 bp。PCR反应体系为样本DNA 50 ng,Phusion® Hot Start Flex 2X Master Mixart Version 12.5 μL,前后引物(1 μmol/L)各2.5 μL,后补加无菌水到25 μL。反应程序为98℃预变性30 s,98℃变性10 s,54℃退火30 s,72℃延伸45 s,反应进行35个循环,后72℃延伸10 min,最后吸取扩增产物电泳检查产物质量。
1.2.3 高通量测序及生物信息学分析
通过构建16S rRNA全长文库,使用Illumina Hiseq 2500高通量测序平台进行测序,获得测序数据后利用overlap将双端数据进行拼接,并进行质控、嵌合体过滤,得到高质量的cleandata,接着调用DADA2(divisive amplicon denoising algorithm)对序列进行去噪,相当于以100%相似度聚类,然后去冗余,得到Feature(特征),再与16S数据库SILVA(Release132)和NT-16S进行序列比对,得到样本中物种注释信息,进而对样本肠道菌群的分类构成与多样性及差异性分析,并生成相关图表。
2 结果
2.1 样本内物种Alpha多样性分析
本研究获得6~8周龄的KM、C57BL/6J、BALB/c、NIH四种品系小鼠70份粪便样本,SD、Wistar两种品系大鼠40份粪便样本,1周龄、2周龄、3周龄、5周龄NIH品系小鼠40份粪便样本,以及6~8周龄NIH小鼠十二指肠、空肠、回肠、盲肠、结肠和直肠共6个肠段的60份肠道内容物样本。
通过对所有样本的16S rDNA高通量测序后,相同组别内的5份动物样本的肠道菌群差异性很小,按照分组原则进行聚类分析,且对样本内物种的丰富度与均匀度进行Alpha多样性分析,绘制Simpson图与Good’s Coverage图(见图1),观察到Simpson图中所有样本曲线均趋于平缓,说明测序深度已经基本覆盖到样本中所有的物种,样本的测序深度充分,测序数据合理;而Good’s Coverage图中曲线都趋近于1,说明样本内物种的丰富度和均匀度足够,样本内物种具有多样性。
2.2 肠道菌群结构组成与影响因素分析
2.2.1 不同来源单位、品种品系和性别的大小鼠肠道菌群分析
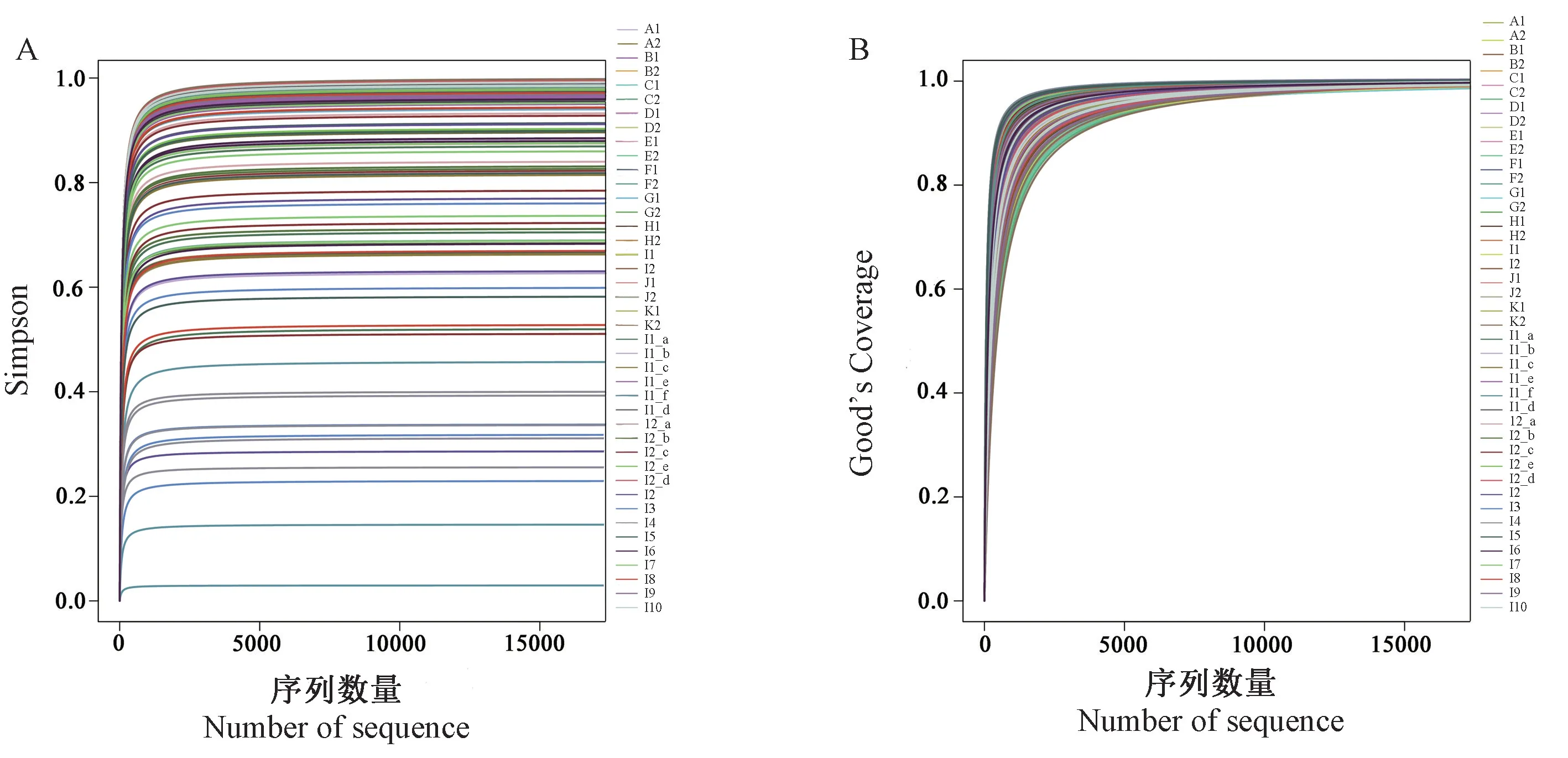
注:A:Simpson图;B:Good’s Coverage图。图1 样本内物种Alpha多样性分析Note.A.Simpson diagram.B.Good’s Coverage diagram.Figure 1 Alpha diversity analysis of sample species
在门分类上,四种品系小鼠与两种品系大鼠的粪便样本肠道菌群主要为拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、Epsilonbacteraeota门和疣微菌门(Verrucomicrobia),前三者占据90%以上(图2A)。在属分类上,肠道菌群物种多样性程度高,主要为未分类的Muribaculaceae属、毛螺菌属NK4A136组(Lachnospiraceae_NK4A136_group)、另 枝 菌 属(Alistipes)、拟普雷沃菌属(Alloprevotella)、拟杆菌属(Bacteroides)、Muribaculum属、乳 杆 菌属(Lactobacillus)7种菌属(图2B)。
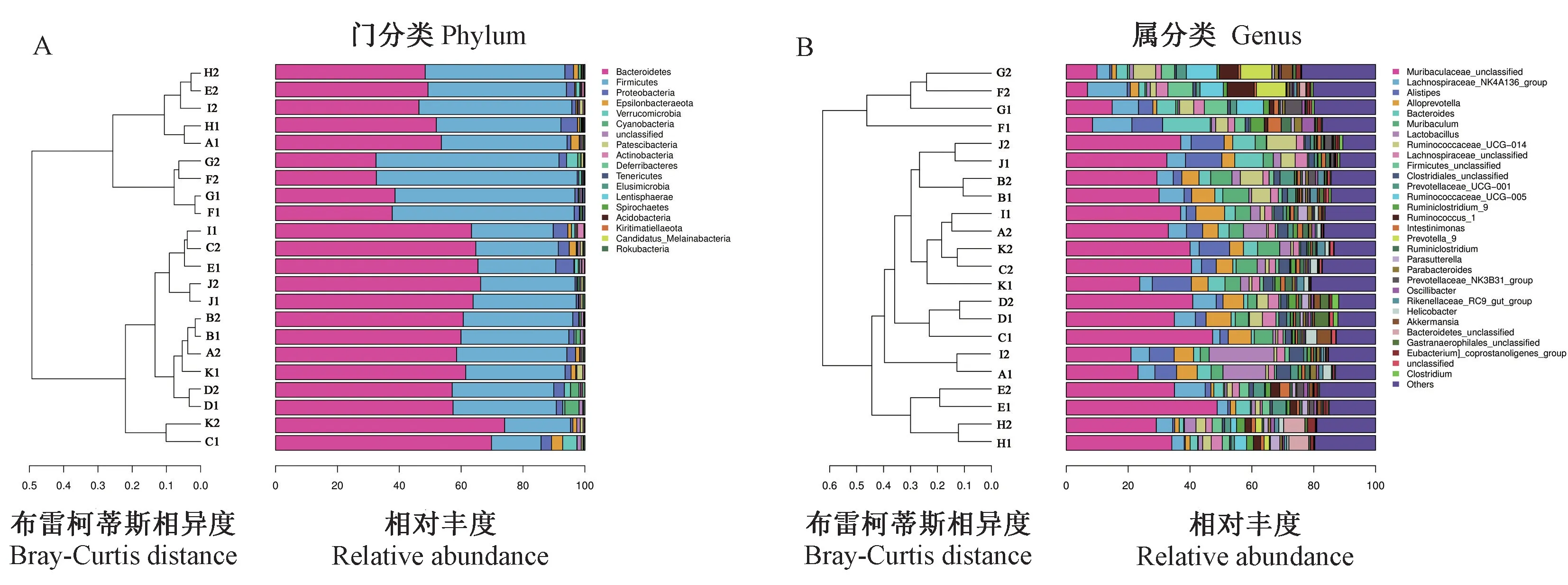
图2 不同来源单位、品种品系和性别的大、小鼠肠道菌群在门与属分类水平上的丰度柱状图Figure 2 Histogram of the abundance of intestinal flora of rats and mice from different source units,breeds,strains and genders at the level of phylum and genus classification
采用Circos圈图分析样本与物种共线性关系以及优势物种的分布情况,并对各样本间的物种丰度进行主坐标分析(principal co-ordinates analysis,PCoA)(图3),可见不同样本间有所交叉并形成四个大类群,动物来源不同可造成肠道菌群物种组成存在差异,如:BWL单位的F1和F2,G1和G2组样本代表的SD、Wistar大鼠肠道菌群相似性较高,而与SY单位的E2和E1,NFY单位的H2和H1组样本代表的SD、Wistar大鼠肠道菌群存在一定差异性,后者未分类的Muribaculaceae属所占相对丰度比例比前者的高;对于同一SY单位中A1和A2、K1和K2、I1和I2、C1和C2组所代表的KM、BALB/c、NIH和C57BL/6品系小鼠肠道菌群相似度较高,但与BWL单位的同种品系小鼠存在差异性;BWL单位中B1和B2、J2和J1、D1和D2组所代表的KM、BALB/c和C57BL/6品系小鼠肠道菌群亦无明显差异性;另外,通过对比小鼠与大鼠品种肠道菌群中优势菌属,发现小鼠肠道菌群中存在较高丰度的Alloprevotella属,而BWL单位F1和F2,G1和G2的大鼠肠道菌群中未分类的Muribaculaceae属相对丰度较低,但G1和F1有更高丰度的Bacteroides属;NFY单位的H2和H1有更高丰度的未分类Bacteroidetes属。最后,通过对所有同一来源单位、同一品种品系、不同性别大小鼠样本间肠道菌群两两比较,其布雷柯蒂斯相异度(bray-curtis diatance)比较接近,未发现存在明显差异性。
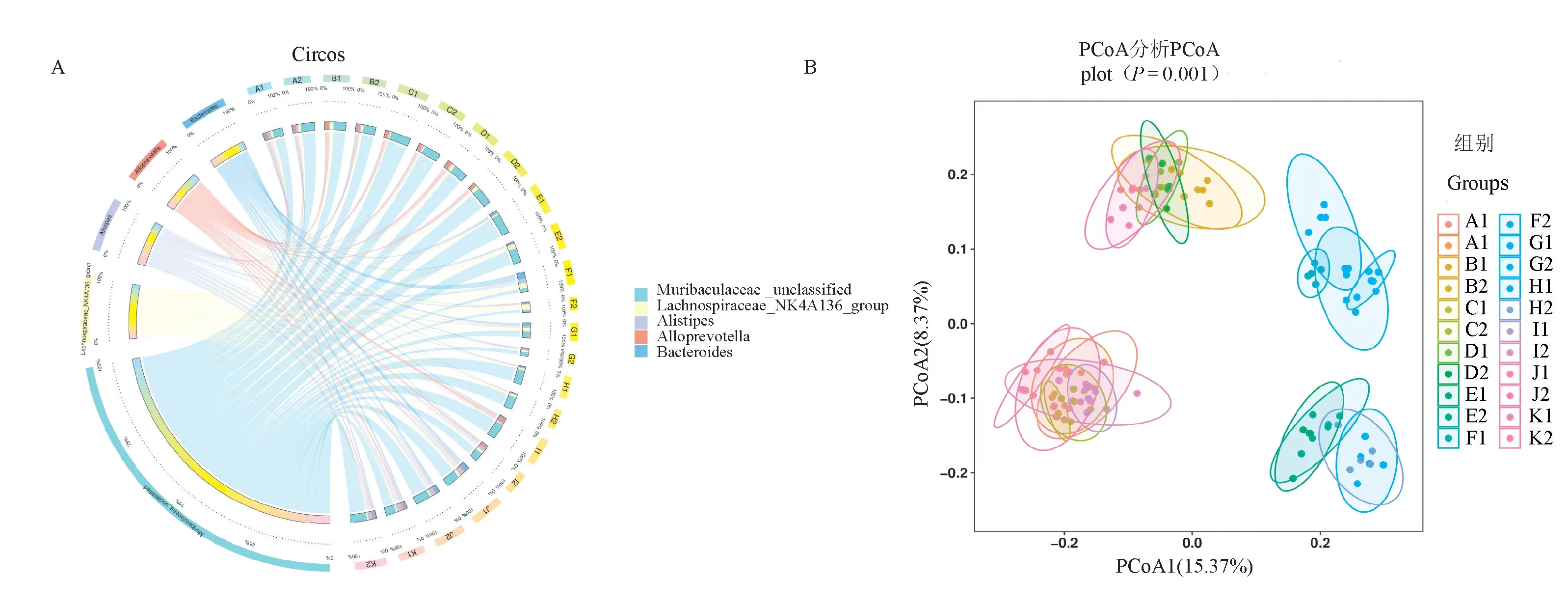
注:Circos圈图左侧代表物种,右侧代表样本组,不同颜色代表不同的分类学门类和样本分组。图3 样本与物种关系Circos圈图与样本间PCoA分析Note.The left side of the Circos circle represents species,and the right side represents sample groups.Different colors represent different taxonomic categories and sample groups.Figure 3 Sample-species relationship Circos circle diagram and PCoA analysis
2.2.2 不同年龄小鼠肠道菌群分析
通过对1周龄、2周龄、3周龄和5周龄NIH小鼠粪便样本分组聚类与PCoA分析(图4),发现各年龄段的雌、雄性小鼠肠道菌群优势菌属种类和相对丰度存在差异性。首先,可观察到I3和I4,I5和I6,I7和I8,I9和I10两两样本组间的布雷柯蒂斯相异度(bray-curtis diatance)最近,其肠道菌群物种构成和相对丰度无明显差异性,说明性别对1~5周龄的雌雄小鼠肠道菌群影响较小。而随着小鼠年龄的增长,肠道菌群是一个动态发展变化的过程,物种的种类数量逐渐增多,且相对丰度发生着不同的变化。小鼠从出生开始,1周龄左右便有肠道菌群的出现,种类最少,多样性较低,以Lactobacillus属,链球菌属(Streptococcus)占据主要地位,且此时雌性小鼠相对雄性小鼠具有较高丰度的假单胞菌属(Pseudomonas);到2周龄,物种的种类明显增多,多样性丰富,Lactobacillus属仍占绝对优势地位,但其相对丰度减少,出现未分类的Muribaculaceae属,Alloprevotella属、Bacteroides属和Proteus属等多种优势菌属;3周龄时,另外观察到出现明显增多的Akkermansia属、Eisenbergiella属、Bilophila属和瘤胃梭菌属(Ruminiclostridium_9)等菌属;5周龄时,则以未 分 类 的Muribaculaceae属、Lactobacillus属、Alloprevotella属、Bacteroides属、Muribaculum属 和Lachnospiraceae_NK4A136_group为主,且发现此时雌性小鼠相对雄性小鼠有较高丰度的未分类的Muribaculaceae属,但只有较低丰度的未分类的Clostridiales属和Alistipes属。进而把5周龄与6~8周龄的NIH小鼠肠道菌群比较分析,发现这两个周龄段的小鼠肠道菌群相似度较高,主要优势菌属一致,说明到5周龄后,肠道菌群已趋于相对稳定共生的状态。

图4 不同周龄NIH小鼠肠道菌群丰度柱状图与PCoA分析Figure 4 Histogram of intestinal flora abundance in NIH mice of different ages and PCoA analysis
2.2.3 不同肠段和粪便样本的小鼠肠道菌群分析
通过对NIH小鼠十二指肠、空肠、回肠、盲肠、结肠、直肠六个不同肠段内容物样本以及粪便样本的菌群进行比较分析(图5),发现小鼠十二指肠、空肠和回肠的肠道菌群物种种类相对较少,主要为Lactobacillus属、未 分 类 的Muribaculaceae属、Candidatus_arthromitus属、Pseudomonas属,且不同性别的小鼠肠道菌群中Candidatus_arthromitus属所占丰度存在一定差异性。小鼠盲肠和结肠中肠道菌群物种种类数量明显增多,多样性丰富且物种丰度比较均衡,主要为未分类的Muribaculaceae属、Lactobacillus属、螺 杆 菌 属(Helicobacter)、Muribaculum属、Alloprevotella属、杜 氏 杆 菌 属(Dubosiella)、Lachnospiraceae_NK4A136_group、Alistipes属八种菌属。然而直肠中以螺杆菌属(Helicobacter)为主,小部分是Lactobacillus属、未分类的Muribaculaceae属和Pseudomonas属。
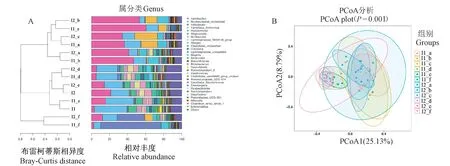
图5 不同肠段和粪便样本的NIH小鼠肠道菌群丰度柱状图与PCoA分析Figure 5 Histogram and PCoA analysis of intestinal flora abundance of NIH mice from different intestinal segments and stool samples
根据粪便样本与不同肠段肠道菌群比较分析结果,发现分组中I1与I1_e,I2与I2_e样本的布雷柯蒂斯相异度(bray-curtis diatance)最近,说明粪便样本与结肠的肠道菌群构成相似性最高。
2.2.4 肠道菌群内物种相关性分析
对属水平分类上的微生物丰度,比较样本中优势菌群物种之间的相关性,绘制出热图以及网络图(图6)。由此可知,优势菌属Muribaculum属与未分类的Muribaculaceae属、Alistipes属、Alloprevotella属存在一定的正相关关系。Lactobacillus属与Streptococcus属、Proteus属和葡萄球菌属(Staphylococcus)存在一定的正相关关系,而与Lachnospiraceae_NK4A136_group、未分类的Muribaculaceae属存在负相关关系。这提示随着肠道内环境的变化,肠道菌群优势菌属存在互相共生共存与竞争抑制的情况。
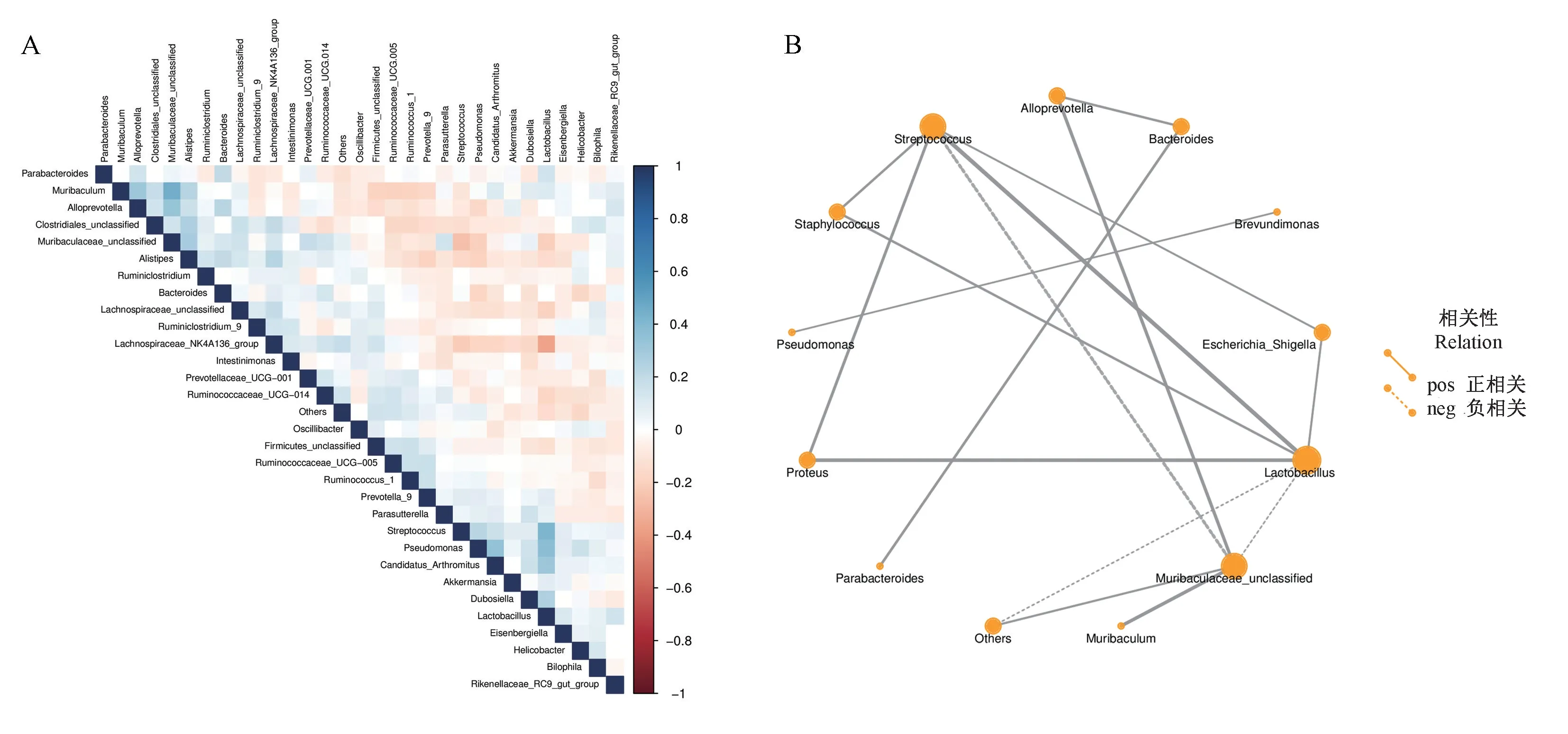
注:A:热图;B:网络图。图6 肠道菌群内物种相关性分析Note.A.Heat map.B.Network map.Figure 6 Species correlation analysis in the intestinal flora
3 讨论
肠道菌群作为人和动物肠道内最复杂多样化的微生物群落,在维持宿主肠道结构和功能、促进营养代谢、调节免疫系统和预防病原菌等方面发挥着重要的作用[12-14]。本研究通过对4种品系小鼠和两种品系大鼠肠道菌群聚类分析,发现小鼠与大鼠肠道菌群具有丰富的多样性,主要有未分类的Muribaculaceae属、毛螺菌属NK4A136、另枝菌属、拟普雷沃菌属、拟杆菌属、Muribaculum属和乳杆菌属7种菌属。相同来源的同个品种动物的肠道菌群相似度较高,小鼠相对大鼠的肠道菌群具有较高丰度的拟普雷沃菌属,两者优势菌属存在一定差异性,而品系、性别对其影响作用较小。究其原因,考虑主要是小鼠或大鼠的基因型决定了其本身品种品系的遗传基础,在不同饲养生存环境作用下,影响着宿主不同的肠道菌群结构组成[15]。随着小鼠年龄的增长,肠道菌群是一个竞争选择动态发展变化的过程。小鼠从出生开始,物种的种类和数量逐渐增多且慢慢趋于稳定,相对丰度发生着相应变化。由早期主要的乳杆菌属和链球菌属慢慢演变为未分类的Muribaculaceae属、乳杆菌属、拟普雷沃菌属、拟杆菌属和Muribaculum属多种优势菌属共生共存的状态。肠道菌群的改变,其优势菌属间互利共存与竞争抑制,又反作用着宿主肠道结构与功能,最终形成一个肠道菌群稳态[15-16]。
本研究还发现,小鼠十二指肠、空肠、回肠、盲肠、结肠和直肠不同肠段菌群分布是不均衡的。随着不同肠段内环境的变化,胃到结肠各肠段的微生物数量快速递增,呈现一定的差异性变化,由十二指肠、空肠和回肠种类较少的乳杆菌属、未分类的Muribaculaceae属、Candidatus_arthromitus属和假单胞菌属,演变为盲肠结肠中菌群种类和数量明显增多的螺杆菌属、Muribaculum属、拟普雷沃菌属、杜氏杆菌属等,而直肠则以螺杆菌属为主。另外,小鼠粪便样本与其结肠的肠道菌群结构相似性最高,而结肠微生物菌群在动物肠道肠段中发挥着重要的生理学功能[17],提示可以通过粪便样来间接评价结肠肠道菌群的变化。此外,本研究对于动物运输过程中应激状态对肠道菌群的影响也值得我们注意,长期慢性应激会导致动物肠道菌群的变化[18]。大量研究也证实,肠道菌群的结构和功能还受到饮食[19-20]、抗生素[21]、益生菌和益生元[22]等多种外源因素的影响。
本研究揭示了动物来源相同的实验小鼠或大鼠的肠道菌群间相似性最高,而实验小鼠与大鼠的肠道菌群因品种不同存在一定差异性。在一定的饲养生存环境下,实验小鼠的年龄和肠段是决定其肠道菌群多样性与差异性的主要内源性因素,而品系、性别对其肠道菌群的影响作用较小。鉴于多种宿主本身因素影响肠道菌群的变化,实验者研究肠道菌群时,须尽量选择同一饲养环境下,同一品种品系的实验动物,且考虑不同肠段与粪便样本肠道菌群的异同,以及样本采集方法的合理性、可重复性和稳定性,优化实验设计,控制多因素变量来观察单一因素的变化,以保证实验结果的准确性与可靠性。
