两种UC小鼠模型的病理损伤和肠道菌群对比研究
2022-01-24谌雪梅彭西叶俏波叶臻邓庆王娟温昌琳袁施彬
谌雪梅,彭西,叶俏波,叶臻,邓庆,王娟,温昌琳,袁施彬*
(1.西华师范大学生命科学学院,四川 南充 637002;2.成都大学药学院,成都 610106;3.成都中医药大学基础医学院,成都 611137;4.四川扬克斯特科技有限公司,成都 611135)
溃疡性结肠炎(ulcerative colitis,UC)是炎症性肠病(inflammatory bowel disease,IBD)的一种,病因与遗传、免疫和环境因素有关,主要引起结肠和直肠黏膜及黏膜下层的非特异性慢性炎症,临床症状包括腹泄、腹痛、便血、呕吐和体重减轻等[1]。UC发病时,可见肠道菌群失衡、肠道免疫反应过度,并兼有肠道黏膜损伤[2]。早在1958年,就有将健康人的粪便功能菌移植进患者体内来治疗UC的报道[3]。临床应用显示,肠道粪菌移植治疗能修复肠道菌群、缓解过度免疫、减轻症状[4],但存在供体菌标准化和耐药菌传播等问题。UC动物模型是研究发病学、筛选药物、评价药效的必要手段,根据建模方法可分为化学性、免疫和基因修饰性两大类[5]。其中,DSS(dextran sulfate sodium)模型和TNBS(2,4,6-trinitrobenzen sulfonic acid)乙醇模型是最常用的化学性动物模型[6-7]。至今尚未见有关于这两种模型肠道菌群改变的对比研究。因此,本实验分别用DSS自由饮法和TNBS乙醇混合物灌肠法,建立C57BL/6小鼠的UC模型,对比研究DSS模型和TNBS模型的结肠病理损伤和菌群构成特征的差异性,丰富了UC动物模型的基础研究资料。结果可为选择不同UC动物模型提供科学依据。
1 材料与方法
1.1 材料
1.1.1 实验动物
6~8周龄的SPF级雄性C57BL/6小鼠30只,由四川大学提供【SCXK(川)2018-026】,体重20~22 g。动物饲养于成都中医药大学【SYXK(川)2017-179】。造模前适应性喂养1周,室温控制20~23℃,湿度控制50%~60%,自然光暗周期。所有实验操作均通过西华师范大学伦理委员会的审查(审准号:CWNU2021D031)。
1.1.2 主要试剂与仪器
DSS(0216011090,MP Bio公司)、TNBS(P2297,西格玛奥德里奇(上海)贸易有限公司)、注射用盐酸替他明盐酸唑拉西泮(外兽药证字43号,法国维克有限公司)、便隐血试剂(BA-2020B,珠海贝索生物技术有限公司)、无水乙醇(64-17-5,成都金山化学试剂有限公司)、苏木素(420699,赛默飞世尔科技公司)、伊红(392155,赛默飞世尔科技公司)。
RM2235石蜡切片机(莱卡,德国)、CX22光学显微镜(莱卡,日本)、DM1000徕卡显微成像系统(莱卡,德国)、819切片刀(莱卡,德国)、KD-98-ⅡA恒温水浴锅(天津市泰斯特仪器有限公司,中国)。
1.2 方法
1.2.1 分组和模型建立
将30只小鼠随机分为对照组、DSS组和TNBS组,每组10只,5只/笼。对照组正常饲喂。DSS组小鼠自由饮用4% DSS药液,每只小鼠药液饮用量为0.04 mL/(g·d)。TNBS组小鼠造模前24 h禁食不禁水。舒泰(注射用盐酸替他明盐酸唑拉西泮)(0.1 mL/100 g)肌肉注射麻醉小鼠,用8号灌肠针从肛门处插入约3~4 cm,将TNBS/乙醇(5%TNBS:50%乙醇=1∶1)混合液按0.1 mL/20 g体重剂量缓慢注入肠腔内。药液注射完后再注入约0.2 mL空气,保持倒立1 min后拔出灌肠针。小鼠苏醒后正常饲喂。造模期7 d。
1.2.2 临床观察
造模期间每日定时称重,观察精神状况和粪便性状,并采用匹拉米洞半定量法测定便隐血。隐血/血便分数评分标准:加显色剂后立即呈紫蓝色(4分);10 s内呈紫蓝色(3分);1 min内呈紫红色(2分);1~2 min内逐渐产生紫红色(1 min);判读时间内无颜色反应(0分)。
1.2.3 样品采集
结肠内容物样品:造模7 d后,用舒泰麻醉处死小鼠,取出结肠组织,置冰盒上,纵向剖开结肠,取结肠内容物放入2 mL无菌防冻管中,液氮速冻后,转移于-80℃冰箱,用于肠道菌群检测。将同组的每3只小鼠的粪便混合成1个样,取3个样进行菌群检测。
结肠组织样品:观察结肠的大体病变并拍照记录,测量结肠的长度和重量后,将结肠组织置4%多聚甲醛液中固定24 h以上,用于组织病理诊断。
1.2.4 组织病理学观察
将固定好的结肠进行梯度乙醇脱水、透明、浸蜡和包埋,制成5 μm厚的石蜡切片,并进行苏木精-伊红(HE)染色,显微镜下观察组织病理损伤情况。
1.2.5 结肠内容物的16S rDNA测序
使用MN NucleoSpin 96 Soi DNA试剂盒提取结肠内容物的细菌总DNA,再用1.8%琼脂糖凝胶电泳检验DNA的浓度和纯度;使用特异性引物(338F-806R)进行PCR扩增;再使用Monarch DNA胶试剂盒回收扩增产物。引物序列为F:5’-ACTCCTACG GGAGGCAGCA-3’;R:5’-GGACTACHVGGGTWTC TAAT-3’。PCR产物经定量和文库构建后,利用Illumina HiSeq 2500平台进行16S rDNA V3+V4测序。
使 用Trimmomatic v0.33、cutadapt 1.9.1、FLASH v1.2.7和UCHIME v4.2软件分析测序所得Raw Reads,经过滤与识别,得到最终有效数据(effective reads)。将有效序列聚类为分类单元(OTUs),对OUTs进行物种注释,在门和属水平绘制物种分布柱状图和聚类树图。使用Mothur软件测算结肠微生物的Alpha多样性指数(包括Ace指数和Shannon指数),进行菌群丰度和多样性评估。用QIIME软件进行非度量多维标定法(Non-MetricMulti-Dimensional Scaling,NMDS)分析。最后通过LefSe(Line Discriminant Analysis(LDA)Effect Size)分析组间Biomarker的统计学差异。
1.3 统计学分析
用SPSS 26.0软件分析实验数据,用平均值±标准差()表示数据结果,用单因素方差法分析组间差异性。P<0.05表示差异具有显著性。
2 结果
2.1 临床观察、结肠长度和重量变化结果
对照组小鼠精神状况良好,无腹泻、软便和便血。DSS组小鼠从造模第3天粪便松软,随后软便现象日趋严重,至第7天排稀溏血便;小鼠精神逐渐萎靡、活动能力下降、毛发失去光泽。TNBS组在造模第1天即有部分小鼠排软便,至第3天,粪便稀软不成形,随后渐趋正常(图1A)。DSS组从造模后第5天体重逐渐下降,TNBS组从第2天急剧下降,随后逐渐上升(图1C)。对照组粪便隐血检测结果均呈阴性;DSS组第5天开始粪便隐血分数显著升高;TNBS组部分小鼠在造模第1天检出粪便隐血阳性,第4天达最高,随后降低(图1D)。
剖检观察:对照组结肠黏膜层的颜色和厚度正常;DSS组结肠明显缩短、肠壁增厚、黏膜层颜色暗沉,局部见深褐色、隆起、点状或圆形或不规则形病灶(三角形区域);TNBS组结肠颜色变红,见少量浅灰褐色,略高于黏膜表面的小病灶(红圈内,图1B)。
结肠重量:DSS组和TNBS组的结肠重量较对照组显著增加(P<0.05),DSS组和TNBS组间无显著差异(P>0.05)(图1E)。结肠长度:DSS组结肠长度较对照组和TNBS组显著变短(P<0.05),对照组和TNBS组之间无显著性差异(P>0.05)(图1F)。
2.2 小鼠结肠组织病理诊断结果
如图2所示,对照组结肠的组织结构层次清晰,黏膜层、黏膜下层和肌肉层清晰可见,隐窝和杯状细胞排列整齐。DSS组结肠黏膜层形成溃疡灶,坏死波及黏膜全层致固有结构消失,结缔组织增生,其间见数量不等的炎症细胞浸润(三角形);溃疡灶附近的隐窝扩张(星号)。TNBS组结肠黏膜层的隐窝上皮细胞和杯状细胞增生,局部细胞层次增厚,偶见分支结构形成(箭头);隐窝间结缔组织增生并伴有数量不等的炎性细胞浸润(方框),致隐窝间隙增宽。

注:A:粪便性状变化;B:剖检病变;C:体重变化;D:粪隐血分数变化;E:结肠重量变化;F:结肠长度变;与正常组比较,*P<0.05;与DSS组比较,#P<0.05。(下图同)图1 各实验组小鼠体重、隐血分数、结肠长度和重量比较Note.A.Changes of fecal traits.B.Anatomic appearance.C.Weight change.D.Fecal occult blood fraction changes.E.Changes in colonic weight.F.Changes in colonic length.Compared with the normal group,*P<0.05.Compared with the DSS group,#P<0.05.(The same in the following figures)Figure 1 Comparison of body weight,fecal occult blood fraction,colonic length and weight of mice in different experimental groups
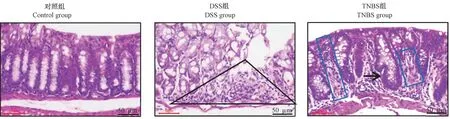
图2 各组小鼠结肠的组织病理变化Figure 2 Histopathological changes of mice colon in each group
2.3 小鼠肠道菌群测序结果
2.3.1 结肠内容物测序结果评估
此次测序共获得1 185 788对Reads,1 185 631条Clean Reads,每个样品平均有79 042条Clean Reads。各组样品的GC含量均在54%左右。
测序量与OTUs的相关曲线图3A显示,测序量达一定数值后,OUT数量值稳定,样本曲线趋于平缓,表明此次实验的测序数据量能全面反映样本中总的OTUs量。用OTU数量绘制Venn图3B:三组共有283个OTU,对照组和DSS组分别特有OTU为1个和25个。DSS组(329个)显著高于对照组(309个)和TNBS组(311个)(P<0.05)。
2.3.2 结肠内容物的菌群多样性分析
用Alpha多样性分析来反映菌群的丰度和多样性,其中shannon指数用来估算样品中微生物的多样性,shannon指数越大,菌群多样性越大。本实验中各组间的shannon指数无显著差异(P>0.05)。Ace指数代表菌群丰富度,Ace指数越大,样品中菌群的丰富度越高。与TNBS组(293.38)和对照组(294.79)相比,DSS组(314.95)小鼠菌群的Ace指数最大(P<0.05)(图3C)。经NMDS分析:各组内样品距离接近,菌群差异较小;反之,菌群差异较大(图3D)。UPGMA聚类树图表明,对照组和TNBS组菌群的亲缘关系更近(图3E)。

注:A:样本稀释曲线;B:OTU分析,数值代表OTU数量;C:Ace指数箱型图;D:NMDS分析图,同组样品使用同种颜色表示;E:聚类树图。图3 结肠内容物的菌群丰度和多样性变化Note.A.Sample dilution curve.B.The result of OTU analysis,the number represents the number of OTU.C.ACE index box chart.D.NMDS analysis diagram,in which each point represents a sample,and the samples in same group is represented by the same color.E.UPGMA Cluster tree diagram.Figure 3 Changes in abundance and diversity of bacteria in colonic contents
2.3.3 肠道菌群物种注释和差异性分析
对门水平丰度前10的菌群进行统计,其中拟杆菌门(Bacteroidia)和厚壁菌门(Firmicutes)占比最大(>75%)。与对照组相比,DSS组拟杆菌门、变形菌门(Proteobacteria)、Patescibacteria、放 线 菌 门(Actinobacteria)和脱铁杆菌门(Deferribacteres)相对丰富度降低(P<0.05);厚壁菌门、疣微菌门(Verrucomicrobia)相对丰度增高(P<0.05)。TNBS组拟杆菌门、变形菌门、Patescibacteria、脱铁杆菌门和酸杆菌门(Acidobacteria)相对丰度降低(P<0.05),厚壁菌门、疣微菌门、软壁菌门(Tenericutes)和蓝藻菌门(Cyanobacteria)相对丰度升高(P<0.05)(见图4A,4B,4C,4D,4E)。
对属水平丰度前10的菌群进行统计分析。与对照 组 相 比,DSS组uncultured_bacterium_f_Muribaculaceae、乳杆菌属(Lactobacillus)、脱硫弧菌属(Desulfovibrio)、Alistipes和Candidatus_Saccharimonas相对丰度降低(P<0.05),uncultured_bacterium_f_Lachnospiraceae、Akkermansia和拟杆菌属(Bacteroides)相对 丰度 上 升(P<0.05);TNBS组uncultured_bacterium_f_Muribaculaceae、脱硫弧菌属、Alistipes、拟杆菌属和Candidatus_Saccharimonas相对丰度降低(P<0.05),Lachnospiraceae_NK4A136_group、uncultured_bacterium_f_Lachnospiraceae和Akkermansia相对丰度升高(P<0.05)(见图4F,4G,4H,4I,4J)。
通过LefSe分析比较各组间显著性差异物种,3组共有28个丰度靠前的显著性差异物种,以LDA值大于3.5为筛选标准,确定各个组中丰度较高的微生物。通过LefSe分析显示,DSS组显著性最高的 是Clostridium_sensu_stricto_1、梭 菌 目(Clostridiales)、梭菌科(Clostridiaceae)、uncultured_bacterium_f_Lachnospiraceae和梭菌属(Clostridia);TNBS组显著性最高的是Eubacterium__xylanophilum_group(见图5A,5B)。

注:A:门水平丰度前10的物种丰度柱状图;B、C、D、E:各组门水平丰度前10的物种显著性;F:各组属水平丰度前10的物种丰度柱状图;G、H、I、J:各组属水平丰度前10存在显著性差异物种。图4 各组小鼠菌群组成和差异分析Note.A.Bar chart of the top 10 species in horizontal abundance of each phyla.B,C,D,E.The top 10 species with significant differences in the level abundance of phyla.F.Bar charts of the top 10 species in horizontal abundance of each genus.G,H,I,J.The first 10 species showed significant differences in horizontal abundance among each group.Figure 4 Microflora composition and difference analysis of each group
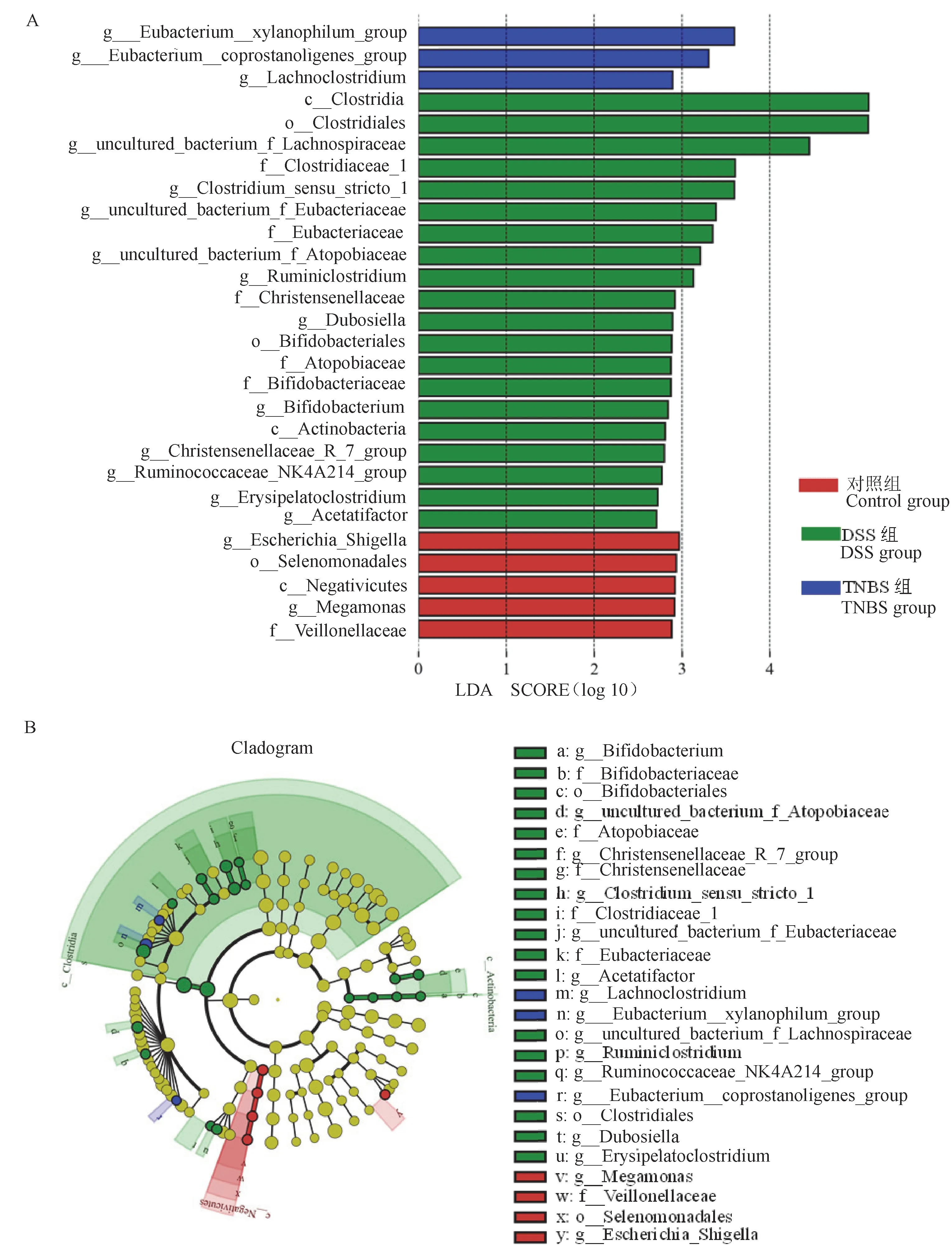
注:A:LDA值分布柱状图;B:进化分支图。由内至外辐射的圆圈代表了由门至种的分类级别;在不同分类级别上的每一个小圆圈代表该水平下的一个分类,小圆圈直径大小与相对丰度大小呈正比;着色原则为将无显著差异的物种统一着色为黄色,红色、绿色和蓝色分别代表对照组、DSS组和TNBS组。图5 LefSe显著性分析Note.A.Histogram of LDA value distribution.B.Evolutionary branching.The circles radiating from the inside to the outside represent classification levels from phylum to species.Each small circle at different taxonomic levels represents a taxon at that level,and the diameter of the small circle is proportional to the relative abundance.The coloring principle was that the species without significant differences were uniformly colored yellow,red,green and blue represented the control group,DSS model group and TNBS model group,respectively.Figure 5 Significance analysis of LEFSE
3 讨论
UC动物模型是研究发病机制和药物筛选的重要手段,其中DSS和TNBS诱导的UC模型最为常用。已有研究报道,这两种模型均表现为肠道粘膜屏障功能降低、肠道免疫功能紊乱并触发炎症反应、肠道菌群失衡、肠道形态结构受损,与人体患者的损伤特征相似[8-9]。但很少有文献资料系统研究两种模型的差异性。本研究重点关注DSS和TNBS诱导的UC小鼠模型在临床症状、病理变化特征和肠道菌群构成上的差异。
临床症状显示,DSS组和TNBS组小鼠均表现为稀便、血便和体重波动,但各有自身特征。DSS组从造模第3天,稀便和血便症状逐渐加重;TNBS组造模当天血便,第3天时稀便和血便最严重,随后逐渐恢复。本实验DSS组临床症状与已有研究较一致,仅粪便性状改变的时间存在差异,原因可能与不同的药液浓度、实验动物种属、造模周期等因素有关[10]。也有研究报道TNBS小鼠血便症状先加重再恢复[11-12]。两种模型病程进展的差异性与成模机制密切相关。DSS不直接腐蚀肠壁,而是缓慢渐进性损伤肠上皮细胞,致细菌、肠内抗原等促炎物质进入黏膜层而引发炎症[13];TNBS造模时,乙醇灼伤肠黏膜后,TNBS与组织内赖氨酸的ε基团结合形成完全抗原,引起免疫应答性炎症反应[14]。
剖检显示,两种模型的结肠均表现为重量增加和溃疡灶形成。病理组织变化的共同特征为结肠黏膜上皮细胞和杯状细胞坏死、结缔组织增生和炎性细胞浸润。不同之处有二:一是结肠溃疡灶结构不同,DSS组溃疡灶部位固有层消失,而TNBS组溃疡灶内残留隐窝结构;二是隐窝病变特征不同,DSS组隐窝扩张更明显,胞核成分减少,而TNBS组隐窝壁上的细胞核成分致密。已有研究显示,DSS模型[15-16]和TNBS模型[17-18]的病理损伤特征相似,包括结肠缩短、黏膜层结构受损、炎性水肿和炎性浸润。对人UC的研究显示,结肠的组织病理变化包括上皮损伤、隐窝扩张、细胞增生和炎症反应[8]。本实验中TNBS组发生明显的隐窝细胞增生,与人UC的病变特征更接近,提示TNBS模型可能更适用于人UC的发病机理和药物筛选研究。
门水平丰度的菌群测序结果显示两种模型的相同之处是:DSS组和TNBS组拟杆菌门、变形菌门、Patescibacteria和脱铁杆菌门的相对丰度都降低,厚壁菌门和疣微菌门的相对丰度均升高;不同之处是:软壁菌门和蓝藻菌门的丰度在TNBS组增加而在DSS组无显著性变化;放线菌门丰度仅在DSS组显著降低,酸杆菌门丰度仅在TNBS组显著降低。属水平丰度的测序结果显示,DSS组和TNBS组uncultured_bacterium_f_Muribaculaceae、脱硫弧菌属、Alistipes和Candidatus_Saccharimonas的相对丰度降低,uncultured_bacterium_f_Lachnospiraceae和Akkermansia的相对丰度升高;区别在于乳杆菌属仅在DSS组丰度降低,拟杆菌属在DSS组丰度上升而在TNBS组显著下降。结果表明,两种UC模型的肠道菌群在门水平和属水平上均与对照组显著不同,发生了明显的菌群结构紊乱。已有研究表明,UC患者或UC模型动物不同门和属细菌的相对丰度改变,均反映出肠道菌群结构紊乱[19-22]。肠道菌群是肠道微生态系统的重要组成部分,参与营养和能量供应、保护肠道粘膜屏障、调节宿主免疫[3,23-24]。本实验中,肠道菌群结构紊乱可能加重结肠的组织病理损伤和功能紊乱。在DSS和TNBS模型中菌群变化,会对结肠上皮屏障和免疫功能产生特定的干扰作用。因此本实验进一步分析了3种常见菌群变化对UC潜在的损伤机制。
在属水平上,与对照组相比,疣微菌门中的Akkermansia的相对丰度在两个模型组中都异常升高,其中DSS组最高。部分研究认为,Akkermansia相对丰度与结肠炎小鼠的组织病理损伤和炎症呈正相关[25-26]。也有研究观察到它的丰度与肠道炎症呈负相关,原因是Akkermansia中的艾克曼菌在人体肠道中定植,有维持肠道菌群、保护肠粘膜、减轻肠道炎症和调节糖脂代等作用[27-29]。因此,艾克曼菌异常增多对机体是否有益存在争议,还需进一步探究。
拟杆菌属是与炎症性肠病高度有关的微生物群[30]。与对照组比较,DSS组拟杆菌属相对丰度显著升高;TNBS组相对丰度降低,与已有研究结果一致[31-32]。拟杆菌是一种中性菌,若发生不稳定增殖则为致病菌,吕志堂等[33]发现拟杆菌属中的脆弱拟杆菌与结直肠癌和炎症性肠病密切相关。脆弱拟杆菌分为产肠毒素脆弱拟杆菌(enterotoxigenicBacterodies friagilis,ETBF)和非产肠毒素脆弱拟杆菌(nontoxigenicBacterodies friagilis,NTBF)[34-35]。有研究发现[36-37]结直肠癌患者肠道中的ETBF数量明显升高,其可能的致癌机制包括干扰粘膜免疫反应、诱导上皮细胞变化等[38];而NTBF通过产生胞外多糖保护结肠黏膜免受致炎因子侵害[39],抑制结肠炎和结直肠癌的发展[40]。本实验DSS组中拟杆菌属的丰度升高是否与致病性ETBF增多有关,TNBS组中拟杆菌属丰度降低是否与NTBF减少有关,尚需进一步研究。
与对照组相比,DSS组中乳杆菌属丰度显著降低,TNBS组无差异。乳杆菌属中乳酸菌是厚壁菌门中的有益菌,具有抗致病菌、增强上皮屏障、调节免疫等作用,主要通过分泌短链脂肪酸阻止致病菌入侵和增殖,恢复肠道菌群平衡,减少肠道炎症的产生[41-42]。因此,本实验中,乳酸菌减少与DSS组小鼠的结肠上皮损伤和炎症反应的活跃密切相关。
综上所述,DSS和TNBS建立的UC小鼠模型在临床症状、结肠组织病理损伤和肠道菌群组成上均有异同,实验结果不仅为UC发病机理的研究提供理论依据,也可为筛选UC治疗药物及药效研究时选择不同动物模型提供参考。
