大鼠混合细菌感染性肺炎模型的建立与评价
2022-01-24彭冬冬陈相池夏伟刘学武王菲
彭冬冬,陈相池,夏伟,刘学武,王菲
(1.新药药效与安全性评价湖南省重点实验室,长沙 410331;2.湖南普瑞玛药物研究中心有限公司,长沙 410331;3.上海市第十人民医院,上海 200072)
肺炎是临床上常见的呼吸道疾病,发病率、死亡率常年居高不下,对人们的健康危害极大,对老人和儿童尤甚,在中国每年约有2100万儿童罹患肺炎[1]。肺炎按病因可分为细菌性肺炎、非典型病原体所致肺炎、病毒性肺炎、肺真菌病、其他病原体所致肺炎等,其中细菌性肺炎最为常见[2]。近年来,国内外学者多采用金黄色葡萄球菌、肺炎链球菌,大肠杆菌、铜绿假单胞菌、肺炎克雷伯杆菌等细菌构建单一细菌感染肺炎模型[3-5],但多种细菌混合后的肺炎感染建模鲜有报道。最新的文献均指出越来越多的社区获得性肺炎(community-acquired pneumonia,CAP)病例中诊断出多种微生物混合感染,它们包括细菌、病毒和真菌等多种组合,其中以细菌合并感染最普遍。常见的混合细菌包括肺炎链球菌、金黄色葡萄球菌以及一些非典型病原体,如肺炎支原体和肺炎衣原体等,它们之间的组合是CAP常见的发病原因。混合细菌性肺炎存在于所有年龄段,除以肺炎链球菌为主要病原体的情况外,约10%~35%的肺炎病例为多种细菌混合感染。由于细菌之间的相互作用,会影响混合细菌感染性肺炎病情的诊断,并且使得病情更加严重,治疗手段有限、治疗效果差[6-7]。然而目前对于混合细菌感染性肺炎药物治疗效果评价的研究却很少,因此有必要对其进行研究[8-9]。本研究拟采用金黄色葡萄球菌、肺炎链球菌以及大肠杆菌等比例混后侵染大鼠,建立细菌性肺炎模型,旨在建立稳定的混合细菌感染性肺炎模型,为细菌性肺炎发病机制研究及抗细菌感染性肺炎药物的评价提供新思路。
1 材料与方法
1.1 材料
1.1.1 实验动物
36只5~6周龄SPF级SD大鼠,雌雄各半,体重(200±20)g,由北京维通利华实验动物技术有限公司提供【SCXK(京)2016-0006】,饲养于湖南省药物安全评价研究中心病原微生物实验室(ABSL-Ⅱ)(长卫计实备字(2019)第B001号)【SYXK(湘)2020-0015】,期间给予鼠全价颗粒饲料,自由饮水,室温(23±2)℃,湿度40%~60%,光照明暗各12 h,通风良好。动物实验经湖南省药物安全评价研究中心实验动物管理伦理委员会批准(IACUC2020(3)038)。
1.1.2 病原微生物
金黄色葡萄球菌,肺炎链球菌,大肠杆菌标准株,由中国人民解放军第四军医大学检验科赠送,在本中心病原微生物实验室培养和扩增。实验前1 d将3种菌株接种于羊血琼脂糖平板上,于CO2恒温培养箱中37℃培养18~24 h后,收集细菌。将上述3株细菌收集液用无菌0.9%氯化钠注射液稀释至1×108CFU/mL,再将3株细菌收集液按1∶1∶1混合后,备用。
1.1.3 主要试剂与仪器
注射用乳糖酸红霉素(规格:以红霉素计0.25 g/瓶,批号:190602,由东易和天生物科技有限公司生产)、丙泊酚乳状注射液(规格:20 mL:0.2 g,批号:21912183,由西安力邦制药有限公司生产)、大鼠肿瘤坏死因子α(TNF-α)(批号:09/2020)、大鼠白细胞介素6(IL-6)(批号:09/2020),以上试剂盒均由江苏酶免实业有限公司提供。BCR-RI01-30-C12-PPSU型大鼠独立通气笼盒系统(山东新华医疗器械股份有限公司)、BSC1300-II-A2型生物安全柜(山东新华医疗器械股份有限公司)、HRHMNE3026型小动物单浓度口鼻吸入染毒系统(北京慧荣和科技有限公司)、BC-5000Vet型兽用五分类血液细胞分析仪(深圳迈瑞公司)、DFC 420C型病理成像系统(德国Leica公司)、Spectra Max i3x型多功能酶标仪(上海美谷光子公司)、小动物肺功能检测系统(上海塔望智能科技有限公司)。
1.2 方法
1.2.1 造模与给药
麻醉大鼠,将其仰卧解剖板上呈30°~45°角倾斜位置,用1 mL的注射器吸取混合细菌液0.5 mL,连接穿刺长针,耳镜下暴露大鼠气管,注入气管内,抽出插管后,将实验动物保持头高脚低位,并轻轻左右旋转体位,使菌液均匀分布于大鼠的两肺。造模后2 h进行口鼻吸入给药,红霉素组大鼠经口鼻吸入给予5 mg/mL红霉素溶液,雾化时设置气溶胶质量检测仪浓度范围为14 000~16 000 mg/cm3,空白对照组与模型对照组按相同方法给予0.9%氯化钠注射液,每天3次,每次10 min,每次间隔4 h,连续给药7 d。
1.2.2 观察指标
(1)一般观察:观察各组大鼠活动状况、背毛、呼吸、自主活动等情况。
(2)体温测定:各组于造模第3、7天,采用MC-347型电子体温计测量大鼠肛温。
(3)肺功能检查:各组于造模第3、7天,按性别随机取6只大鼠,雌雄各半,采用尾静脉注射10 mg/kg丙泊酚乳状注射液(10 mg/mL)麻醉,麻醉后分离气管进行插管,采用小动物肺功能检测仪检测大鼠潮气量(VT)、呼吸频率(f)、每分通气量(MV)、用力肺活量(FVC)、第0.2秒量(FEV200),并计算FEV200/FVC。
(4)肺泡灌洗液中白细胞(WBC)与中性粒细胞(Neu)含量测定:各组于造模第3、7天,首先对大鼠左侧主支气管结扎,采用2 mL的0.9%氯化钠注射液对大鼠右侧肺部进行灌洗,抽取3次,收集肺泡灌洗液(BALF),采用兽用五分类血液细胞分析仪检测WBC数目及Neu%。
(5)BALF中IL-6、TNF-α含量测定:将收集到的灌洗液转移至试管内,采用酶联免疫吸附法测定,具体如下:将样品稀释液和待测样品加入各样本孔,加入酶标试剂后37℃温育60 min。使用配好的洗涤液洗涤5次后加入显色剂,37℃避光反应15 min后加入终止液中止反应,终止反应后15 min内应用酶标仪检测450 nm处吸光度(OD),计算样本中浓度。
(6)肺组织病理学观察:收集肺泡灌洗液后腹主动脉放血安乐死,解剖取左侧下叶肺组织置于10%中性福尔马林溶液固定,经HE染色后,采用DFC 420C型病理成像系统观察肺组织病理学改变。
(7)肺组织细菌培养计数:除空白对照组外,其余每组中随机抽取6只动物(首次及末次解剖各随机挑选6只),雌雄各半,取左侧中叶肺组织,用0.9%氯化钠注射液清洗表面血迹。称取肺组织1.0 g于无菌的Ep管中,加入1 mL无菌生理盐水研磨成匀浆,采用10倍梯度进行稀释(即10-1、10-2、10-3、10-4、10-5……),选择适宜的2个梯度于选择性培养基上,且每个梯度做2个平行,置(36±1)℃培养24 h后进行细菌计数。
1.3 统计学方法
采用SPSS 22.0软件进行统计学处理,各组数据在分析前进行正态性检验和方差齐性检验,正态分布数据以平均值±标准差()表示,非正态分布数据用中位数表示。两组均数比较采用t检验,多组均数比较采用单因素方差分析,以P<0.05为差异具有统学意义。
2 结果
2.1 一般状态
整个试验期间,空白对照组大鼠背毛光泽、活动能力强、饮食无异常、呼吸状态平稳,无气促现象、无其他异常;模型对照组给大鼠,给药期间背毛无光泽、呼吸急促、活动减少;红霉素组大鼠给药前期背毛无光泽,出现呼吸急促、活动减少现象,但随着给药时间的延长,上述状况明显好转,给药结束时,该组大鼠呼吸状态趋于正常,活动亦明显增多。
2.2 各组大鼠体温变化比较
如表1所示,与空白对照组比较,模型对照组造模第3~7天体温显著升高(P<0.01);与模型对照组比较,红霉素组造模第4~6天体温明显降低。
表1 各组大鼠不同时间体温变化比较(,n=6)Table 1 Comparison of body temperature changes of rats in different groups at different times(,n=6)
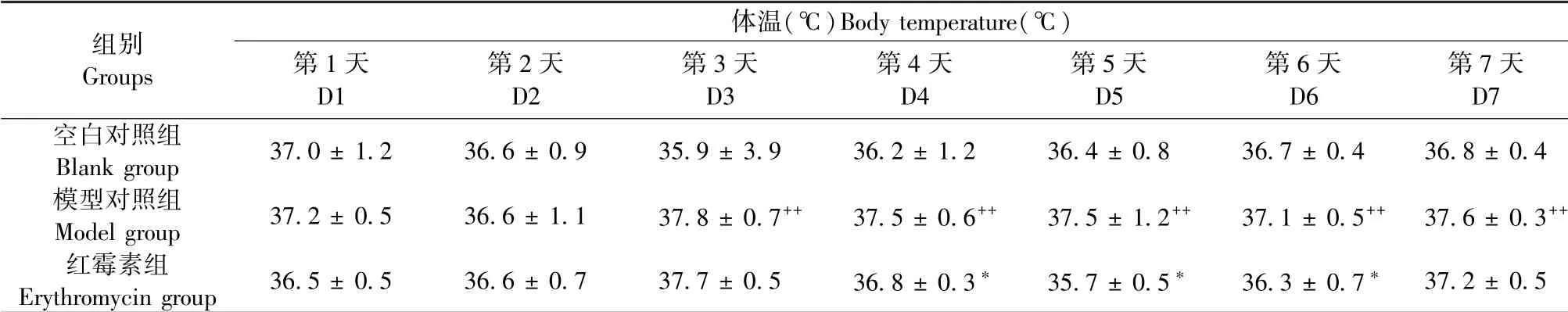
表1 各组大鼠不同时间体温变化比较(,n=6)Table 1 Comparison of body temperature changes of rats in different groups at different times(,n=6)
注:与空白对照组相比,++P<0.01;与模型对照组相比,*P<0.05。Note.Compared with blank group,++P<0.01.Compared with model group,*P<0.05.
组别Groups体温(℃)Body temperature(℃)第1天D1第2天D2第3天D3第4天D4第5天D5第6天D6第7天D7空白对照组Blank group 37.0±1.2 36.6±0.9 35.9±3.9 36.2±1.2 36.4±0.8 36.7±0.4 36.8±0.4模型对照组Model group 37.2±0.5 36.6±1.1 37.8±0.7++ 37.5±0.6++ 37.5±1.2++ 37.1±0.5++ 37.6±0.3++红霉素组Erythromycin group 36.5±0.5 36.6±0.7 37.7±0.5 36.8±0.3* 35.7±0.5* 36.3±0.7* 37.2±0.5
2.3 各组大鼠肺功能指标比较
如图1所示,造模第3、7天,模型对照组大鼠最大呼气及吸气流量较空白对照组均有明显降低,提示混合菌感染大鼠后,肺通气功能下降;模型大鼠经过雾化吸入红霉素溶液,发现大鼠最大呼气及吸气流量有所增加,提示红霉素可改善肺通气功能;造模第3天后,与空白对照组比较,模型对照组用力肺活量(FVC)显著减小(P<0.01)。与模型对照组比较,红霉素组潮气量(VT)呈增加趋势,呼吸频率(f)呈降低趋势,但无显著性差异,每分通气量(MV)无显著变化;红霉素组FEV200/FVC显著增加(P<0.01)。提示,肺炎早期由于肺的通气功能受限,机体会通过增加呼吸频率,进而维持通气量的恒定。造模第7天后,与空白对照组比较,模型对照组潮气量、FEV200/FVC均显著减小(P<0.05,P<0.01);与模型对照组比较,红霉素组呼吸频率、每分通气量、FCV、FEV200呈上升趋势,但无统计学差异,潮气量、FEV200/FVC均显著增加(P<0.01)(见表2,表3)。
表3 造模第7天各组大鼠肺功能指标比较(,n=6)Table 3 Comparison of lung function indexes of rats in each group 7 days of modeling(,n=6)

表3 造模第7天各组大鼠肺功能指标比较(,n=6)Table 3 Comparison of lung function indexes of rats in each group 7 days of modeling(,n=6)
组别Groups VT(mL) f(次/min) MV(L/min) FVC(mL) FEV200(mL) FEV200/FVC(%)空白对照组Blank group 1.78±0.23 116±10 0.21±0.03 4.75±1.89 4.43±1.70 93.58±1.50模型对照组Model group 1.22±0.22++ 125±15 0.15±0.01 3.55±0.45 2.93±0.63 81.63±7.70++红霉素组Erythromycin group 1.67±0.24** 130±25 0.21±0.01 3.68±0.20 3.40±0.12 92.36±2.94**

注:造模D3、D7空白对照组、模型对照组和红霉素组肺通气功能图谱(图中蓝线和红线箭头分别代表最大呼气流量和最大吸气流量)。图1 不同时期各组大鼠肺通气功能图谱及肺功能指标Note.Modeling D3,D7 lung ventilation function map of blank control group,model control group and erythromycin group(The blue and red arrows represent the maximum expiratory and inspiratory flows respectively).Figure 1 Lung ventilatory function map and lung function index of rats in different periods
表2 造模第3天各组大鼠肺功能指标比较(,n=6)Table 2 Comparison of lung function indexes of rats in each group 3 days of modeling(,n=6)
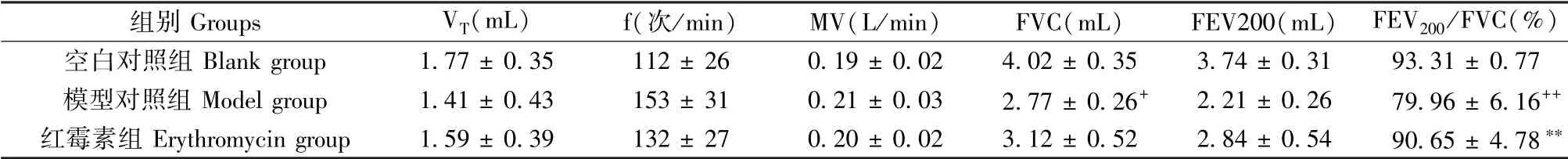
表2 造模第3天各组大鼠肺功能指标比较(,n=6)Table 2 Comparison of lung function indexes of rats in each group 3 days of modeling(,n=6)
注:与空白对照组比较,+P<0.05,++P<0.01;与模型对照组比较,**P<0.01。(下图/表同)Note.Compared with blank group,+P<0.05,++P<0.01.Compared with model control group,**P<0.01.(The same in the following figures and tables)
组别Groups VT(mL) f(次/min) MV(L/min) FVC(mL) FEV200(mL)FEV200/FVC(%)空白对照组Blank group 1.77±0.35 112±26 0.19±0.02 4.02±0.35 3.74±0.31 93.31±0.77模型对照组Model group 1.41±0.43 153±31 0.21±0.03 2.77±0.26+ 2.21±0.26 79.96±6.16++红霉素组Erythromycin group 1.59±0.39 132±27 0.20±0.02 3.12±0.52 2.84±0.54 90.65±4.78**
2.4 各组大鼠BALF中WBC与Neu%比较
如表4所示,造模第3天,与空白对照组比较,模型对照组白细胞数目显著增加(P<0.05);与模型对照组比较,红霉素组白细胞数目显著减少(P<0.01),中性粒细胞百分比(Neu%)无显著性差异。造模第7天,与空白对照组比较,模型对照组白细胞数目、中性粒细胞百分比显著增加(P<0.05,P<0.01);与模型对照组比较,红霉素组白细胞数目均显著减小(P<0.01)。值得关注的是,模型大鼠在造模后第7天白细胞数目较造模后第3天有一定的降低,提示肺炎大鼠在造模后第7天可能有自愈趋势。
表4 不同时期各组大鼠BALF中WBC、Neu(%)比较(,n=6)Table 4 Comparison of WBC and Neu(%)in BALF of different groups of rats in different periods(,n=6)

表4 不同时期各组大鼠BALF中WBC、Neu(%)比较(,n=6)Table 4 Comparison of WBC and Neu(%)in BALF of different groups of rats in different periods(,n=6)
造模第3天3 days of modeling 造模第7天7 days of modeling组别Groups WBC(109/L) Neu(%) WBC(109/L) Neu(%)空白对照组Blank group 0.34±0.06 44.6±18.0 0.14±0.11 38.4±11.8模型对照组Model group 1.71±1.21++ 55.1±7.1 0.64±0.17++ 55.5±11.0+红霉素组Erythromycin group 0.89±0.37** 57.4±5.8 0.33±0.18** 45.7±12.2
2.5 各组大鼠BALF中IL-6、TNF-α比较
如表5所示,造模第3天,与空白对照组比较,模型对照组IL-6、TNF-α显著增加(P<0.01);与模型对照组比较,红霉素组IL-6虽一定程度降低,但无统计学差异,红霉素组TNF-α较模型对照组显著减小(P<0.01)。造模第7天,与空白对照组比较,模型对照组IL-6、TNF-α显著增加(P<0.01);与模型对照组比较,红霉素组IL-6、TNF-α均显著降低(P<0.05,P<0.01)。
表5 不同时期各组大鼠BALF中IL-6、TNF-α比较(,n=6)Table 5 Comparison of IL-6 and TNF-α in BALF of different groups of rats in different periods(,n=6)

表5 不同时期各组大鼠BALF中IL-6、TNF-α比较(,n=6)Table 5 Comparison of IL-6 and TNF-α in BALF of different groups of rats in different periods(,n=6)
造模第3天3 days of modeling 造模第7天7 days of modeling组别Groups IL-6(pg/mL) TNF-α(pg/mL) IL-6(pg/mL) TNF-α(pg/mL)空白对照组Blank group 129.8±1.8 270.4±20.2 121.14±4.8 256.7±6.3模型对照组Model group 152.2±6.2++ 326.6±8.1++ 152.6±8.1++ 310.6±24.7++红霉素组Erythromycin group 146.3±4.4 298.1±4.4** 141.3±3.9** 258.6±11.9**
2.6 肺组织病理形态改变
如图2所示,空白对照组大鼠肺泡以及肺间质的组织结构均为正常,首次解剖,模型对照组肺泡结构被破坏,肺泡壁明显增厚,可见肺泡壁血管充血,炎症细胞大量浸润,红霉素组均可见肺泡壁增厚,肺泡壁血管有微量充血,炎症细胞浸润,肺泡结构异常,但上述病理改变较模型对照组均有明显改善。末次解剖模型对照组肺泡壁增厚明显,可见肺泡壁血管少量充血,炎症细胞大量浸润,值得注意的是,末次解剖模型对照组肺组织在炎症细胞浸润方面较首次解剖有所减轻,与肺炎大鼠肺泡灌洗液白细胞结果基本一致,提示该肺炎模型在造模后7 d有一定自愈趋势。

图2 不同时期各组大鼠肺组织苏木精和伊红染色法结果(n=6)Figure 2 Results of hematoxylin and eosin staining in lung tissues of rats in different periods(n=6)
2.7 肺组织细菌培养计数
如表6所示,与模型对照组比较,造模第3天,红霉素组动物肺组织中大肠埃希菌、金黄葡萄球菌、肺炎链球菌数目大幅度的降低(P<0.01),造模第7天,红霉素组动物肺组织中大肠埃希菌、金黄葡萄球菌、肺炎链球菌数目大幅度的降低(P<0.01)。
表6 不同时期各组大鼠肺组织细菌培养计数比较(,n=6)Table 6 Comparison of bacterial culture counts of lung tissue in different groups of rats in different periods(n=6)

表6 不同时期各组大鼠肺组织细菌培养计数比较(,n=6)Table 6 Comparison of bacterial culture counts of lung tissue in different groups of rats in different periods(n=6)
第3天(CFU/mL)Number of bacteria D3(CFU/mL)第7天(CFU/mL)Number of bacteria D7(CFU/mL)组别Groups 大肠埃希菌Escherichia coli金黄葡萄球菌Staphylococcus aureus肺炎链球菌Streptococcus pneumoniae大肠埃希菌Escherichia coli金黄葡萄球菌Staphylococcus aureus肺炎链球菌Streptococcus pneumoniae模型对照组Model group 3100±544 5027±1017 4730±1062 3712±1102 5389±2012 5290±1881红霉素组Erythromycin group 447±146** 633±146** 1223±287** 243±89** 245±70** 301±103**
3 讨论
近些年来,国内外先后建立多种细菌侵染性肺炎动物模型,但多数研究均是以单一菌株进行动物模型的建立,忽视了CAP多为混合感染,且以革兰阴性菌(如肺炎链球菌、金黄色葡萄球菌、大肠埃希菌、肺炎克雷伯菌等)感染多见,出现该现象可能与广泛应用抗菌药物致细菌耐药有关[10]。混合细菌感染性肺炎患者除了会出现体温、肺功能、白细胞及肺部X光线等指标异常外,容易并发电解质紊乱、呼吸衰竭、心率失常等疾病,严重威胁患者的生命安全,并给临床诊治带来很大的困难,故此类动物模型建立对抗混合细菌感染性肺炎药物评价有着重要意义。因此本研究选用临床上较为普遍的革兰阴性菌(肺炎链球菌、金黄色葡萄球菌、大肠埃希菌)感染大鼠,按1∶1∶1的剂量混合后进行大鼠气管注射,建立大鼠混合细菌感染性肺炎模型,通过观察各组大鼠肛温、白细胞、肺功能及肺组织形态学变化,并观察金黄色葡萄球菌、肺炎链球菌、大肠埃希菌在大鼠肺组织定植情况,同时选用临床有效的红霉素雾化后对大鼠混合细菌感染性肺炎模型的作用。
本实验结果显示,给予每只0.5 mL混合菌液感染(1×108CFU/mL)大鼠,大鼠在注入菌液第2天就出现了活动减少、呼吸急促、反应迟钝等现象,且第3天体温明显上升,这与已报道的动物肺炎感染模型的症状相符[3]。造模第3天,模型对照组动物肺功能检测结果显示,该组动物肺潮气量下降,呼吸频率上升,但每分通气量与空白对照组无明显差异,提示肺炎早期由于肺的通气功能受限,机体会通过增加呼吸频率,进而维持通气量的恒定;造模第7天,肺炎模型组动物潮气量、FEV200/FVC明显降低,呼吸频率趋于正常,提示随着病程的推进,模型对照组动物肺通气功能受损。给予红霉素雾化吸入治疗后,潮气量下降,FEV200/FVC提高。结果表明红霉素雾化治疗可以缓解细菌感染性性肺炎造成的肺通气功能受损。
金黄色葡萄球菌、肺炎链球菌、大肠埃希菌表面复合物抗原能引起炎症反应、刺激细胞因子产生[11-13]。TNF-α具有广泛的生物活性的前炎症细胞因子,可由多种免疫细胞释放[14],在免疫应答中,TNF-α可诱导IL-6、IL-10等炎症因子的产生,肺炎发病期间呈升高趋势,并与病情的程度相关[15]。IL-6是一种多功能细胞因子,与炎症密切相关,研究表明肺炎发病过程中IL-6显著升高[16]。本实验结果显示,造模第3、7天肺炎模型组大鼠BALF中TNF-α、IL-6含量均明显上升,提示金黄色葡萄球菌、肺炎链球菌、大肠埃希菌刺激致大鼠TNF-α、IL-6水平升高,介导炎性反应。给予红霉素雾化治疗后,肺炎动物肺泡灌洗液中的TNF-α、IL-6水平显著降低,这表明红霉素雾化给药能明显下调肺炎大鼠TNF-α、IL-6的水平,缓解TNF-α、IL-6介导炎性反应。对模型对照组与红霉素组动物肺进行细菌培养计数,实验结果显示,红霉素雾化治疗后的动物肺中的金黄色葡萄球菌、肺炎链球菌、大肠埃希菌数目均有明显的减少,提示红霉素雾化治疗能显著抑制金黄色葡萄球菌、肺炎链球菌、大肠埃希菌在肺中的复制。
对支气管肺泡灌洗液中成分的检测,是一种有效研究肺组织局部免疫病理过程的方法[17],能直接反映出感染肺炎的肺泡结构中细胞的类型和数量[18]。其中白细胞和中性粒细胞的数量与肺炎程度紧密相关,可作为判断患者是否出现肺炎或判断肺炎严重程度的标准[19]。本实验结果显示,相较于空白对照组,造模第3、7天模型对照组白细胞数目,中性粒细胞百分比均明显增加,这表明模型对照组动物肺部出现了炎症反应,肺组织病理学观察显示肺泡结构被破坏,肺间质明显增厚,大量炎性细胞浸润,亦表明该组动物肺部出现了严重的炎症。给予红霉素雾化治疗后,模型动物肺泡灌洗中白细胞数目,中性粒细胞降低明显,表明模型动物肺中的炎症反应得到了明显缓解,肺组织病理学观察结果亦显示该组动物的病变程度明显好转。令人意外的是,与第3天相比,在第7天模型对照大鼠肺泡灌洗液中白细胞数量出现下降的情况,并且肺组织病理改变也存在一定的改善,说明其具有一定的自愈趋势,与文献报道基本一致[20]。考虑到传统的肺炎模型通常为重症模型,大鼠病情较重,死亡率较高,因此本实验采用混合细菌经气管单次给药的造模方式,并且给药剂量与文献相比也较低。在第7天,发现与空白对照大鼠相比,模型大鼠仍有明显的肺炎指征,因此我们认为本次实验结果仍具有一定参考价值。不过在后续研究中,我们还会对不同病原菌动物模型建立方法进行不断优化,并探索不同病原菌动物模型和菌株接种剂量以及菌株浓度的关系,必要时辅以免疫抑制剂加强造模效果,为抗肺炎药物有效性评价和作用机制研究建立稳定的肺炎模型。
4 结论
综上所述,肺炎模型大鼠体温、肺功能参数的变化、肺泡灌洗液中炎症细胞与炎症因子以及肺组织病理学变化和肺组织细菌培养计数等指标变化的结果,认为采用金黄色葡萄球菌、肺炎链球菌、大肠埃希菌混合后经气管滴入大鼠肺部,该方法能成功建立细菌感染性肺炎大鼠模型,此外,发现红霉素溶液雾化给药对肺炎大鼠治疗效果显著。
