两种砷钼杂化多酸盐的合成、结构及变色性质
2022-01-24石文杰金邻豫马鹏涛王敬平牛景杨
王 进,石文杰,金邻豫,马鹏涛,王敬平,牛景杨
(河南大学化学化工学院,开封 475000)
多酸是由多酸根与抗衡离子构成的一大类多核配合物的通称.纯无机多酸阴离子由2个以上无机酸根缩合而成,杂化多酸根则由无机多酸阴离子与有机酸根缩合而成.纯无机多酸阴离子通常是由{MOx}(M=Mo,W,V,Nb,Ta)等金属多面体通过共面、共边或者共角连接而形成[1],杂化多酸根由于有机酸根的参与,表现出更为丰富的结构类型.自从1826年Berzelius发现第一例多金属氧簇以来,多酸已在催化[2]、医药[3]、电化学[4]、光致变色[5]、磁性材料[6]等领域得到广泛应用.多酸结构类型丰富,通过结合过渡金属或稀土金属可以得到结构各异的新型多酸,还可以与有机配体结合形成基于多酸的有机-无机杂化多酸[7~12].羧酸是一类反应活性强、用途广泛的有机配体,具有种类繁多、结构类型多样、配位模式灵活多变的特点.由羧酸根与无机酸根缩合构成的杂化多酸会由于羧酸根结构的影响而显示出更丰富的结构类型和性质,对化合物的电子特性调控能力更强,进而表现出更丰富的热色性、光色性以及氧化还原性等.
迄今,由羧酸根与钼酸根缩合构成的杂化多钼酸已有较多报道,包括{Mo4O8}[13],{Mo6O13}[14],{Mo132O372}[15],{Mo154O462}[16]等,但羧酸根参与构筑的杂化杂多酸结构类型极为有限[17~19].在前期工作中,我们报道了一系列基于{XMo6O21}(X=Se,As,P,Sb,Te)结构的杂多酸化合物[20,21].我们发现在此类杂化多酸的构建过程中,羧酸的骨架结构和羧基的位置及数目会直接决定形成的杂化多酸的结构.随着研究的深入,我们还意识到,反应中的其它因素(例如反应条件、杂原子种类等)也可能会对产物的构型产生影响.近期,我们研究了几种芳香族多元羧酸构筑的杂化多酸,试图发现芳香族羧酸中羧基的位置和数目如何决定产物的结构走向,以及中心杂原子的种类对产物构型的影响规律.本文报道2种分别由间苯二甲酸和5-羟基-1,3-苯二甲酸构筑的杂化杂多砷钼酸盐的结构特点,对此类有机-无机杂化多酸构建过程中羧酸的模板作用进行进一步对比总结,并对2种化合物的光致变色和热致变色性质进行了研究.
1 实验部分
1.1 试剂与仪器
所有试剂均为分析纯,经商业渠道购买,使用时未经进一步纯化.
C,H,N元素分析在美国珀金埃尔默公司Perkin-Elmer 240C型元素分析仪上进行;粉末X射线衍射数据在布鲁克公司Bruker D8 Advance型X射线粉末衍射仪上收集,以CuKα射线λ=0.154056 nm为射线源;单晶结构使用布鲁克公司Bruker Apex-II CCD型X射线单晶衍射仪进行测试;使用耐驰公司STA 499 F5型热重分析仪进行热重分析;使用美国Perkin-Elmer公司的Spectrum Two傅里叶变换红外光谱仪进行红外测试.
1.2 合 成
1.2.1(NH4)17H4[(AsMo6O21)2(AsMo6O23)(BDC)4]·28H2O(1)的合成将钼酸铵(1.06 g,0.86 mmol)溶解在15 mL水中,边搅拌边加入As2O3(0.10 g,0.50 mmol)、1,3-苯二甲酸(H2BDC,0.224 g,1.35 mmol)和NH4Cl(0.15 g,2.80 mmol).将此混合液回流加热1 h,然后冷却至室温进行过滤.将滤液放置在25 mL小烧杯中,在室温下缓慢挥发,大约14 d后得到无色透明的晶体.FTIR(KBr),ν͂/cm-1:3417(s),3153(s),3021(s),2832(m),2058(w),1600(s),1555(s),1482(m),1397(s),1276(m),1191(w),1165(w),1073(w),934(s),918(s),883(s),769(s),674(s),508(m).元素分析实验值(%,计算值):Mo 39.21(38.69),As 4.83(5.03),C 8.58(8.61),H 3.58(3.25),N 5.30(5.33).
1.2.2(NH4)5Cs8H6[(AsMo6O21)3(OIP)5]·40H2O(2)的合成将钼酸铵(0.53 g,0.43 mmol)溶解在15 mL水中,边搅拌边加入As2O3(0.05 g,0.25 mmol)、NaOH(0.06 g,1.5 mmol)、5-羟基-1,3-苯二甲酸(H2OIP,0.14 g,0.74 mmol)和CsCl(0.10 g,0.60 mmol).将此混合液回流加热1 h,然后冷却至室温进行过滤.将滤液放置在25 mL小烧杯中,在室温下缓慢挥发,大约28 d后得到无色透明的晶体.FTIR(KBr),ν͂/cm-1:3413(s),3183(s),2855(s),2067(w),1617(m),1560(s),1417(m),1392(s),1281(m),1221(w),1126(w),1004(w),978(w),931(s),914(s),885(s),783(s),677(s),511(w).元素分析实验值(%,计算值):Mo 31.05(30.08),As 4.12(3.92),Cs 19.32(18.52),C 8.26(8.37),H 1.94(2.21),N 1.30(1.22).
1.3 晶体结构表征
选取化合物1和2的单晶样品密封于毛细管中,在X射线单晶衍射仪上,以经过石墨单色器的MoKα射线(λ=0.071073 nm)为辐射源在296 K下收集衍射数据.晶体结构解析采用直接法,经过各向异性热参数修正和全矩阵最小二乘法优化.非氢原子坐标通过直接法得到,强度数据经过Lp因子校正以及经验吸收校正,有机基团氢原子坐标用几何加氢法得到,利用骑乘模式精修.晶格水分子数目结合热重分析结果得到.所有计算利用SHELXL-97程序完成[22],化合物的晶体学数据列于表1.

Table 1 Crystallographic data for compounds 1 and 2
2 结果与讨论
2.1 合 成
化合物1与2的合成采用的是“一锅煮”的方法.通常,多酸的合成过程受反应条件变化影响较大,例如pH值、反应温度和加热时间以及抗衡阳离子种类等都能影响产物的结构和类型,所以很难对反应的机理和过程进行推测和了解.而在此类杂化多酸合成过程中,基于羧酸的模板化作用,我们可以根据羧酸中羧基的位置和数目对产物的构型事先做出预判.例如,长链脂肪族二元羧酸HOOC(CH2)nCOOH(n=0,2,4,6)作为配体时通常会得到二聚、三聚或四聚结构(n=1);而芳香族羧酸作为配体时,羧基的数目及其在苯环上的位置会决定产物的构型[23].在化合物1与2的合成过程中,加入稍微过量的As2O3会对提高晶体质量有所帮助.1,3-苯二甲酸和5-羟基-1,3-苯二甲酸在常温下溶解度都较小,在反应液冷却过程中会有少量析出.
2.2 结构分析
如图1所示,化合物1与2均为三聚体结构.化合物1由1个{AsMo6O23}和2个{AsMo6O21}构筑块经由4个1,3-苯二甲酸分子共价连接而成.每个{AsMo6O21}构筑块中,3组{Mo2O7}共顶点相互连接,每个{Mo2O7}都能够被1个羧基共价修饰,4个1,3-苯二甲酸分子共提供8个羧基,因此化合物1中存在1个{Mo2O9}未被羧基修饰.化合物2由3个{AsMo6O21}构筑块经由5个5-羟基-1,3-苯二甲酸分子共价连接而成.由于5个5-羟基-1,3-苯二甲酸分子可以提供10个羧基,因此化合物2中所有的{Mo2O7}都与羧基共价连接,且还有1个羧基处于未配位的游离状态.
这种无机-有机-无机杂化多酸的特点是:有机羧酸配体处于内部,无机构筑块通过连接配体末端的羧基而包围在外层.因此,整个杂化多酸阴离子的结构是由羧酸配体的结构,即羧酸中羧基的位置和数目来决定的.此外,羧酸与{AsMo6O21}进行共价连接对整个杂化多酸的结构起到了稳定和支撑的作用.

Fig.1 Structures of compounds 1(A)and 2(B)
我们在前期工作中同样应用1,3-苯二甲酸和5-羟基-1,3-苯二甲酸构建了2种多羧酸修饰的磷钼酸盐(NH4)10[(HPMo6O21)2(HPO3){C6H4(COO)2}2]·14H2O(a)和(NH4)9H[(HPMo6O21)2(HPO3){C6H3OH(COO)2}2]·14H2O(b)[23].如图2所示,当中心杂原子为磷时,经2种羧酸修饰,得到的均为二聚结构.在化合物a和b中,未与多羧酸进行配位的2对{Mo2}簇与HPO3共价结合,其中2个钼八面体{MoO6}(图中为暗红色)为了适应配位,由共边相连转为以共面相连.这种由HPO3共价连接2对钼原子的情况仅出现在以P作为杂原子的杂多酸中.由此可见,在此类有机羧酸共价修饰的杂多钼氧酸盐的构建过程中,杂原子种类等因素也会对杂多酸的最终构型产生影响.

Fig.2 Comparison of structures of arsenomolybdates and phosphomolybdates functionalized by the same carboxylic acid ligand
在此类有机多羧酸共价修饰的杂多钼酸盐的构筑过程中,羧酸配体既对最终产物的构型起到了模板化的作用,又同时起到了稳定、支撑和连接整个框架的作用.本文中2种有机羧酸配体1,3-苯二甲酸和5-羟基-1,3-苯二甲酸都具有V形结构,由于2个羧基所处的相对位置的特殊性,使得此类配体具备一定的灵活伸缩性,其修饰的杂化多酸可能拥有2种甚至2种以上的构型.除本文中的2例有机羧酸配体,丙二酸和均苯三甲酸也属于此类V形结构多羧酸,这2种多羧酸修饰的杂多钼酸盐同样根据不同的杂原子呈现了非单一构型[24,25].丙二酸修饰时分别得到了三聚和四聚结构,均苯三甲酸修饰时也分别得到了二聚体和四聚体.因此,当此类V形多羧酸参与构筑有机-无机杂化的多钼酸盐时,在不同杂原子、不同抗衡阳离子等外部条件协同作用下,会得到非单一构型的杂化钼酸盐.
2.3 光致变色性质
作为有机-无机杂化多金属氧酸盐的一个重要分支,羧基配体修饰的多钼氧酸盐通常都能表现出光致变色活性.这一性质很有可能在紫外探测器、化妆品、光信息储存等领域具有应用价值.化合物1和2在氙灯照射下均能随时间呈现由浅至深的颜色变化.如图3所示,2种化合物的粉末在光照前均为白色,当用氙灯照射5 min后,2种化合物都呈现出明显的颜色变化:化合物1变为浅灰色,化合物2变为浅棕色.随着照射时间延长,2种化合物的颜色逐渐加深,当照射时间达到25 min后,2种化合物的颜色均不再随照射时间的延长而发生改变.

Fig.3 Images of compounds 1 and 2 at different times under the irradiation of a Xe lamp
多钼氧酸盐的变色机理通常用Yamas的电子转移机制来解释[26].对于含氮化合物,在氙灯照射下,光激发形成了N—H…O氢键的电子转移体系,化合物中的MoVI转化为MoV,化合物开始呈现不同的颜色.随照射时间延长,有更多的MoVI转化为MoV,化合物颜色会逐渐加深.而对于非含氮化合物或者羧酸作配体的钼酸盐,电子转移常常被认为与C—H…O电子转移体系形成相关[27,28],结果同样是化合物中的MoVI转化为MoV从而引起颜色变化.我们对化合物1和2变色前后的样品进行了EPR测试,发现光照前的样品均不显示顺磁信号,而变色后的样品都显示了顺磁信号,g值分别为1.933和1.936,证明了光照后五价钼的存在.变色后样品的EPR谱如图4所示.这说明化合物的颜色变化与MoVI转化为MoV有关.为了研究化合物变色前后结构的变化情况,分别对2种化合物光照前后的样品进行了红外测试,发现化合物光照前后红外光谱未发生明显变化,提示光照并未使化合物骨架发生变化.

Fig.4 EPR spectra of compounds 1(A)and 2(B)after light irradiation
2.4 热致变色性质
对2种化合物的热致变色性质进行了初步探究.从常温开始对2种化合物进行持续升温加热,在每个设定温度持续加热0.5 h.由图5可见,在373 K时,2种化合物的颜色都发生了明显变化:化合物1变为浅棕绿色,化合物2显示为浅棕黄色.随着温度持续上升,2种化合物的颜色也逐渐加深.最后,在463 K时,化合物1变为绿褐色,化合物2变为深棕色.

Fig.5 Images of compounds 1 and 2 at different temperatures
对加热后的样品进行了EPR测试.如图6所示,二者均显示了顺磁信号,证明了加热后五价钼的存在.而加热前样品不显示顺磁信号,提示加热下发生的颜色变化同样与MoVI转化为MoV有关.目前,与光致变色研究相比,对杂化多酸热致变色机理的研究要少得多[20].可以初步推断的是,温度升高促使越来越多的MoVI转化为MoV,于是样品的颜色越来越深.而与光致变色不同的是,加热时的颜色变化不仅仅发生在样品表面,而是样品整体的颜色发生了改变.将变色后的样品避光保存30 d,发现颜色仍然保持,这也和光致变色现象不同.很明显,化合物1和2的热致变色与光致变色的机理存在很多不同,还需要进行更广泛深入的物理化学性质研究才能进一步做出解释说明.
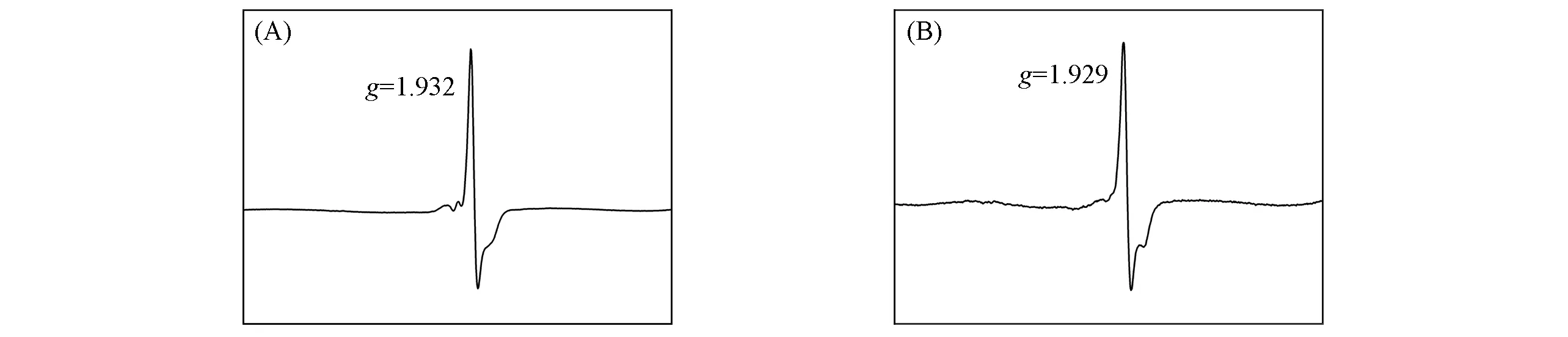
Fig.6 EPR spectra of compounds 1(A)and 2(B)after heating
3 结 论
本文以2种V型羧酸1,3-苯二甲酸和5-羟基-1,3-苯二甲酸作为有机配体,分别制得了2种有机-无机杂化的砷钼酸盐,二者均为三聚结构,其阴离子中所含羧酸配体数目分别为3和5.2种化合物均显示了光致变色和热致变色性质.
