TSWV 侵染辣椒的胼胝质沉积及细胞病理学研究*
2022-01-24张美玲赵肖梅许德万李永忠刘雅婷
张美玲,赵肖梅,许德万,李永忠 ,刘雅婷
(1.云南农业大学 植物保护学院,云南 昆明 650201;2.云南农业大学 农学与生物技术学院,云南 昆明 650201;3.文山学院 三七医药学院,云南 文山 663000)
番茄斑萎病毒(Tomato spotted wilt orthotospovirus,TSWV)是正番茄斑萎病毒属(Orthotospovirus)的代表种[1],于1915 年在澳大利亚被首次报道,随后在美国、法国和意大利等国相继被发现[2]。中国于20 世纪90 年代在四川省发现TSWV;于海芹等[3]于2014 年 2 月— 2018 年 7月在云南省采集到566 份疑似感染正番茄斑萎病毒属的烟株、烟田周围作物和田间杂草样品,TSWV 检出率为43.88%。TSWV 已从最初被发现的四川和云南向国内其他地区快速扩散,目前已在辽宁、天津、安徽、福建、河南、海南、云南、贵州、四川、重庆、山西、甘肃、上海、北京、山东和青海等地被发现[4-5]。TSWV 可侵染辣椒、番茄、莴苣、芹菜、马铃薯、花生、烟草、菊花、鸢尾、洋桔梗和朱顶红等多种农作物和花卉[6],造成巨大经济损失。其中,辣椒是中国重要的经济作物,据联合国粮食和农业组织(Food and Agriculture Organization of the United Nations,FAO)统计,2018 年全世界辣椒播种面积199.04 万hm2,总产量3 677.15 万t,中国辣椒播种面积和产量分别占38.7%和49.5%,是世界上辣椒种植面积最大的国家[7],但TSWV 频发给辣椒生产带来了巨大损失,防治辣椒TSWV 具有重要意义。
与动物不同,在外界胁迫来临时,植物不能改变自身的生存位置来躲避伤害,因此,植物进化出一系列的防御反应来应对生物或非生物胁迫带来的伤害。胼胝质沉积是植物抵御外界伤害的反应之一[8]。胼胝质(callose)是一种由β-1,3 键结合的线性葡聚多糖,广泛存在于高等植物中。通常情况下,它以细胞壁多糖的形式存在,是植物细胞壁以及细胞壁偶联和附属结构的专有成分[9];在特定的生长和分化阶段,胼胝质是特殊细胞壁或细胞壁相关结构的组成部分[10]。胼胝质可通过对植株胞间连丝进行修饰,或与木质素一起在细胞膜和细胞壁之间形成乳状突起,以抑制病原体扩散,对病原体入侵产生免疫应答[11]。丁旭[12]研究表明:脱落酸抑制剂氟啶草酮能促进褐飞虱的取食行为,并抑制胼胝质沉积。许有友[13]研究发现:脱落酸处理感、抗虫品种水稻叶鞘后,胼胝质主要沉积在木质部,其次沉积于导管周围;褐飞虱取食水稻汁液后,抗虫品种水稻的表皮组织、维管束鞘和机械组织中出现胼胝质,表明脱落酸增加了褐飞虱取食后抗虫品种水稻中胼胝质的沉积;脱落酸处理并接虫后,胼胝质沉积面积较不接虫处理增加,表明脱落酸处理和褐飞虱取食可进一步促进抗虫品种水稻胼胝质沉积。当泡桐丛枝病菌侵染泡桐时,筛管内胼胝质的积累对泡桐丛枝病菌的扩增和繁殖具有抵抗作用,因此,由泡桐丛枝病菌引发的筛管胼胝质过量积累是抵御泡桐丛枝病菌扩增的重要原因[14]。为研究TSWV 与寄主植物辣椒互作时的防御反应,以易感TSWV 的湘研十一号辣椒为试验材料,研究TSWV 侵染辣椒后,叶片胼胝质的沉积情况及超微细胞结构变化,以期为防治辣椒TSWV 提供理论基础。
1 材料与方法
1.1 试验材料
试验植物寄主:辣椒(Capsicum annuumL.)品种湘研十一号;病毒繁殖寄主:一点红[Emilia sonchifolia(L.)DC];番茄斑萎病毒(TSWV)毒源(JC-6)由本实验室在一点红上进行传代培育,并置于防虫网中作为活体毒源。
1.2 病毒接种和RT-PCR 检测及测序
用漂浮盘培育辣椒,在长出2 片真叶后移栽,在2~4 叶期进行摩擦接种,试验处理分为2 组:接种TSWV(TSWV 组)和接种缓冲液对照组(CK 组)。接种病毒21 d 后采集植株系统叶片,进行RT-PCR 检测。
运用Clone Assistant 1.0 在TSWV 的3 条RNA链上设计引物,分别为:TSWV-NP-F:ATGTYTAAGGTTAAGCTCACTAAG,TSWV-NP-R:TTAAGCAAGTTCTGTGAGTTTTGCC,750 bp;TSWV-Nsm1-F:TGGCAACGGGAAGCAAAATG,TSWV-Nsm1-R:TCTGCTTCTCACTGTTTCCCT,491 bp;TSWV-RdRp1-F:TTGCTGGGATGCCAATCACT,TSWV-RdRp1-R:TTTGTCGGCGATATGCTGGT,431 bp。应用TransZol Plant(Trans-Gen Biotech,北京)试剂盒法提取植物总 RNA,然后选用PrimeScriptTMⅡ1st Strand cDNA Synthesis Kit(TaKaRa,北京)试剂盒反转获得cDNA。PCR体系配置以及反应条件:cDNA 1 µL,10 mmol/L上游引物 1 µL,10 mmol/L 下游引物1 µL,Prime STAR Max DNA Polymerase 10 µL,加ddH2O 至总量为20 µL;反应程序:98 ℃,10 s;98 ℃20 s,58 ℃ 30 s,72 ℃ 1 min,35 个循环;72 ℃10 min。通过1.2 %琼脂糖凝胶电泳检测,送PCR产物测序并通过NCBI-BLAST 比对,鉴定结果。
1.3 苯胺蓝染色法检测胼胝质
于TSWV 接种后第1、3、7、14 和21 天采集上方系统叶片(对应编号分别为T1、T2、T3、T4和T5),用FAA 固定液(福尔马林—乙酸—乙醇混合液)固定,后于脱色液(V乙酸∶V乙醇=1∶3)中脱色至无色状态,用150 mmol/L 的K2HPO4进行漂洗,再于0.01%苯胺蓝染液中染色,用扫描仪(Pannoramic MIDI)扫描后观察胼胝质,利用Image J 软件计算胼胝质的平均荧光强度。
1.4 透射电子显微镜观察寄主细胞病理变化
于TSWV 接种后第1、3、7、14 和21 天采集上方系统叶片(对应编号分别为T1、T2、T3、T4和T5),用戊二醛—锇酸双重固定,再依次用30%、50%、70%、90% 和100% 乙醇梯度脱水,脱水后将叶片修剪为1 mm×3 mm 的长方形,于环氧树脂Epon812(SPI 公司)包埋剂中包埋,将样品的超薄切片用醋酸铀和柠檬酸铅溶液进行双重染色,后在透射电子显微镜(JEOL TEM 1200EXⅡ型)80 kV 加速电压下进行超微结构观察。
2 结果与分析
2.1 RT-PCR 鉴定结果
TSWV 接种处理21 d 后对辣椒进行RTPCR 检测,PCR 产物电泳后的目标条带分别与预期片段大小一致(图1),测序结果通过NCBIBLAST 比对发现,所扩增序列与TSWV 高度同源,相似值均达到95%以上,说明在辣椒上成功接种TSWV 病毒。

图1 电泳检测结果Fig.1 Results of electrophoresis detection
2.2 胼胝质沉积观察
由图2、3 可知:TSWV 侵染辣椒后,第1 天胼胝质主要沉积在叶脉筛管上,气孔上也有少量胼胝质累积;第3 天胼胝质沉积数量持续增多,筛管、气孔及叶边缘均出现胼胝质沉积;第7 天时,主要沉积于叶脉筛管处;到接种后第14 和21 天,胼胝质沉积量呈上升趋势,前一时期可在叶脉筛管、气孔和表皮细胞壁中观察到胼胝质沉积,后一时期主要在叶脉筛管中观察到胼胝质。接种TSWV 后,5 个时期均有胼胝质以点状沉积于辣椒叶片,胼胝质总体变化呈“N”字型。表明TSWV 侵染辣椒后,胼胝质在气孔、细胞间和叶脉筛管上均会出现沉积。
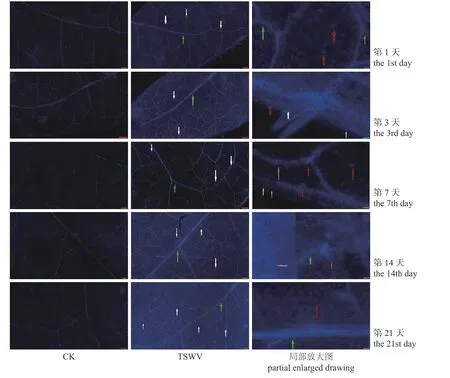
图2 胼胝质荧光图Fig.2 Fluorescence of callose
2.3 透射电子显微镜观察TSWV 侵染后寄主细胞病理变化
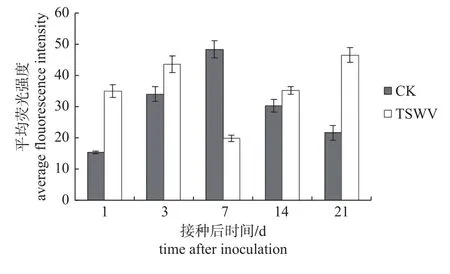
图3 胼胝质平均荧光强度表达量Fig.3 Average fluorescence intensity of callose
由图4 可知:健康辣椒叶片叶绿体呈纺锤型,其中淀粉粒较多,基粒片层和基质片层分布于整个叶绿体中且排列紧密;接种TSWV 后第1 天,叶绿体出现较多病毒粒子,且病毒粒子存在之处的片层被破坏,叶绿体外出现大小不一的囊泡;接种后第3 天,细胞死亡,叶绿体已失去生命活力,呈渔网状悬浮于细胞中,胞内存在较多囊泡结构;接种后第7 天,细胞内囊泡明显增多,叶绿体外膜稍有溶解;接种后第14 天,病毒粒子主要靠近叶绿体膜分布,在淀粉粒周围也观察到病毒粒子且被病毒占据之处的片层结构消失,叶绿体形状改变,局部有空腔出现,基质片层稀少;接种后第21 天,细胞出现质壁分离,病毒粒子存在于细胞质基质中,且叶绿体外出现囊泡结构,但叶绿体中片层结构完好。

图4 接种TSWV 辣椒的透射电镜图Fig.4 Transmission electron micrograph of pepper inoculated with TSWV
3 讨论
在感染部位早期有效地形成乳状突,可帮助植物抵御病原菌及病毒的侵害[15]。本研究中,可以观察到有大颗粒的胼胝质荧光点,推测这是胼胝质与木质素结合形成的乳突。大豆花叶病毒侵染大豆后,胼胝质出现的时间与大豆抗病级别相关,抗病性越强的品种在侵染点可越早发现胼胝质的积累,在抗病性为0 级的大豆组合中,叶脉、叶柄和茎部可发现胼胝质积累,而在抗病级别为5 的组合中,却一直未能观察到胼胝质荧光[16]。在水稻条纹病毒胁迫下,抗病水稻叶片中胼胝质荧光强度增强,且其大维管束中的维管束鞘内层厚壁细胞、木质部和韧皮部以及维管束鞘延伸的厚壁组织、小维管束、表皮细胞以及叶肉细胞均有较强的胼胝质荧光出现[17]。而本研究中,接种TSWV 后24 h 观察到胼胝质在叶片、叶脉筛管和气孔上积累,试验开始的24 h 内胼胝质沉积是否已在叶片上产生值得进一步探讨。此外,本研究仅采叶片观察胼胝质沉积,并未采集根部和茎部样本进行研究,这些部位胼胝质是否也发生沉积需要进一步探讨。
除胼胝质沉积外,植物被TSWV 侵入后,叶绿体片层会变得疏松,叶绿体内、外有囊泡出现,且线粒体增多或聚集,病毒粒子主要分布于内质网中[18-19]。在本研究中,叶绿体片层排列疏松甚至叶绿体解体,叶绿体外出现大量囊泡结构,与前人研究结果一致,由此可确定,TSWV侵染植株后会对植物的叶绿体结构造成严重伤害,推测这是染病植株叶片褪绿的主要原因。
本研究中也出现大量大小不一的囊泡。囊泡可分为胞外囊泡与胞内囊泡,前者由细胞膜直接分泌或通过多囊泡体与细胞膜融合释放产生,可选择性包裹蛋白与核酸等物质;后者由高尔基体和内质网等内膜系统产生,而内质网是内膜系统的核心部分,具有运输细胞内物质的功能[20-22]。很多RNA 病毒通过侵染内质网来形成内含体,这种内含体是病毒复制中心和蛋白合成中心,供病毒完成复制并装配成运动复合体;运动复合体从复制中心转运到胞间连丝最直接、最有效的方法就是随着内质网膜运动[22-23]。Orthotospovirus属病毒的胞间运动方式有3 种,分别是单个病毒粒体沿内质网膜运动、包裹病毒粒体的囊泡沿内质网膜运动以及包裹病毒颗粒的囊泡与其他囊泡协同从细胞液泡的一端运动到另一端并向细胞壁附近聚集[24]。此外,研究已证实Orthotospovirus属病毒编码的运动蛋白NSm 为膜蛋白,可诱导内质网膜结构的改变并产生与病毒相关的囊泡结构[25-26]。本研究观察到大量胞内、外囊泡,进一步证实Orthotospovirus属病毒侵染植物后细胞内会产生大量囊泡,但由于试验并未开展进一步的观察,未在囊泡中发现病毒粒子,其运动方式还需进一步研究。此外,本研究发现:病毒粒子除分布于细胞质基质外,还分布于叶绿体中靠近叶绿体膜和淀粉粒的位置,且病毒粒子聚集之处叶绿体片层消失,叶绿体内出现空白区域等病变现象。这与同属的番茄环纹斑点病毒(Tomato zonate spot virus,TZSV)侵染番茄叶片后叶绿体呈空泡化[27]相似。病毒粒子主要靠近细胞器膜或细胞膜分布,进一步加大了病毒粒子是通过囊泡等膜结构完成其扩散侵染的可能性。
4 结论
番茄斑萎病毒(Tomato spotted wilt orthotospovirus,TSWV)侵染其寄主植物辣椒后,植物启动胼胝质沉积反应;其叶绿体结构被破坏,出现大量囊泡,且TSWV 会破坏植物细胞的超微结构。
