利用CRISPR/Cas9技术体内标记示踪小鼠内源性NPC1L1蛋白
2022-01-22武晓静陈玉霞麻献华章卫平
武晓静,陈玉霞,麻献华,章卫平,
(1.天津医科大学朱宪彝纪念医院,天津市内分泌研究所,国家卫健委激素与发育重点实验室,天津市代谢性疾病重点实验室,天津 300134;2.海军军医大学基础医学院病理生理学教研室,上海 200433)
膳食胆固醇的过量摄入是导致高胆固醇血症的常见原因,对胆固醇吸收机制的认识可望为高胆固醇血症的防治提供新的思路。目前认为,胞外游离胆固醇的吸收主要是由尼曼-匹克C1型样蛋白1(Niemann-Pick C1-Like 1,NPC1L1)介导的囊泡内吞(vesicular endocytosis)途径实现的[1-3]。NPC1L1高表达于小肠吸收型上皮细胞的刷状缘和人及灵长类动物的肝细胞胆管面[1,4]。NPC1L1基因敲除小鼠对胆固醇的吸收率下降约70%,能够抵抗饮食诱导的高胆固醇血症;而其他脂类(如甘油三酯、磷脂)和植物性甾醇的吸收则不受影响[1-2]。解析NPC1L1囊泡形成、内吞、运输和循环等相关过程的细胞分子机制,对揭示胆固醇的吸收机制具有重要意义。本研究利用CRISPR/Cas9技术,通过融合表达,在内源性NPC1L1蛋白的C端分别标记上增强型绿色荧光蛋白EGFP和由DYKDDDDK 8个氨基酸组成的FLAG蛋白标签,为该分子的示踪和功能研究提供有效手段。
1 材料与方法
1.1 实验动物C57BL/6N小鼠(品系代码213)引自北京维通利华实验动物公司。按照SPF级动物饲养标准繁殖饲养于本实验室动物房[许可证号:SYXK(沪)2019-0034],环境温度25℃,湿度40%~70%,12 h光照,昼夜交替。小鼠饲料、垫料和饮水均经过高温高压灭菌处理。8~10周龄的雄性小鼠用于实验。
1.2 主要试剂载体质粒pT7-2G、pCS-3G、pTV-4G来自Biocytogen Pharmaceuticals公司,限制性核酸内切酶(Thermo Scientific Fast Digest系列),GeneRuler 1 kb plus DNA Ladder(Thermo Scientific,SM1332),NeonTMTransfection System(Invitrogen,MPK 10096),2xTaq Plus Master MixⅡDye Plus(Vazyme,P213-01),KODFXDNA聚合酶(TOYOBO,KFX-101),MEGAshortscriptTMT7转录试剂盒(ThermoFisher Sci entific,AM1354),MEGAclearTM转录纯化试剂盒(ThermoFisher Scientific,AM1908),DAPI(Invitrogen,D1306)。
1.3 sgRNA序列设计和活性检测根据CRISPR/Cas9系统中sgRNA切割原理,针对NPC1L1基因终止密码子后的非翻译区,在CRISPR设计网站(http://www.sanger.ac.uk/htgt/wge/)上选择打靶分数高且脱靶率低的sgRNA序列,3′端引入一个与靶向DNA序列错配的碱基。sgRNA序列和对应的靶向序列见表1。于sgRNA序列两侧加上与pCS-3G骨架质粒互补的同源臂序列,左侧同源臂序列为5′-CTATTTCTAGCTCTAAAAC-3′,右侧同源臂序列为5′-GGTGTTTCGTCCTTTCCA-3′。合成单链寡聚核苷酸片段,经退火后,通过Gibson无缝连接的方式连入经Xho I和BamH I双酶切线性化的pCS-3G质粒,连接产物转化后选择经测序验证正确的克隆,采用UCATMCRISPR/Cas9荧光素酶活性检测法检测Cas9/sgRNA的活性。

表1 靶向NPC1L1基因3′UTR的sgRNA序列及其靶向DNA序列Tab 1 sgRNA and DNAsequences targeting 3′UTRof NPC1L1 gene
1.4 Cas9/sgRNA体外转录选择高活性的sgRNA,在其对应的DNA序列两侧分别加上与骨架质粒匹配的同源臂序列,其中5′端同源臂序列为5′-CTATTTCTAGCTCTAAAAC-3′,3′端同源臂序列为5′-TATAGTGAGTCGTATTA-3′。合成的两条互补单链寡核苷酸片段经退火后,通过Gibson无缝克隆方式组装至经Xho I和BamH I双酶切的质粒载体pT7-2G,质粒经测序正确后,使用T7 RNA聚合酶和MEGAshortscriptTMT7转录试剂盒,体外转录sgRNA和Cas9 mRNA,产物经MEGAclearTM转录纯化试剂盒纯化回收后,进行RNA电泳检测。
1.5 基因敲入打靶载体的构建根据打靶方案,在NPC1L1基因3′UTR插入FLAG-EGFP基因序列。构建打靶载体所用的引物见表2。以基因组DNA为模板,用引物LA-F/R PCR扩增5′端同源臂(LA),大小为1 388 bp;以基因组DNA为模板,用引物RA-F1/R的扩增产物为模板,再用引物RA-F2/R扩增得到3′端同源臂(RA),大小为1 294 bp;引物FG-F/R扩增插入的FLAG-EGFP基因序列(FG),长度为789 bp。扩增产物经AIOTM法克隆进载体pTV-4G,经酶切和DNA测序鉴定正确的克隆用于后续显微注射。

表2 构建打靶载体的引物序列Tab 2 Primer sequences for the construction of targeting vectors
1.6 小鼠受精卵显微注射将体外转录制备的sgRNA、Cas9 mRNA和打靶载体质粒配制成混合物,通过显微注射法注射到C57BL/6N小鼠受精卵胞质中,然后移植到假孕受体母鼠内,母鼠生产获得的子鼠称为F0代小鼠。
1.7 小鼠基因型鉴定受精卵移植的假孕母鼠单笼饲养20 d后,观察乳鼠出生情况。剪取长至1周后F0代小鼠尾尖组织1 cm,溶于500μL基因组DNA裂解液[0.2%SDS、0.2 mol/L NaCl、5 mmol/L EDTA、0.1 mol/L Tris-HCl(pH 8.0)、0.5 g/L蛋白酶K],提取基因组DNA进行PCR鉴定其基因型。基因型鉴定引物设计见图2A,反应体系为基因组DNA 1μL(50 ng),2×PCR mix12.5μL,10μmol/L上下游引物各1μL,ddH2O 9.5μL,总体积为25μL。采用Touchdown PCR,反应条件为94℃,2 min;98℃,10 s,67~57℃,30 s,68℃,2 min,每个循环降低0.7℃,共15个循环;98℃,10 s,57℃,30 s,68℃,2 min,共25个循环;再于68℃,10 min。反应结束后取10μL PCR产物跑2%琼脂糖凝胶电泳,根据产物大小判断小鼠基因型并经测序确认。以P1F/P1R引物扩增得到2 154 bp产物且以P2F/P2R为引物扩增得到1 971 bp产物,为F0阳性小鼠。P1F序列为5′-ACTTCTCTGTAGATGGAACCCAG-3′,P1R序列为5′-GTAGTTG TACTCCAGCTTGTGCCCC-3′;P2F序列为5′-CACGACTTCTTCAAGTCCGCCATGC-3′,P2R序列为5′-CAGCCATAAGACCCATGCCAG-3′;P3F序列为5′-CAGGGCCAGATGTTAACCAAGC TCT-3′,P3R序列为5′-GTACCACTGCCACACG TTCCCAAG-3′。鉴定阳性的F0代小鼠和野生型C57BL/6N小鼠交配,获得F1代小鼠。F1代小鼠基因型鉴定方法同F0代小鼠,经鉴定有同源重组者再经Southern印迹检测确认。
1.8 可视化观察NPC1L1-FLAG-EGFP蛋白的分布野生型和纯合小鼠腹腔注射4%水合氯醛溶液麻醉后快速取小肠组织,剪取1 cm空肠中段组织,浸泡入4%的中性多聚甲醛中于4℃固定过夜。组织经PBS洗涤后,依次在15%、30%的蔗糖溶液中脱水过夜,OCT包埋并经液氮速冻后切片。厚度为8μm的冰冻切片于55℃烘烤20 min,10μg/mL DAPI溶液衬染5 min,PBS轻洗3 min×3次,晾干后中性树胶封片,于倒置荧光显微镜(Olympus DP80)下观察。
2 结果
2.1 sgRNA靶向活性的检测和制备针对NPC1L1基因第19外显子靶向位点附近的不同区域,定制8条sgRNA的相应寡核苷酸链,构建重组载体pCSsgRNA,并与包含靶点基因片段的pUCA-NPC1L1载体共转染检测Cas9/sgRNA的剪切活性。如图1A所示,sgRNA1、sgRNA3、sgRNA5、sgRNA8均有较强的剪切向导活性。综合考虑靶点位置和活性结果,选择sgRNA1进行体外转录制备向导RNA,凝胶电泳显示sgRNA1在65℃温育5 min呈现出单一条带,提示成功制备可用于显微注射的RNA(图1B)。

图1 靶向NPC1L1基因3′端sgRNA的活性检测和转录Fig 1 The activity and transcription products of the sgRNA targeting 3′end of NPC1L1 gene
2.2 打靶载体的构建和鉴定在小鼠NPC1L1基因的终止密码子前面敲入FLAG-EGFP编码序列的打靶策略见图2A。打靶载体酶切鉴定结果如图2B所示,正确的克隆经Apa I酶切可得到6 076 bp和8 00 bp片段;经HindⅢ和Sph I双酶切可得到3 842 bp、2 025 bp和1 009 bp片段;经Eco47Ⅲ和KpnⅠ双酶切可得到4 611 bp和2 265 bp片段。
2.3 F0及F1代小鼠的获得与基因型鉴定通过446个受精卵的显微注射和体内移植,出生子鼠44只,出生率9.86%;经PCR基因型鉴定,其中4只F0小鼠发生同源重组,阳性率9.1%。对PCR鉴定同源重组阳性的F1代小鼠,进一步进行基因组的Southern印迹检测,探针结合位点和限制性内切酶酶切位点见图2A所示。基因组DNA经BspHⅠ酶切后,以5′探针杂交显影,出现9.5 kb条带者为野生型,4.7 kb条带者为重组小鼠。基因组DNA经BamHⅠ酶切后,以EGFP探针杂交,仅见6.7 kb条带者为正确重组且无随机插入的阳性F1代小鼠。Southern印迹结果显示编号1~4为阳性F1代小鼠,编号5~7为有随机插入的重组小鼠,编号8为野生型小鼠(图3A)。
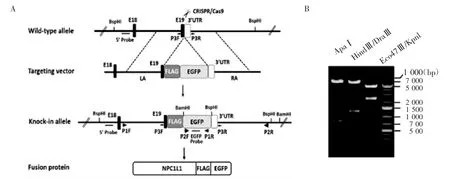
图2 CRISPR/Cas 9介导的NPC1L1基因编辑策略及打靶载体酶切鉴定Fig 2 Schematic demonstration for CRISPR/Cas9-mediated editing of NPC1L1 gene and restrictive enzyme digestion analysis of gene targeting vector
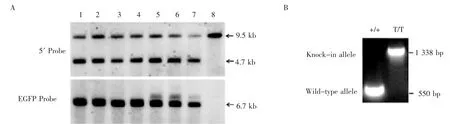
图3 F1代阳性小鼠的Southern印迹检测和基因型鉴定Fig 3 Southern blotting and genotyping analysis of positive F1 generation mice
进一步鉴定F1代小鼠基因型的引物设计见图2A,以引物P3F/P3R扩增,野生型基因和FLAGEGFP敲入的等位基因型可分别得到550 bp和1 338 bp的产物。如图3B所示,只有550 bp产物的是野生型小鼠(+/+);只有1 338 bp扩增产物的是表达NPC1L1-FLAG-EGFP融合蛋白(简称NPC1L1-FG)的纯合小鼠(T/T)。
2.4 EGFP可视化示踪NPC1L1蛋白在小肠上皮细胞的表达特征与野生型小鼠(+/+)相比,纯合小鼠(T/T)的空肠绒毛上皮细胞肠腔面可见明显的绿色荧光,勾勒出清晰的刷状缘质膜轮廓(图4)。
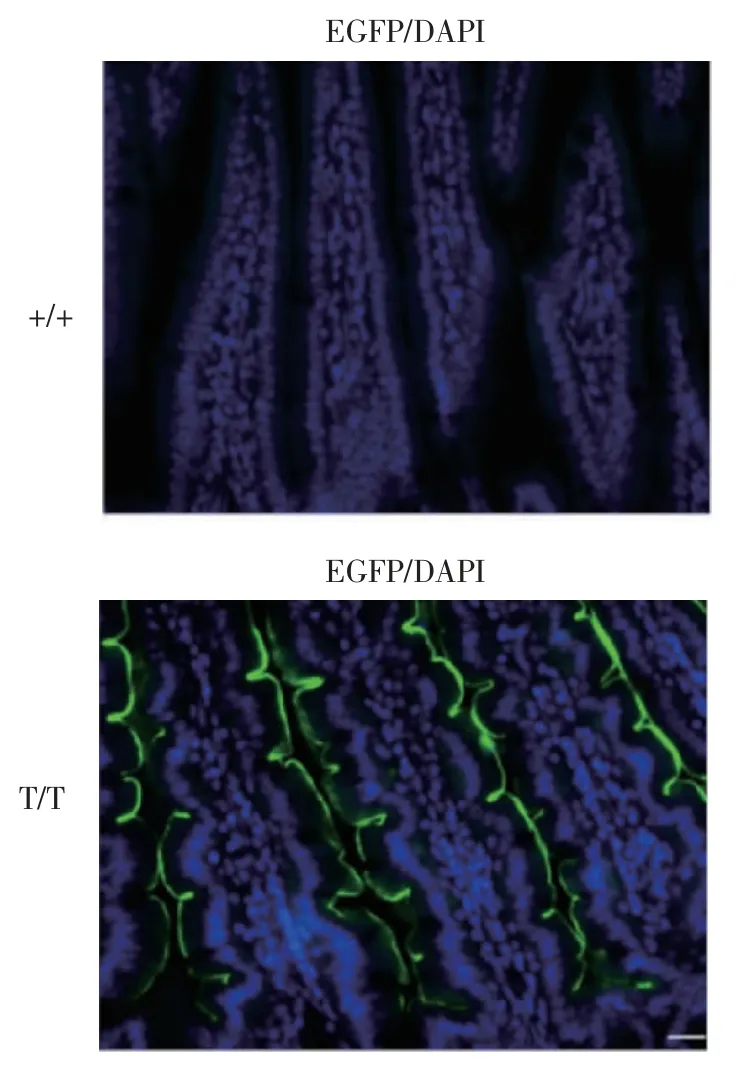
图4 空肠组织中NPC1L1-FG融合蛋白的表达分布Fig 4 Distribution of NPC1L1-FG fusion protein in jejunum tissue
3 讨论
NPC1L1蛋白在肠道和肝内胆道游离胆固醇的摄取中发挥重要作用。寻找NPC1L1的共作用分子,是解析胆固醇吸收机制的有效策略。因包括大鼠在内的啮齿类动物肝脏组织几乎不表达NPC1L1蛋白,迄今关于NPC1L1介导胆固醇吸收机制的研究多以离体大鼠肝癌细胞为模型,导入人NPC1L1基因进行的。有课题组利用NPC1L1-EGFP在大鼠肝癌细胞过表达的细胞模型,经免疫沉淀和质谱分析,发现共作用分子Flotillin在介导形成富含胆固醇的NPC1L1微区(microdomain)膜结构和胆固醇吸收中发挥重要作用[5]。该课题组还发现Clathrin的接头蛋白Numb能特异性识别和结合NPC1L1蛋白C末端的YVNXXF内吞信号肽,从而招募Clathrin以启动NPC1L1内吞[6-7]。此外,该课题组还证实了卸载胆固醇后的NPC1L1从内吞循环体(endocytic recycling compartment,ERC)转运回胞膜时,需要小G蛋白Cdc42[8]和LIM区和actin结合蛋白1(LIMdomain and actin binding 1,LIMA1)[9]介导耦联含myosin Vb的运输复合物。然而,目前尚无可体内示踪NPC1L1的动物模型,用以进一步在体探索NPC1L1在胆固醇吸收中的作用机制。
在NPC1L1蛋白的在体功能研究方面,目前常用的小鼠模型为NPC1L1基因全身敲除模型[1-2],或者在全身敲除的基础上利用villin-Cre使肠道过表达人源NPC1L1[10],或者利用载脂蛋白E启动子在肝脏过表达人源NPC1L1[4,11-12],以探讨肠道或肝脏NPC1L1蛋白在胆固醇代谢中的作用。虽然敲入的外源NPC1L1在标靶组织的定位与内源性蛋白的定位基本一致,但是也会发生脱靶现象。比如胃和肾组织也有villin启动子活性[10],因此无法排除这些组织表达的外源NPC1L1在胆固醇代谢稳态维持中的作用。本研究的NPC1L1-FG工具小鼠是利用CRISPR/Cas9技术在内源性NPC1L1基因末端插入标签蛋白基因,不会改变内源性NPC1L1蛋白的表达分布,因此可以有效避免NPC1L1在标靶组织外表达而造成的实验假象。
文献报道的关于NPC1L1定位的研究,不管是在体的小鼠组织还是离体的细胞模型,均利用荧光标记二抗杂交显影,这在放大荧光信号的同时也会产生杂信号。本研究的小鼠模型在内源性NPC1L1蛋白C端标记上EGFP蛋白,荧光显微镜下可见绿色荧光分布在小肠上皮细胞的刷状缘膜,与文献报道的NPC1L1蛋白的分布特征一致,说明EGFP敲入能准确示踪内源性NPC1L1蛋白的表达分布。该模型可以方便地利用荧光显微镜直接观察内源性NPC1L1蛋白的定位、内吞囊泡的形成及其在细胞内的转运,也可避免抗体杂交所致的杂信号的干扰。另外,NPC1L1蛋白还带有FLAG标签,利用FLAG抗体可以高效地富集NPC1L1蛋白及其共作用蛋白,结合蛋白组学分析手段,可以深入分析调控NPC1L1蛋白表达、降解的分子机制以及参与胆固醇代谢的信号通路。
总之,笔者成功构建了肠道特异性表达NPC1L1-FG融合蛋白的小鼠模型,且可利用EGFP标签蛋白镜下可视化追踪NPC1L1蛋白的在体运动轨迹,利用FLAG标签抗体富集捕获NPC1L1蛋白及其潜在的共作用蛋白,为今后探讨NPC1L1介导的胆固醇和脂溶性维生素稳态维持的分子机制提供有力工具。
