基于生物信息学方法筛选散发性克雅氏病神经炎症相关关键基因
2022-01-22程雅静刘莹王菲
程雅静,刘莹,王菲
(天津医科大学总医院神经内科,天津 300052)
散发性克雅氏病(sporadic Creutzfeldt-Jakob disease,SCJD)是一种快速进展的具有传染性的致命性神经退行性疾病,其特征是大脑中朊病毒蛋白(PrP)的错误折叠和聚集[1]。SCJD是最常见的人类朊病毒病(约占90%的病例),发病率约为每年1.5人/百万人~2.0人/百万人[1]。正如许多研究对朊病毒疾病动物模型的报道一样,神经炎症是神经退行性疾病发病机制的重要部分[2]。对朊病毒疾病模型的研究表明,激活的小胶质细胞表达的基因在炎症、新陈代谢、呼吸应激以及其他功能调节中起主要作用[3]。因此,探索神经炎症在SCJD中的作用机制有重大的意义。本研究旨在利用生物信息学方法筛选SCJD炎症相关的差异基因,并进一步鉴定关键基因,探索SCJD发展过程中神经炎症的作用并为该病的诊断和治疗提供新思路。
1 对象和方法
1.1 数据的获取及差异表达基因的筛选通过GEO(Gene Expression Omnibus)数据库检索“Sporadic Creutzfeldt-Jakob Disease”和“Neuroinflammation”,最终选择与SCJD炎症相关的GSE160208数据集,它由与神经炎症相关的800个基因在27例SCJD患者和20名正常人的脑组织中的表达数据组成。用GEO2R(https://www.ncbi.nlm.nih.gov/geo/geo2r/)的“limma”包筛选SCJD和正常脑组织的差异表达基因(DEGs),筛选标准为:|Log2FC|>1,adj.P<0.05。用R语言的“ggplot2”包对DEGs进行可视化。若DEGs对应的Log2FC>0,则该基因在SCJD脑组织中表达升高;若DEGs对应的Log2FC<0,则该DEGs在SCJD脑组织中表达降低。
1.2 功能富集分析用R语言的“cluster Profiler”和“DOSE”包对SCJD的DEGs分别进行KEGG通路分析和GO富集分析,其中GO富集分析涵盖生物学的3个方面,即生物过程(biological process)、细胞组分(cellular component)、分子功能(molecular function)。本研究中P<0.05作为筛选条件,选取排名前十的通路探索DEGs的生物学功能。
1.3 蛋白质互作网络的构建及hub基因的筛选将DEGs导入STRING数据库(http://string.embl.de/),构建DEGs蛋白质相互作用网络(protein-protein interaction,PPI),用Cytoscape软件及MCODE插件对PPI网络进行分析和可视化,以MCODE评分最高且节点个数最多的模块作为PPI网络的枢纽模块,然后计算该枢纽模块中基因间的Pearson相关系数和相关性P值并鉴定SCJD的候选hub基因。
1.4 验证候选hub基因在SCJD脑组织的表达用SCJD相关的GSE124571数据集验证15个基因在人脑组织的RNA水平表达情况,该数据集有SCJD和对照脑组织样本各10例。采用t检验和R语言的“ggplot2”包对候选hub基因的表达进行分析和可视化。
1.5 构建候选hub基因的靶基因-转录因子(TF)和靶基因-miRNA调控网络为了探究候选hub基因中与转录因子和miRNA在SCJD中的相互作用,笔者利用miRnet数据库(https://www.mirnet.ca/)对14个候选hub基因进行了靶基因-转录因子(TF)和靶基因-miRNA调控网络的构建。
1.6 绘制候选hub基因的ROC曲线鉴定关键基因用R语言的“pROC”和“ggplot2”包分析并可视化候选hub基因的受试者工作特征(ROC)曲线,比较候选hub基因在SCJD中的诊断效能。ROC曲线的曲线下面积(AUC)在0.5~1。AUC越接近于1,说明诊断效果越好。AUC在0.5~0.7时有较低准确性,AUC在0.7~0.9时有一定准确性,AUC在0.9以上时有较高准确性。本研究中关键基因选取标准为:AUC>0.9。最终根据候选hub基因的AUC鉴定出SCJD神经炎症相关的hub基因。
2 结果
2.1 DEGs的筛选用GEO2R工具来筛选SCJD患者的DEGs,得到127个DEGs,包括上调DEGs109个和下调DEGs18个。如图1A所示,红色表示上调DEGs,蓝色表示下调DEGs,黑色表示非DEGs。运用R语言的“Complex Heatmap”包对TOP50DEGs的表达水平进行可视化(图1B)。
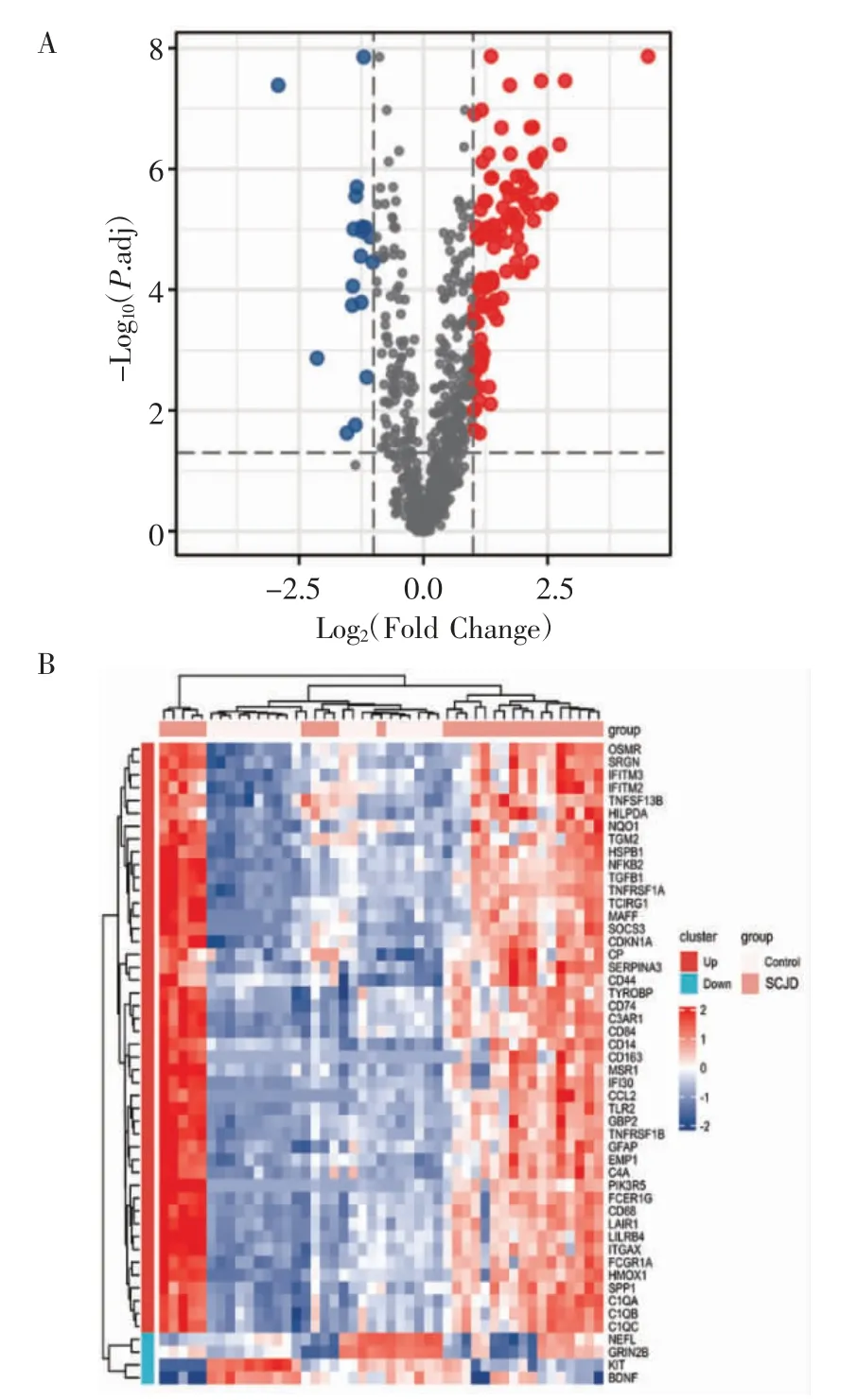
图1 差异基因的可视化分析Fig 1 Visual analysis of differentially expressed genes
2.2 功能富集分析结果为了探索DEGs的生物学功能,对127个DEGs进行KEGG通路分析后,得到的生物学信号通路为Tuberculosis(结核病)、Osteoclast differentiation(破骨细胞分化)、Phagosome(吞噬体)、Staphylococcus aureus infection(金黄色葡萄球菌感染)、NF-kappa B signaling pathway(NF-κB信号通路)和B cell receptor signaling pathway(B细胞受体信号通路)等(图2A)。此外,对127个DEGs进行GO分析后,发现这些基因主要富集在与炎症细胞的激活和炎症有关的生物学功能,包括:在BP中主要富集在leukocyte proliferation(白细胞增殖)、neutrophil degranulation(中性粒细胞脱颗粒)和neutrophil activation involved in immune response(中性粒细胞激活参与免疫反应)等;CC分析表明,这些基因产物在细胞中的位置主要富集在secretory granule membrane(分泌颗粒膜)、endocytic vesicle(内吞泡)和phagocytic vesicle(吞噬小泡)等;在MF分析中,这些基因主要富集在amyloid-beta binding(淀粉样β蛋白结合)、immune receptor activity(免疫受体活性)和IgG binding(IgG结合)等的作用(图2B)。
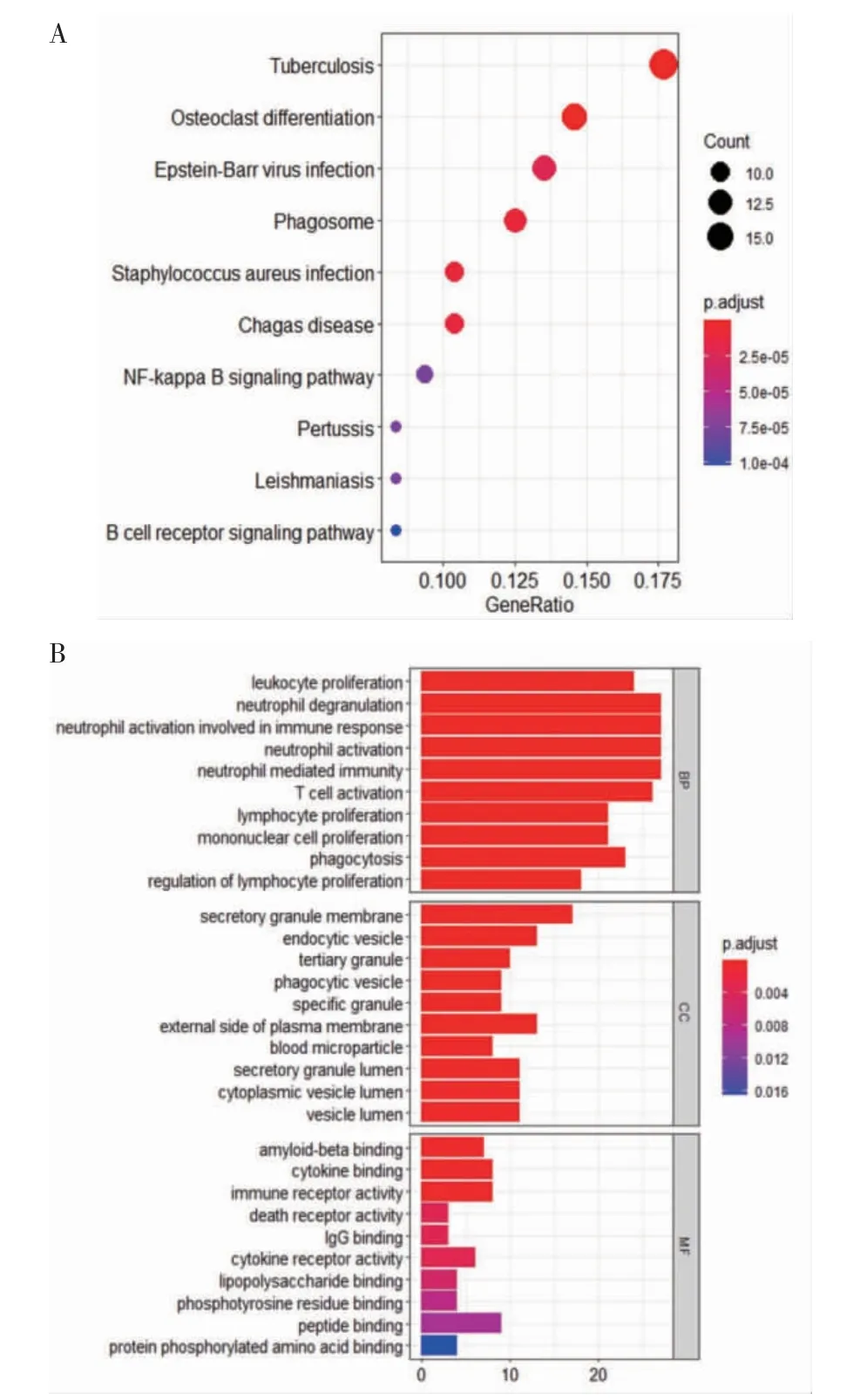
图2 差异基因功能富集分析Fig 2 Functional enrichment analysis of differentiallyexpressedgenes
2.3 蛋白质互作网络的构建及候选hub基因的筛选如图3A所示,该PPI网络包括116个节点和727条边。然后,用Cytotype的MCODE插件进一步分析,结果显示在PPI网络中鉴定出包括16个节点的枢纽模块(图3B)。计算该枢纽模块中基因间的Pearson相关系数和相关性P值后,结果提示TYROBP与其他15个基因的Pearson相关系数r<0.5,且P>0.05(图3C)。因此,TYROBP不能作为该PPI网络的候选hub基因,其他15个基因可作为SCJD的候选hub基因待进一步分析。

图3 SCJD差异基因蛋白质相互作用网络和筛选枢纽基因Fig 3 Protein-protein interaction network of DEGs of SCJD and screening hubgenes
2.4 候选hub基因在SCJD脑组织中的表达如图4所示,15个候选hub基因中的14个基因(TLR2、C1QA、ITGAM、C3AR1、FCER1G、CD163、C1QB、C1QC、FCGR1A、TREM2、MSR1、CTSS、CYBB、AIF1)(图4A~4N)在SCJD脑组织中表达上调且有统计学意义(均P<0.05,t检验),而FCGR3A在SCJD脑组织中的表达无统计学意义(图4O)。因此,这14个基因可作为SCJD的候选hub基因待进一步分析。

图4 15个SCJD候选Hub基因在与SCJD相关的GSE124571数据集的脑组织样本中的表达Fig 4 The expression of fifteen candidate hub genes of SCJD in brain tissue samples from GSE124571 dataset related to SCJD
2.5 候选hub基因的靶基因-TF和靶基因-miRNA调控网络如图5A所示,在TF靶调控网络中,有TF的靶基因是TLR2、ITGAM、CD163、FCGR1A、MSR1、CTSS和CYBB。CYBB与SPI1等8个TF相互作用;CD163与SPI1、SP1等4个TF相互作用;TLR2与SP1等3个TF相互作用。如图5B所示,在miRNA靶调控网络中,有miRNA的靶基因是TLR2、ITGAM、C3AR1、FCER1G、C1QB、C1QC、TREM2、MSR1、CTSS、CYBB和AIF1。C3AR1和QKI均与has-mir-107和hsa-mir-16-5p相互作用;C1QB和FCER1G均与hsa-mir-124-3p相互作用。

图5 14个hub基因的靶基因-TF和靶基因-miRNA调控网络Fig 5 TF-target gene and miRNA-target gene regulatory network of fourteen hub genes
2.6 hub基因的鉴定用ROC曲线的AUC值比较14个候选hub基因在SCJD中诊断效能。TLR2、C1QA、ITGAM、C3AR1对SCJD的诊断有较高的准确性(AUC>0.9,图6A~6D);FCER1G、CD163、C1QB、C1QC、FCGR1A、TREM2、MSR1、CTSS、CYBB、AIF1对SCJD的诊断有一定的准确性(0.9>AUC>0.7,图6E~6N)。TLR2、C1QA、ITGAM、C3AR1为SCJD的神经炎症过程中的hub基因。

图6 14个SCJD枢纽基因的受试者工作特征曲线Fig 6 Receiver operating characteristic curves of fourteen hub genes of SCJD
3 讨论
据有关研究报道,免疫系统反应、新陈代谢、发育生物学和囊泡介导的转运等生物学过程参与了克雅氏病的发病[4]。然而,关于人类SCJD发病过程中神经炎症相关机制的研究报道较少,具体机制尚未清楚。因此,探究神经炎症在SCJD发病过程中的作用机制具有重要的意义。本研究通过生物信息学分析方法鉴定出TLR2、C1QA、ITGAM、C3AR1为SCJD神经炎症过程中的hub基因,为SCJD神经炎症发展过程中的机制研究提供了新思路。
研究报道,朊病毒感染会刺激模式识别受体(PRR)相关分子和信号通路,包括Toll样受体(TLRs)、干扰素调节因子(IRFs)和一些细胞因子[5]。此外,在SCJD中,星形胶质细胞介导的吞噬作用和PrP-铁蛋白聚集体的自噬可以保护细胞免受毒性,因此吞噬体在SCJD发病过程中对神经元有保护作用[6]。一项研究显示在SCJD和SCJD MM1小鼠中炎症相关的NF-κB/IKK和JAK/STAT细胞信号通路被激活[7]。然而,在本研究中,KEGG通路分析结果提示SCJD神经炎症的发生与细菌和病毒的感染、吞噬体、NF-κB信号通路和B细胞受体信号通路等有关。GO分析结果提示SCJD的发生与炎症细胞的激活和炎症反应有关。由此可知,细菌和病毒的感染以及相关的免疫反应生物学过程在SCJD发展过程中有重要作用,但这些通路在SCJD中的具体机制仍需要进一步研究。
细胞膜上表达的TLR2在TLR家族的10个功能成员中占有特殊的地位,它可以检测多种微生物物种的病原体相关分子模式(PAMP),从而能够感知最广泛的PAMP。一项研究报道,TLR2是Aβ触发神经炎症激活的主要受体,抑制小胶质细胞中TLR2的表达对阿尔茨海默病(AD)的发病有益;在AD淀粉样前体转基因小鼠中,TLR2的缺失能将小胶质细胞的M1型炎症激活转变为M2型炎症激活,这种转变可以改善神经元的功能[8];此外,TLR2在帕金森病[9]和多发性硬化[10]等神经系统疾病中有重要的作用,这些发现表明TLR2在神经退行性疾病的炎症激活过程中有重要的作用。本研究发现TLR2在SCJD中表达上调,且对SCJD有较高的诊断效能,因此,TLR2可能是SCJD发病过程中神经炎症相关的关键基因。
补体蛋白C1QA是组成C1Q的重要部分,C1Q是经典补体激活途径的亚单位复合体C1的识别成分。研究报道,补体蛋白的表达在神经元损伤后、衰老期间和AD等神经退行性疾病的早期上调,随着损伤的增加,补体蛋白的过度表达介导的突触消除与神经元变性[11]与各种衰老和神经疾病小鼠模型的认知丧失以及精神分裂症等有关[12]。C1QA不仅在精神分裂症的高炎症患者的脑中高表达[13],还与家族性淀粉样多发性神经病的晚期发病有关[14]。本研究发现C1QA在SCJD患者脑组织中表达上调且对SCJD有较高的诊断效能。因此,认为C1QA的高表达与SCJD的神经炎症有较大的相关性。
ITGAM(CD11b)是整联蛋白受体CD11b/CD18的α链,在先天免疫细胞(巨噬细胞和中性粒细胞)的表面高度表达,与系统性红斑狼疮及其并发症的易感性密切相关[15]。据报道,小胶质细胞中的CD11b对β-淀粉样蛋白(Aβ)诱导的神经毒性至关重要,因为CD11b的敲除可显著减弱Aβ诱导的小胶质细胞激活、超氧化物的产生和体内、体外神经变性[16]。ITGAM调节与缺血性脑损伤相关的分子,如纤维蛋白 原、TNF、IL6、ITGB2、NF-kB、STAT3、MAPK3和MAPK1有关,此外,ITGAM在大鼠大脑中段闭塞模型中表达上调[17]。本研究发现ITGAM在SCJD患者的脑组织中表达上调且对SCJD有较高的诊断效能。因此,认为ITGAM的高表达与SCJD的炎症反应相关,并且可能也参与了SCJD患者脑组织中神经毒性的发生。
C3AR1是趋化和炎症肽过敏毒素C3a的受体,位于补体系统的末端,调节趋化性和信号转导。C3AR1在AD的PS19小鼠模型中的缺失可减轻tau病变、神经炎症、突触缺陷和神经变性[18],其选择性靶向有望调节炎症而不会对吞噬、清除(C3b)和膜攻击复合物(C5b/MAC)等其他关键补体过程产生不利影响[19]。在tau转基因小鼠模型中,通过内皮细胞增强C3a/C3aR信号通路表达会促进血管炎症和BBB功能障碍,并导致小鼠衰老和神经退行性疾病神经炎症[20]。此外,C3AR1可作为肌萎缩侧索硬化的潜在生物标志物[21]。本研究发现C3AR1在SCJD患者的脑组织中表达上调且对SCJD有较高的诊断效能。尽管C3AR1与SCJD相关的报道较少,但C3AR1的上调会导致神经退行性疾病的神经炎症,提示C3AR1在SCJD中有重要的作用。因此,认为C3AR1的高表达与SCJD发病过程中的神经炎症反应有很大的相关性,C3AR1在SCJD中的具体作用机制需要进一步研究。
综上所述,本研究基于生物信息学分析筛选出SCJD炎症相关的4个hub基因,提示TLR2、C1QA、ITGAM、C3AR1可能为SCJD的早期诊断提供新思路,其作用有待进一步探究。本文为探索SCJD神经炎症相关发展的分子机制、诊断和治疗提供了理论依据。
