基于TCGA数据库分析JMJD6在肝癌组织中的表达及临床意义
2022-01-22赵冉武燕洁刘振凤冯圣鋆兰蓓
赵冉,武燕洁,刘振凤,冯圣鋆,兰蓓
(天津医科大学基础医学院生物化学与分子生物学系,天津 300070)
肝癌是全球范围内最常见的恶性肿瘤之一,因此对肝癌中异常表达基因的研究将有助于寻找新的治疗靶点。JMJD6蛋白属于Jumonji C domain-contai ning(JMJD)蛋白家族,主要定位在细胞核内,具有催化组蛋白或非组蛋白赖氨酸羟基化和精氨酸去甲基化活性。最新研究发现,JMJD6还具有酪氨酸激酶活性[1]。JMJD6在多种生物学过程中发挥重要作用,能够将组蛋白H4R3me2去甲基化[2],并通过与Br d4结合调控转录[3]。JMJD6能够与剪接因子U2AF65结合并羟基化其第15位和第276位赖氨酸,进而影响RNA剪接[4]。此外,JMJD6能够磷酸化组蛋白H2A.X第39位酪氨酸,促进细胞自噬[1]。同时,越来越多的研究表明,JMJD6在乳腺癌、肺癌、卵巢癌、胶质母细胞瘤、黑色素瘤等多种癌症中发挥作用[5-9],但是其在肝癌中的作用仍有待进一步研究。为了探讨JMJD6在肝癌中的作用,笔者对TCGA数据库进行数据挖掘,分析JMJD6在肝癌组织中的表达水平及其与预后的关系,并进一步分析JMJD6表达对细胞信号通路的影响,为其作为肝癌诊断和治疗的靶点奠定理论基础。
1 材料与方法
1.1 数据资料收集及患者分组从GDC(https://portal.gdc.cancer.gov/)下载TCGA肝癌患者项目为TCGALIHC的RNA FPKM数据和患者临床资料。剔除缺少RNA数据或临床信息的患者,且相同患者保留原位癌数据,最后371例肝癌患者列入本次分析(其中50例患者包括癌组织和正常组织,其余321例仅包括癌组织)。以肝癌组织中JMJD6 mRNA表达量中位值为界(MEDIA=3.380),将患者分为高表达组(185例)和低表达组(186例)。JMJD6在正常组织和肝癌组织中的免疫组化数据来自The Human Protein Atlas(HPA:https://www.proteinatlas.org/)。
1.2 JMJD6表达的差异分析及与患者临床特征的关系比较肝癌患者正常组织和肿瘤组织中的JMJD6表达量差异,以及不同临床分期或病理分级患者之间的表达差异,寻找JMJD6表达与临床特征的相关性。进行Kaplan-Meier生存分析及Cox回归分析,探讨JMJD6表达与肝癌患者预后的关系。其中Kaplan-Meier生存分析删除了1例无生存数据病例,Cox回归分析中删除27例临床信息不全的病例。
1.3 基因集富集分析(gene set enrichment analysis,GSEA)利用GSEA 4.0.1对肿瘤样本JMJD6高表达组和低表达组的差异表达基因进行比较分析,探讨JMJD6表达水平对细胞信号通路的影响。基因集数据库选择kegg.v7.4,置换次数设定为1 000次,以q<0.05为显著富集基因集。
1.4 统计学处理数据用R语言R-4.0.3进行整理和统计学分析。非正态分布的计量数据采用中位数(P25,P75)描述,进行Wilcoxon检验比较JMJD6表达差异,进行单因素Logistic回归分析JMJD6表达量与临床特征的相关性。绘制Kaplan-Meier生存分析曲线,进行单因素和多因素Cox回归分析。P<0.05为差异有统计学意义。
2 结果
2.1 JMJD6在肝癌组织中的表达肿瘤组织中JMJD6 mRNA表达显著升高[肿瘤组织:3.380(2.489,4.969),正常组织:1.606(1.283,2.322),W=2 506,P<0.001,图1A]。此外,将50个正常组织及其对应的肿瘤组织进行配对分析,结果同样显示,肿瘤组织中JMJD6表达高于正常组织(配对样本Wilcoxon检验,W=87,P<0.001,图1B)。在HPA数据库中,JMJD6免疫组化染色结果也证明了其在肝癌组织中高表达(图1C)。
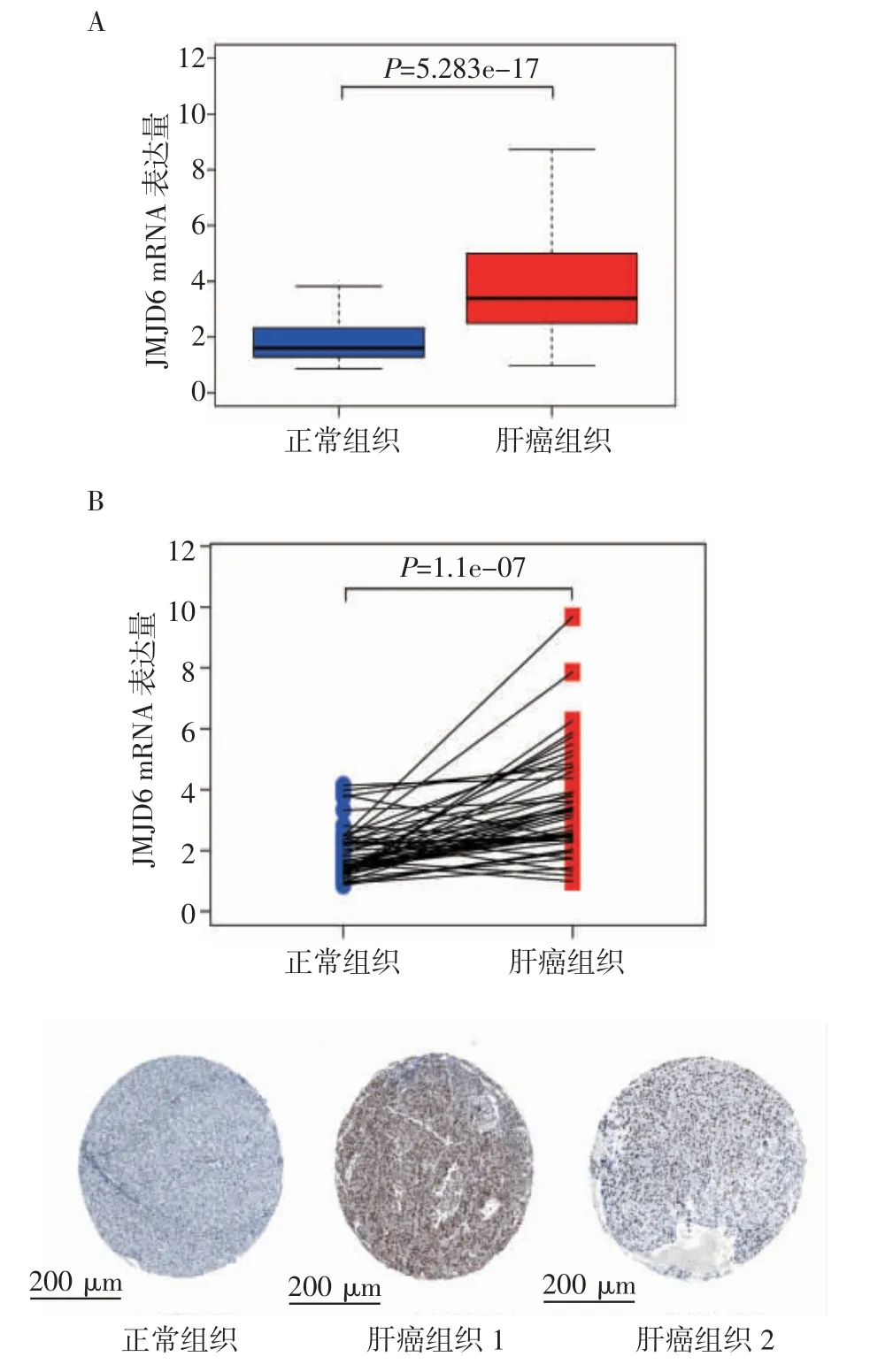
图1 JMJD6在正常组织和肝癌组织中的表达情况Fig 1 The expression of JMJD6 in normal tissues and HCC tissues
2.2 JMJD6表达与临床特征之间的关系应用患者的临床数据分析JMJD6与临床分期及病理分级的关系。结果显示,与stageⅠ期患者相比,stageⅡ、Ⅲ期患者JMJD6表达水平升高,且差异具有统计学意义[stageⅠ:3.093(2.341,4.060),stageⅡ:3.845(2.979,6.220),stageⅢ:4.112(2.526,5.640),stageⅡvs.stageⅠ:W=5 041,P<0.001,stageⅢvs.stageⅠ,W=5 543,P<0.01,图2A]。同样,与G1级相比,G3、G4级患者JMJD6表达水平也升高[G1:2.844(2.012,4.237),G2:3.089(2.415,4.373),G3:3.987(3.050,6.105),G4:4.386(3.433,5.355),G3 vs.G1:W=2 140,P<0.001,G4 vs.G1:W=185,P<0.05,图2B]。采用单因素Logistic回归分析JMJD6表达与不同临床病理特征之间的关系,JMJD6高表达与病理分级和临床分期呈正相关,与年龄呈负相关,而与性别无关(表1)。
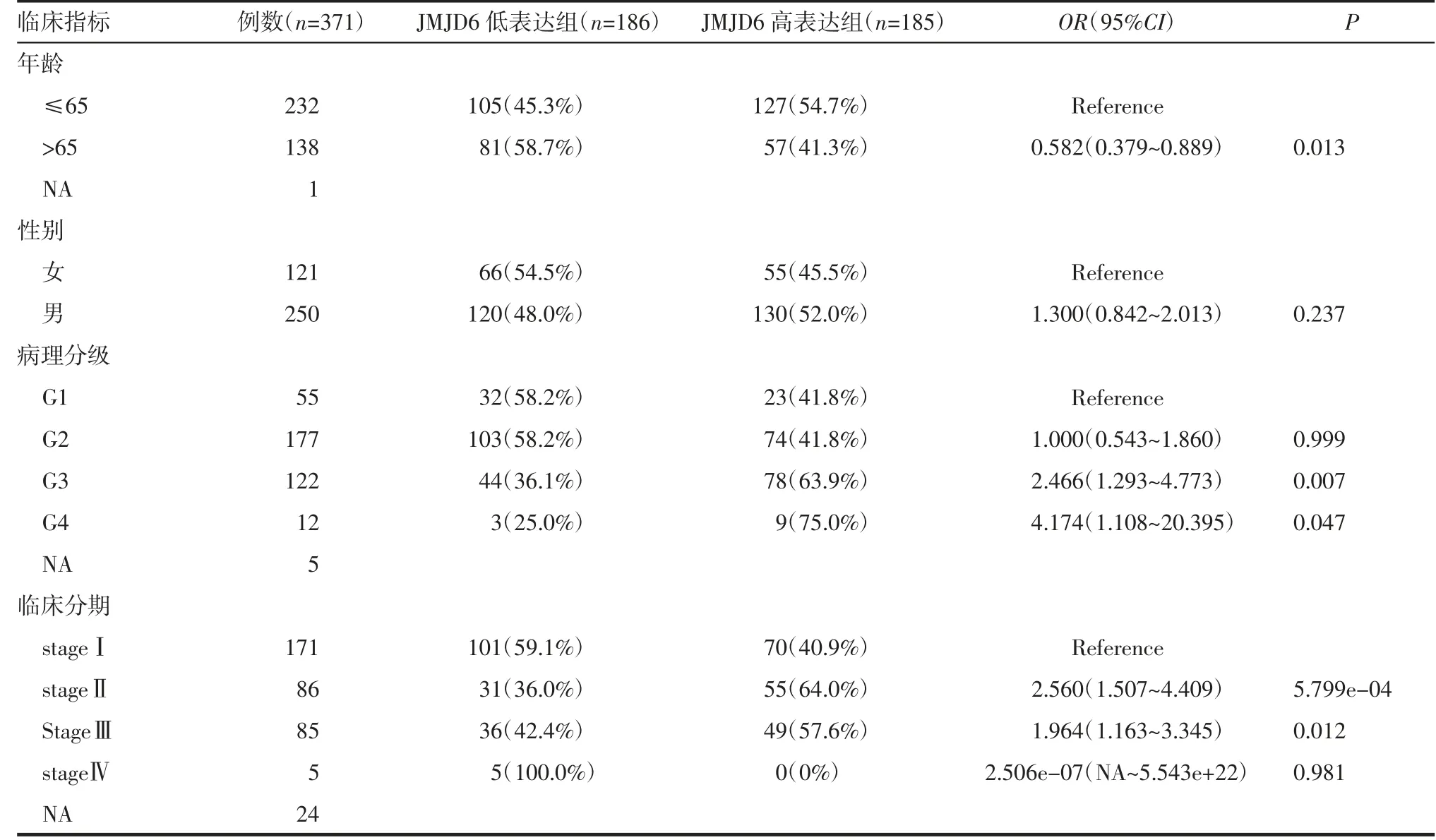
表1 JMJD6基因表达水平与肝癌患者临床特征的关系Tab 1 Relationship between JMJD6 gene expression level and clinical indicators in patients with HCC
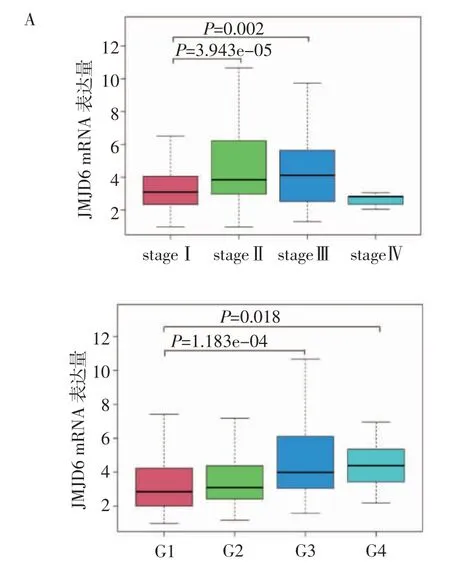
图2 JMJD6 mRNA表达量与临床分期、病理分级的关系Fig 2 The relationship between the expression of JMJD6 mRNA and clinical stage/pathological grade
2.3 JMJD6表达与肝癌预后的关系为了研究JMJD6表达与肿瘤患者生存率之间的关系,进行Kaplan-Meier生存分析。结果显示,JMJD6高表达患者中位生存期为4.082年,少于低表达患者的5.838年(χ2=5.541,P<0.05,图3A)。Kaplan-Meier Plotter在线数据库显示,JMJD6高表达患者和低表达患者的中位生存期分别为41个月和81.9个月(P<0.001,图3B)。
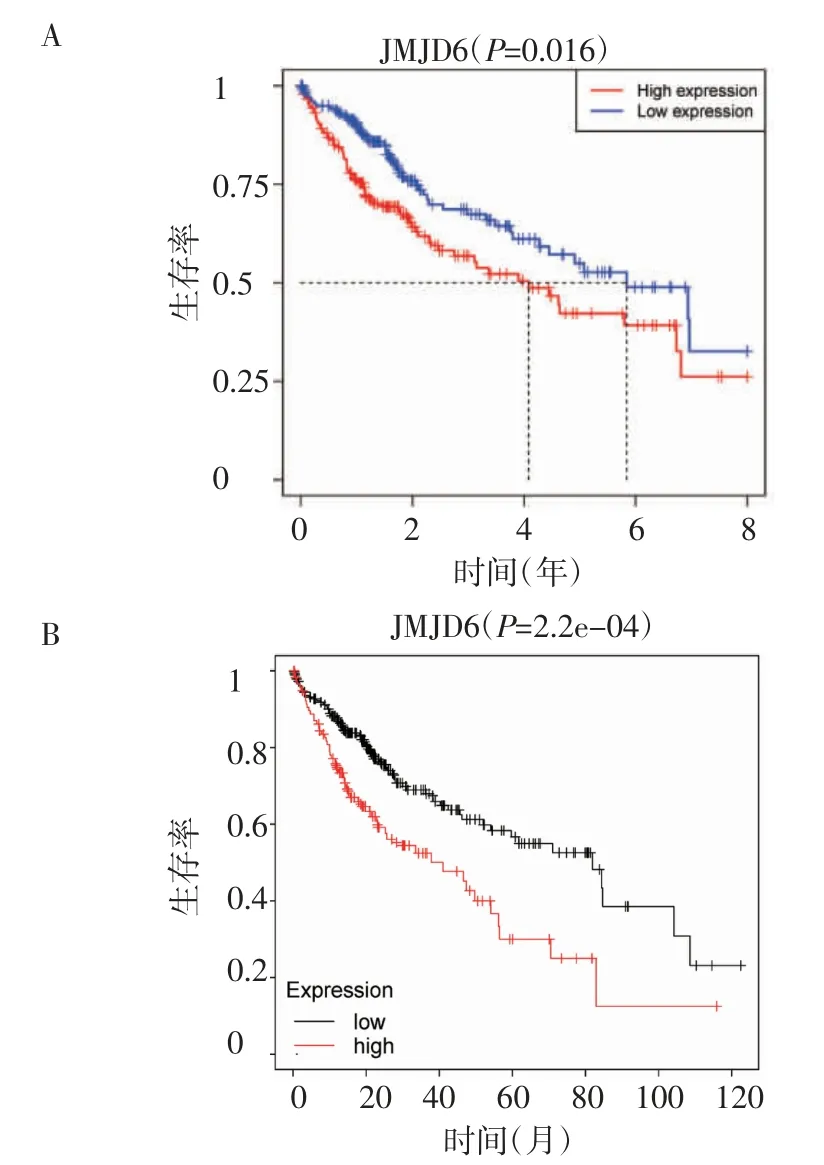
图3 JMJD6 mRNA表达量对肝癌患者生存率的影响Fig 3 The effect of JMJD6 mRNA expression on survival rate of patients of HCC
采用单因素Cox回归分析年龄、性别、病理分级、临床分期、饮酒、Hepatitis B或Hepatitis C感染与否、吸烟及JMJD6表达量对肝癌患者预后的影响。结果显示,临床分期、Hepatitis C感染和JMJD6表达量与肝癌患者预后相关。进一步将单因素分析有统计学意义的变量纳入多因素回归分析中,与临床分期stageⅠ患者相比,stageⅢ和Ⅳ患者死亡风险升高(HR=2.292,95%CI:1.469~3.575,P<0.001;HR=8.202,95%CI:2.484~27.079,P<0.001);丙型肝炎病毒感染及JMJD6高表达患者死亡风险也升高(HR=2.115,95%CI:1.426~3.139,P<0.001;HR=1.109,95%CI:1.039~1.184,P<0.01),见表2。
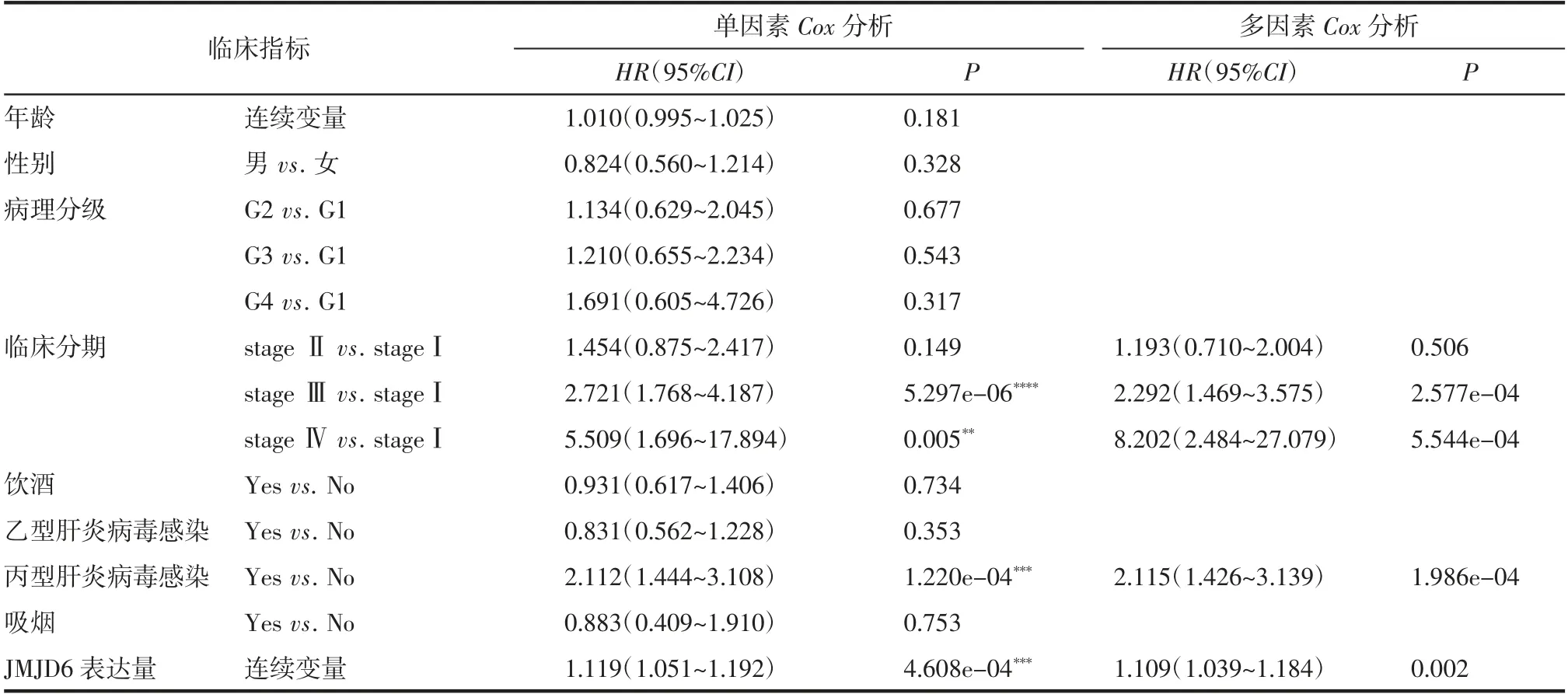
表2 肝癌患者总生存率的单因素和多因素Cox回归分析Tab 2 Univariate and multivariate Cox regression analysis of overall survival rate in patients with HCC
2.4 JMJD6表达水平对细胞信号通路的影响通过GSEA分析,探讨JMJD6表达所影响的信号通路。JMJD6高表达组中,前5个富集的基因集包括:核糖体、剪接、DNA复制、细胞周期。JMJD6低表达组中,前10个富集的基因集包括:脂肪酸代谢、缬氨酸、亮氨酸和异亮氨酸降解、甘氨酸、丝氨酸和苏氨酸代谢、色氨酸代谢等(图4)。
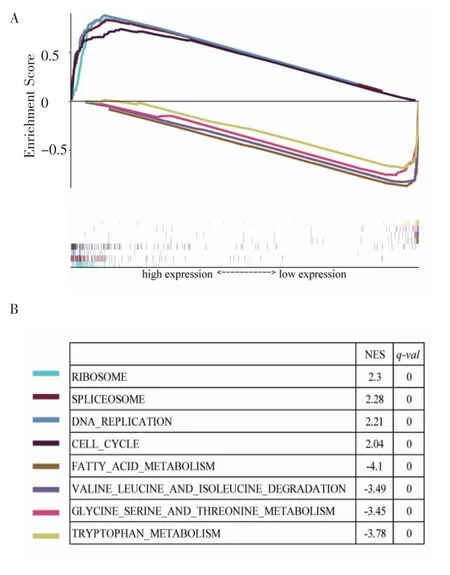
图4 GSEA分析JMJD6表达对细胞信号通路的影响Fig 4 GSEA analysis of the effect of JMJD6 expression on cell signaling pathway
3 讨论
肝癌是常见的癌症类型之一,其发生与多种因素有关,其中以慢性乙型肝炎病毒感染和肝硬化最为常见。肝癌的治疗方法包括肝移植、肝切除、消融、化疗栓塞,靶向治疗肝癌的一线药物包括索拉非尼等,但是肝癌的治疗效果仍然不令人满意[10]。因此,发现肝癌组织中异常表达的蛋白并确定其作用机制,将为肝癌的诊疗提供新的作用靶点。
JMJD6能够催化赖氨酸羟基化和精氨酸去甲基化,其底物包括组蛋白和多种非组蛋白。越来越多的研究发现,JMJD6在多种癌症中异常表达,促进肿瘤的生长、转移。其机制包括:在结肠癌中,JMJD6结合并羟基化p53的K382,抑制了p53的转录活性[11];在乳腺癌中,JMJD6能够抑制转化生长因子-β通路[5],且JMJD6在雌激素受体α结合的增强子的募集是RNA聚合酶Ⅱ招募和增强子RNA产生所必需的,因此雌二醇引起的乳腺癌细胞增殖依赖于JMJD6[12]。
在本研究中,笔者利用TCGA数据库,发现在肝癌患者的癌症组织中JMJD6 mRNA表达量高于正常组织,且随着癌症患者分期增加或者病理分级增加,JMJD6表达也升高。其中,stageⅣ患者与stageⅠ患者相比,JMJD6表达无明显差别(P>0.05),原因可能在于stageⅣ仅为5例,样本量过小,不具有代表性。单因素Logistic回归分析显示JMJD6高表达与年龄、临床分期和病理分级相关。以上结果说明JMJD6 mRNA高表达与肝癌的发生、发展相关。其次,Kaplan-Meier生存曲线结果表明,JMJD6 mRNA高表达导致肝癌患者生存率下降,Cox回归分析显示JMJD6表达量、临床分期及丙型肝炎病毒感染是患者预后的独立危险因素,即JMJD6高表达导致了肝癌患者的不良预后。
GSEA分析结果显示,JMJD6高表达组在RNA剪接、DNA复制、细胞周期等通路富集。RNA剪接是JMJD6已知重要功能之一,在黑色素瘤中,JMJD6通过影响p21-Activated kinase 1(PAK1)的可变剪接,激活丝裂原活化蛋白激酶通路,促进肿瘤细胞生长、侵袭[8];细胞周期的失调是肿瘤细胞异常增殖的基础[13],JMJD6高表达伴随细胞周期通路基因的富集,如Cyclin B1(CCNB1)、Cyclin B1(CCNB2)、细胞周期蛋白依赖激酶2(CDK2)的高表达,与肿瘤的发生紧密相关[14]。此外,JMJD6高表达组在DNA复制通路富集,包括在DNA复制过程中起关键作用的MCM蛋白。而根据之前的报道,MCM家族蛋白能够促进肝癌的增殖[15]。JMJD6低表达组在脂肪酸和氨基酸代谢通路富集,而JMJD6在肿瘤代谢中的研究还未见报道,该结果提示JMJD6在代谢过程可能也发挥作用。
笔者还分析了JMJD6在肝癌患者中的突变和拷贝数改变的情况(结果未展示)。在已知信息的364例患者中,仅有1例患者JMJD6基因发生突变,说明JMJD6在肝癌患者中的突变频率很低。JMJD6不属于拷贝数显著扩增或缺失基因,因此JMJD6突变及拷贝数变化不是导致其在肿瘤中表达升高的原因。
总之,本研究结果说明JMJD6在肝癌组织中高表达,与肝癌的发生、发展及患者不良预后相关,为后续研究鉴定了基础。
