非小细胞肺癌M1期患者的危险、预后因素和转移特征:一项基于SEER数据库的研究
2022-01-22陈嫱英硕李冠华赵晓赟张力
陈嫱,英硕,李冠华,赵晓赟,张力
(天津市胸科医院1.呼吸与危重症医学科;2.心血管内科,天津 300222)
肺癌是全球癌症相关死亡的主要原因,每年有近200万人死于此病。非小细胞肺癌(NSCLC)约占肺癌的80%[1]。因早期无症状,约65%的NSCLC患者在确诊时已出现局部进展或转移[2]。骨、脑、肝、肺是NSCLC最常见的转移器官,有报道最高转移率分别可达39%、30%、24%、80%[3]。考虑到NSCLC患者转移和死亡的高风险,如人们能准确估计其相关危险因素、预后标志物和转移特征,通过早期干预可能会改善此类患者临床结局。遗憾的是,由于研究和样本量有限,这些因素和转移特征没有足够的循证证据支持。在本项研究中,通过对Surveillance,Epidemiology and End Results(SEER)数据库的大样本数据挖掘,筛选1975—2016年NSCLC患者诊治和生存信息,以确定M1期患者的危险、预后因素和转移特征。
1 资料与方法
1.1 数据库在本项研究中,所有病例都来自于SEER数据库(SEER.cancer.gov),这是一个公开的癌症数据库,覆盖约34.6%的美国人口。使用SEER*Stat 8.3.6版本下载1975—2016年数据用于分析总体情况。
1.2 数据收集骨、脑、肝、肺的转移信息是2010年开始记录的。从这个数据库中提取以下变量:确诊时的年龄、种族、性别、分级、原发部位、侧位、American Joint Committee on Cancer(AJCC)分期、T分期、N分期、M分期、肿瘤直径、手术、放疗、化疗、转移模式(骨、脑、肝、肺)、生存时间等。排除未知或空白数据。
1.3 统计学处理使用χ2检验比较不同的分类变量,并确定这些基线特征之间的相关性。采用单因素Logistic回归分析对远处转移的影响因素进行初步评价。随后进行多因素Logistic回归分析,验证危险因素。采用单变量和多变量Cox比例风险回归模型,确定影响总生存期(OS)的预测因素。回归模型均计算95%置信区间(CI)。Kaplan-Meier曲线和Log-rank检验用于比较不同转移模式间的OS。双侧P<0.05为差异有统计学意义。所有统计分析均采用SPSS统计软件24.0版本(IBM公司Armonk,NY,US)。
2 结果
2.1 患者资料本研究共纳入26 497例NSCLC患者,其中男性12 639例(47.70%),女性13 858例(52.30%)。患者根据年龄(<35岁,35~49岁,50~64岁,65~79岁和≥80岁),种族(白种人、黑种人和其他种族),性别(男性和女性),分级(Ⅰ~Ⅳ),原发部位(主支气管、上、中、下叶),肿瘤位于肺组织位置(单侧、两侧),分级(Ⅰ~Ⅳ),T期(1~4),N期(0~3),M期(0~1),肿瘤直径(<1 cm、1~2 cm、2~3 cm、3~4 cm、4~5 cm和≥5 cm),手术(有或无),放疗(有或无),化疗(有或无)分组。
2.2 远处转移部位骨、脑、肝、肺是常见的远处转移部位。确诊时共发现骨转移1 773例(6.69%),脑转移1 471例(5.55%),肝转移838例(3.16%),肺转移1 737例(6.56%)。表1显示了NSCLC患者的临床基线特征和4个转移部位。

表1 NSCLC患者临床基线特征和转移部位[n=26 497,n(%)]Tab 1 Clinical baseline characteristics and metastasis sites for with patients[n=26 497,n(%)]
2.2.1 骨转移 骨转移多见于年龄35~49岁、男性、Ⅲ级、原发部位为主支气管、T4期、N3期、肿瘤直径≥5 cm、无手术、放疗和化疗(P均<0.001)的患者。
2.2.2 脑转移 年龄35~49岁、黑种人、男性、Ⅳ级、原发部位为主支气管、T4期、N3期、肿瘤直径≥5 cm、无手术、放疗、化疗(均P<0.001)治疗和双侧性(P=0.022)是脑转移的相关因素。
2.2.3 肝转移 男性、Ⅳ级、原发部位主支气管、T4期、N3期、肿瘤直径≥5 cm、无手术、放疗、化疗(均P<0.001)、双侧性(P=0.022)的患者肝转移发生率较高。
2.2.4 肺转移 肺转移多见于黑种人、男性、Ⅲ级、原发部位主支气管、双侧、T4期、N3期、肿瘤直径≥5 cm、无手术、放疗、化疗(均P<0.001)、年龄35~49岁(P=0.015)。
2.2.5 转移模式 5 453例M1期患者中,近1/4(24.28%)出现一个以上的转移部位。单一部位转移(10.46%)是最常见的转移方式,其中孤立性肺转移所占比例最高(3.49%),肝转移最少(0.91%)。两个转移部位以骨+肺最常见(1.03%)。3个转移部位以骨+肝+肺为主(0.38%)。4处转移54例(0.20%)。余1 355例患者伴有其他部位转移。
2.3 NSCLC患者远处转移的危险因素采用Logistic回归分析明确远处转移的危险因素。在校正所有因素后,多因素Logistic回归分析中,较高的分级(Ⅲ~Ⅳ)(P均<0.001)、T分期(2~4)(均P<0.000 1)、N分期(1~3)(均P<0.000 1)、双侧性(P<0.001)和较大的肿瘤直径(≥4 cm)(分别为P=0.019和P=0.009)是NSCLC远处转移的独立危险因素,见表2。
2.4 生存期末次随访累计死亡12 912例(48.73%)。无远处转移患者的中位OS为69个月,有远处转移患者的中位OS为6个月(P<0.001)。孤立性肺转移患者中位OS最长(10个月)。两种转移组合间无显著差异(P=0.424)。骨+脑+肺(3个月)和骨+肝+肺(3个月)的中位OS较其他组合长(P=0.025)。4个转移部位的患者中位OS最短(2个月)。其他部位、单一转移部位、2处转移部位、3处转移部位、4处转移的中位OS分别为7个月、6个月、4个月、3个月、2个月(P<0.001),见表2。

表2 NSCLC患者远处转移的危险因素(n=26 497)Tab 2 Risk factors for distant metastasis of NSCLC patients(n=26 497)
无远处转移患者1、3、5年OS率分别为83.18%、68.07%、62.88%。而远处转移患者1、3、5年OS率分别为29.38%、14.01%、11.90%(P均<0.001)。孤立性肺转移患者1、3、5年OS率最高(分别为44.97%、26.05%、22.16%)。其他部位1、3、5年OS率次之(分别为35.21%、17.16%、14.20%)。4个转移部位的1、3、5年OS率最低(分别为7.41%、0、0)。表3列出了不同转移模式的NSCLC患者的1年、3年、5年OS率。
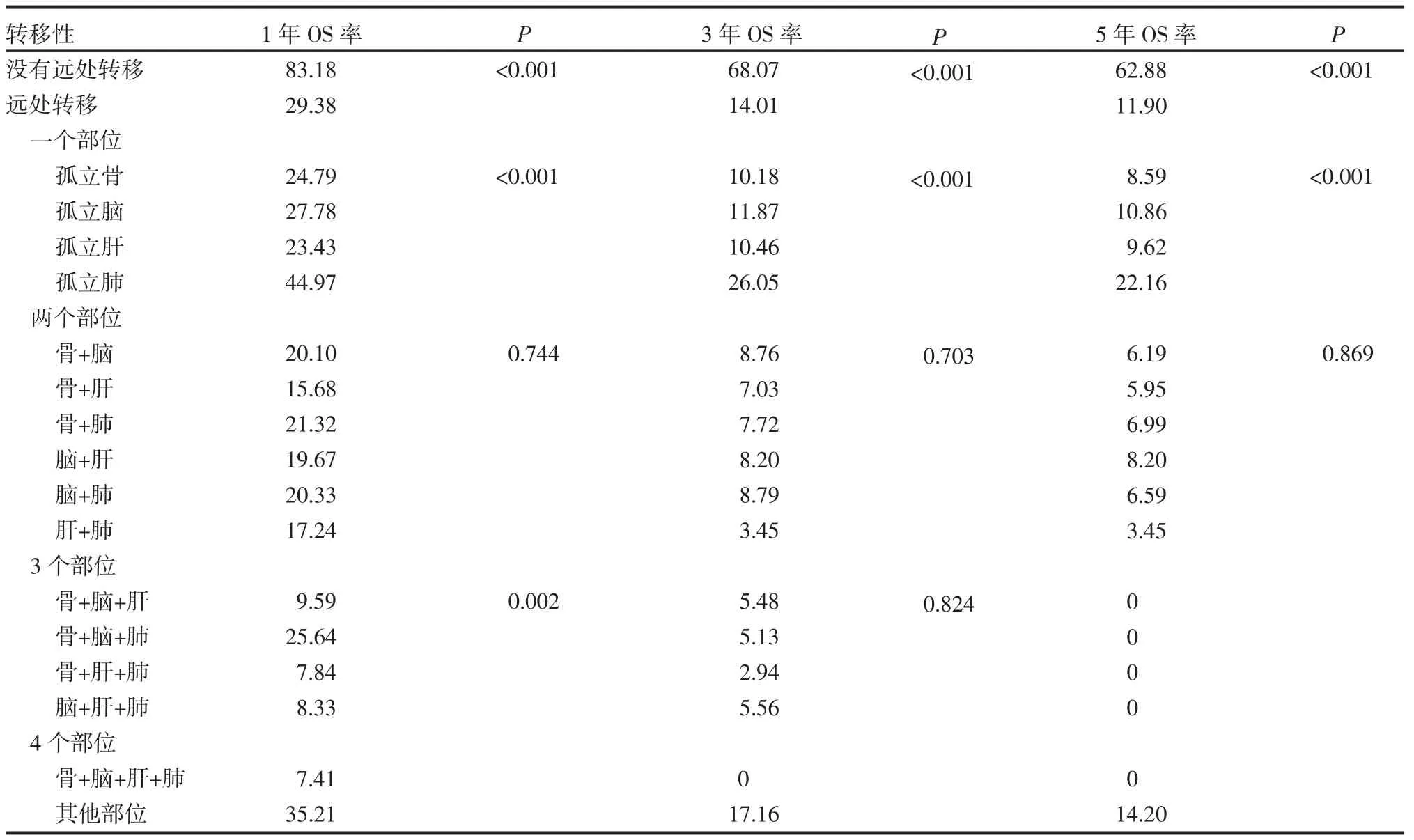
表3 不同转移部位的OS率(n=26 497,%)Tab 3 The OS rates of different metastatic sites(n=26 497,%)
Kaplan-Meier图可以直观反映生存时间的差异。总体而言,有远处转移的NSCLC患者OS较无远处转移的患者更短(P<0.001)。对于一个转移部位来说,Kaplan-Meier图显示肺转移患者的OS最长(P<0.001)。在两个转移部位的模式中,所有组合之间OS没有显著差异(P=0.424)。骨+脑+肺转移的患者在3个转移部位中OS较长(P=0.025),有趣的是,在所有转移部位中,其他部位转移患者OS最长,而具有4个部位转移的患者OS最短(P<0.001)。OS的生存曲线如图1所示。

图1 不同转移特征患者间OS差异的Kaplan-Meier曲线Fig 1 Kaplan-Meier curve of OS among different metastatic features in patients
2.5 影响NSCLC伴远处转移患者OS的预测因素通过多因素Cox回归分析,在校正所有变量后,发现更高的分级(Ⅱ~Ⅳ)(P<0.001),所有N期(1~3)(P<0.001)和较大的肿瘤直径(≥5 cm)(P=0.009)是M1期的NSCLC患者OS较差的独立预测因素,而其他种族(美国印第安人、亚洲人和太平洋岛民)、女性、肺上叶、手术、放疗和化疗与OS更好相关。OS的Cox回归分析细节见表4。

表4 M1期NSCLC患者OS的单因素和多因素Cox回归分析Tab 4 Univariate and multivariate Cox regression analysis of OS in NSCLC patients with M1 stage
3 讨论
既往很少有大规模的临床研究系统性地描述M1期NSCLC患者的危险、预后因素和转移特征。因此,笔者从SEER数据库中提取大量病例数据进行回顾性分析。骨、脑、肝、肺是最常见的远处转移部位。本研究中NSCLC患者远处转移的发生率较其他研究低,主要是因为笔者选取的样本中M1期患者的比例较低[4]。笔者还发现发生率最高的转移模式是一个部位,其中肺是最常见的受累器官。这一现象部分可以通过肺内转移定义的明确和诊断技术的改进来解释[5]。在两个转移部位中,骨+肺所占比例最大。在3个转移部位中,骨+肝+肺比其他组合更常见。4个转移部位的患者占比最少。
本研究通过多因素Logistic回归分析发现,较高的分级(Ⅲ~Ⅳ)、T分期(2~4)、N分期(1~3)、双侧分布、较大的肿瘤直径(≥4 cm)是NSCLC远处转移的独立危险因素。最近的一项研究显示,年龄<70岁、腺癌或大细胞肺癌、肿瘤直径>3 cm、肿瘤分级≥Ⅱ、N期(1~3)与脑转移相关。不同肿瘤浸润部位对远处转移也有影响。Shimada等[6]研究表明,伴瘤外血管侵犯的NSCLC患者远处转移率高于瘤内血管侵犯患者。Tian等[7]研究表明,脏层胸膜浸润与远处转移率的增加密切相关。此外,肋间肌或肋骨被侵犯促进远处转移,可能是由于血供丰富所致[8]。NSCLC也可通过淋巴结进行远处转移[9]。在本研究中,笔者发现原发双侧NSCLC是远处转移的一个危险因素。1975年,同时多原发肺癌(synchronous multiple primary lung cancer,sMPLC)和异时多原发肺癌(metachronous multiple primary lung cancer,mMPLC)由Martini和Melamed[10]首先提出。随着计算机断层扫描和组织病理学技术的快速发展,越来越多的患者被诊断为MPLC。但目前的TNM分期系统并没有应用于MPLC,因此治疗方案存在争议。
在本研究中,笔者发现无转移患者的中位OS和OS率明显优于转移患者。M1期患者中位OS和OS率与转移部位数呈负相关。这些特征与其他肿瘤相似[11]。值得注意的是,孤立性肺转移的患者预后比其他转移部位要好得多。1995年,Hellman和Weichselbaum提出了“寡转移”(oligmetastasis)的概念,即对某些肿瘤而言,只有一个或有限数量的转移器官。局部治疗寡转移部位可获得长期生存[12]。
在本研究中,更高的分级、N期和更大的肿瘤直径是M1期NSCLC患者OS较差的独立预测因素。而其他种族、女性、肺上叶、手术、放疗和化疗与更好的OS相关。分级对NSCLC患者的生存预测价值较差。与高分化型相比,未分化型、低分化型和中分化型的死亡风险均增加[13]。此外,肿瘤直径大、肿瘤分级高和淋巴转移与不良OS相关[14]。一项大型队列研究表明,男性NSCLC患者预后较女性差。这一现象是由许多因素造成的,如女性年龄较轻、吸烟较少、身体状况较好、表皮生长因子受体(EGFR)阳性的情况较多等[15],但另有研究却发现某些因子(如活化T细胞核转录因子2)在女性及非吸烟NSCLC患者中高表达[16]。一项与NSCLC患者的种族和预后差异相关的研究指出,种族是OS的独立预后因素。与白种人患者[17]相比,亚洲患者发生EGFR突变更常见、吸烟者更少、免疫治疗后生存改善更明显。而在本研究中,白种人和黑种人患者的OS没有差异。但一项研究分析,考虑到社会经济地位[18],黑种人患者的生存率比白人患者低。值得注意的是,一项纳入了10项研究的荟萃分析表明,位于肺上叶的NSCLC患者的5年生存率高于其他叶患者。这一特点可以用以下几个原因解释。首先,下叶肿瘤的准确分期难以确定。其次,下叶肿瘤更容易侵袭扩散到附近的组织[19]。对于伴有远处转移的NSCLC,治疗是最值得关注的。本研究认为手术、放疗、化疗可改善M1期患者的预后。笔者知道,这类患者应根据病理模式、分子遗传特征和身体状况,初步给予全身治疗,以期延长生存时间,减缓疾病进展,提高生活质量。联合化疗是[20]NSCLC的一线治疗。此外,放射治疗是一种有效的治疗方案[21]。Ⅰ、Ⅱ、ⅢA期NSCLC患者可采用手术治疗[22]。但对于Ⅳ期患者是否能从手术中获益仍存在争议。一些研究表明,对于寡转移病灶的患者,通过手术或放射治疗可以改善预后[23-25]。
本研究入组样本量大,但仍有一定的局限性。(1)这是一项回顾性研究,证据水平低于前瞻性队列研究。(2)统计偏倚可能是由于白种人患者比例高造成的。(3)SEER数据库没有提供更多的转移部位和更多的信息,如死亡原因、手术、化疗、放疗方案和其他药物。(4)虽然免疫治疗、靶向治疗及程序性细胞死亡蛋白-1(PD-1)及其配体(PD-L1)抑制剂等已广泛应用于临床工作中,但SEER数据库并未提供相关资料。
综上所述,较高的分级、T分期、N分期、双侧性、较大的肿瘤直径(≥4 cm)是NSCLC远处转移的独立危险因素。更高的分级、N期和更大的肿瘤直径被确定为M1期患者较差OS的独立预测因素。
