喜炎平注射液对ARDS患者血清炎性因子和全血苦味受体水平的作用及机制*
2022-01-21汤娜娜谢登海杨国辉宁睿刘晓娴方昊李莉刘婷
汤娜娜,谢登海,杨国辉,宁睿,刘晓娴,方昊,李莉,刘婷
(1.贵州医科大学附属医院 内科ICU,贵州 贵阳 550004;2.贵州医科大学附属医院 心内科,贵州 贵阳 550004)
喜炎平注射液是由穿心莲内酯总磺化物制成的现代中药注射液,具有抗病毒、抗菌及抗炎等作用,被广泛用于呼吸系统感染性和炎症性疾病的临床治疗[1-2]。苦味受体(bitter taste receptors,TAS2R)是与人体感受苦味物质密切相关的一类G蛋白偶联受体,在全身多个组织器官中均有表达[3],近年发现TAS2R在呼吸系统的防御机制中发挥重要作用[4-5]。本课题组前期生物学研究表明,TAS2R亚型TAS2R39是脓毒症并发急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)的关键基因之一,提示TAS2R及其信号通路可能在ARDS发生机制中发挥重要作用[6]。穿心莲属苦味类中药[7],喜炎平注射液可否通过调节TAS2R的表达、在治疗ARDS中发挥抗炎效应尚无研究报道。本研究通过观察喜炎平注射液对ARDS 患者炎症反应的影响,并对其作用机制进行初步探讨,现报道如下。
1 对象与方法
1.1 研究对象
选取2020年7月—2021年6月收治的ARDS患者,要求符合“ARDS柏林定义”诊断标准[8],治疗前ARDS分型为轻度或中度[氧合指数(the ratio of arterial blood partial pressure of oxygen to the fraction of inspired oxygen,PaO2/FiO2)为100 mmHg<~≤300 mmHg]、呼吸末正压≥5 cm H2O、年龄为18~75岁,患者本人或授权委托人同意并签署知情同意书;排除已知或怀疑对喜炎平注射液或相关成分过敏者,排除妊娠期和哺乳期女性患者,排除有免疫功能缺陷(如长期使用糖皮质激素或免疫抑制剂,恶性肿瘤等),排除有严重肝肾功能异常,排除放弃积极抢救、不愿进行常规治疗者。共纳入ARDS患者49例,采用随机数字表法,将患者分为对照组(n=25)和观察组(n=24),2组患者的临床特征见表1。本研究获得医院伦理委员会批准实施[2020伦审第(268-01)号]。
1.2 研究方法
1.2.1治疗方法 对照组ARDS患者接受ARDS常规治疗,包括病因治疗、机械通气、抗感染及营养支持治疗等;观察组ARDS患者在对照组常规治疗基础上联合喜炎平注射液治疗,治疗方案为喜炎平注射液(江西青峰药业有限公司,国药准字Z20026249)250 mg加0.9%氯化钠注射液250 mL稀释,静脉滴注,1次/d,疗程7 d。
1.2.2基本资料和临床指标收集 收集2组患者治疗前的基本资料,包括性别、年龄、病因分类(肺内源性/肺外源性)、PaO2/FiO2及急性生理与慢性健康状况评分(acute physiology and chronic health evaluation scoring system Ⅱ,APACHE Ⅱ),记录2组患者治疗过程中药物不良反应发生情况(包括皮疹、过敏性休克及严重肝肾功能不全等)以及治疗后的PaO2/FiO2。
1.2.3血清炎性因子检测 分别于治疗前及治疗结束时抽取2组患者外周静脉血标本,3 000 r/min离心10 min,取上清,采用电化学发光法和免疫比浊法分别检测2组患者血清白细胞介素-6(interleukin-6,IL-6)和C反应蛋白(C-reaction protein,CRP)水平,操作严格按说明书执行,IL-6和CRP试剂盒均购自美国Roche。
1.2.4全血TAS2R39 mRNA检测 分别于治疗前及治疗结束时抽取2组患者外周全血标本2 mL,采用逆转录实时荧光定量聚合酶链反应(reverse transcription quantitative PCR,RT-qPCR)检测TAS2R39 mRNA的表达;全血标本离心柱吸附法提取总核糖核酸(ribonucleic acid,RNA),分光光度计检测总RNA纯度和浓度;采用SYBR Green 染色法进行RT-qPCR扩增,以3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作为内参,健康志愿者全血RNA样本作为空白对照,通过2-ΔΔCt公式计算TAS2R39 mRNA的相对表达量;引物由生工生物工程(上海)股份有限公司设计合成,TAS2R39上游引物为5′-TGATACCCTGGCTTCTGT-3′、下游引物为5′-TTAGTGGAGTTGGAGGAGTG-3′,GAPDH上游引物为5′-CAGGAGGCATTGCTGATGAT-3′、下游引物为5′-GAAGGCTGGGGCTCATTT-3′。
1.3 统计学分析

2 结果
2.1 基本资料
2组患者性别、年龄、病因分类、治疗前PaO2/FiO2及APACHE II评分比较,差异均无统计学意义(P>0.05),提示2组患者基本资料具有可比性。见表1。
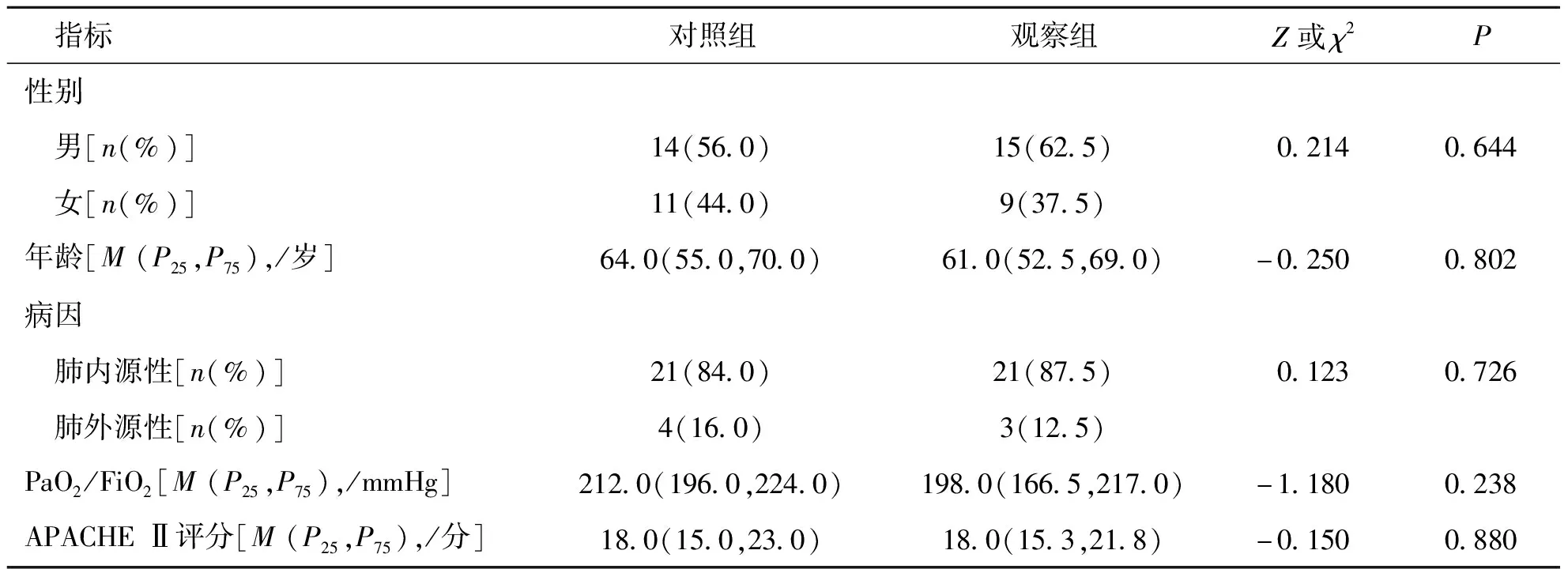
表1 对照组和观察组患者的基本资料
2.2 治疗后PaO2 /FiO2水平及并发症
2组患者在治疗过程中均未发生皮疹、过敏性休克及严重肝肾功能不全等药物不良反应;治疗后,观察组患者的PaO2/FiO2[244.5(190.0,261.5)mmHg]较对照组[225.0(154.0,245.0)mmHg]升高,差异有统计学意义(Z=-2.17,P=0.03)。
2.3 血清 IL-6和CRP水平
治疗前2组患者血清 IL-6、CRP水平比较,差异均无统计学意义(P>0.05);治疗后2组患者血清IL-6、CRP均较治疗前下降(P<0.05),且观察组较对照组的水平更低(P<0.05)。见表2。

表2 对照组和观察组患者血清IL-6和CRP水平比较[M(P25,P75)]
2.4 全血TAS2R39 mRNA
治疗前2组患者全血TAS2R39 mRNA水平比较,差异无统计学意义(P>0.05);对照组患者治疗后全血TAS2R39 mRNA水平与治疗前比较,差异无统计学意义(P>0.05);观察组患者治疗后全血TAS2R39 mRNA水平较治疗前明显升高,且高于对照组,差异均有统计学意义(P<0.01)。见图1。

注:(1)与同组治疗前比较,P<0.01;(2)与同时点对照组比较,P<0.01。
2.5 TAS2R39 mRNA水平与炎性因子的相关性
Spearman相关分析表明,观察组患者治疗后TAS2R39 mRNA的表达分别与 IL-6(rs=-0.728,P<0.001)和CRP(rs=-0.622,P<0.001)水平呈负相关;对照组患者治疗后全血TAS2R39 mRNA的表达与炎性因子IL-6(rs=0.166,P=0.429)和CRP(rs=0.100,P=0.633)的水平无秩相关。
3 讨论
ARDS是一种临床常见的急危重症,是由于炎症反应失控造成的急性弥漫性肺损伤,多种肺内、肺外原因均可诱发ARDS,最常见的病因为细菌性或病毒性肺炎[9]。例如目前全球疫情依然严峻的新冠肺炎,重症患者机体可出现过度的炎症反应即“细胞因子风暴”,引起ARDS等严重并发症,导致患者病情恶化甚至死亡[10-11]。我国在此次抗击新冠肺炎疫情中取得了重大战略成果,中西医结合治疗起到重要作用。在多版《新型冠状病毒肺炎诊疗方案》中,喜炎平注射液被推荐用于治疗重型新冠肺炎患者[12-14]。既往研究表明,喜炎平注射液有多种抗炎机制,如抑制核转录因子-κB/丝裂原活化蛋白激酶(nuclear transcription factor-κB/mitogen activated protein kinase,NF-κB/MAPK)、磷脂酰肌醇3-激酶/蛋白激酶B(phosphatidylinositol-3-kinase/protein kinase B,PI3K/Akt)及Janus激酶/转录激活因子(the Janus kinase/signal transducer of activators of transcription,JAK/STAT)等多条信号通路[15-16];抑制多种细胞多种促炎基因的表达,包括环氧合酶-2(cyclooxygenase,COX-2)、IL-6、白细胞介素-1β(interleukin-1β,IL-1β)、白细胞介素-8(interleukin-8,IL-8)、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)[17];减少氧化应激和血管内皮生长因子(vascular endothelial growth factor,VEGF)、血管细胞黏附分子-1(vascular cell adhesion molecule-1,VCAM-1)、缺氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)及内皮素-1(endothelin-1,ET-1)等的生成[7,18-20]。目前有关喜炎平注射液治疗ARDS的研究报道少见,在本研究中,观察组ARDS患者联合使用喜炎平注射液治疗期间未发生明显药物不良反应,治疗后血清炎性因子IL-6和CRP水平低于对照组、PaO2/FiO2高于对照组,这一结果提示联合喜炎平注射液治疗ARDS,临床安全性好,能有效改善患者氧合,其机制可能与抑制炎性反应有关。
TAS2R属于G蛋白偶联受体,是味觉受体家族成员,人类基因组共编码25种TAS2R亚型[3]。过去认为TAS2R只存在于口腔味蕾,仅与苦味识别相关,近年发现在呼吸、循环、免疫、消化、中枢神经及生殖等多种系统和组织中均有TAS2R表达,并且发挥不同的生物学功能[21];呼吸系统气道上皮细胞的TAS2R能增加气道纤毛搏动频率,并可作为前哨受体检测入侵的革兰氏阴性菌,触发防御性杀菌反应[22];TAS2R可减少依赖免疫球蛋白(immunoglobulinE,IgE)活化的肥大细胞释放组胺和前列腺素D2,抑制肺巨噬细胞释放炎性因子[23];激活TAS2R及其下游信号通路,可舒张气道平滑肌,作用强于β2受体激动剂[4]。因此,通过多种防御功能,TAS2R有望成为慢性阻塞性肺疾病、支气管哮喘等气道炎症性疾病新的防治靶点,但TAS2R及其信号通路是否也与ARDS的发生发展相关,目前少有研究报道。本课题组前期生物信息学研究结果表明,TAS2R39可能在ARDS发生机制中发挥重要作用[24]。此外,已有研究认为苦味中药可经TAS2R途径遏制气道炎症过程[25]。喜炎平注射液属于苦味中药,为研究喜炎平注射液能否通过TAS2R在治疗ARDS中发挥抗炎作用,本研究检测了2组患者治疗前、后全血TAS2R39 mRNA表达,结果显示对照组ARDS患者治疗前、后全血TAS2R39 mRNA的表达水平无差异,但观察组ARDS患者经喜炎平注射液联合治疗后全血TAS2R39 mRNA表达上调且与IL-6、CRP水平均呈负相关,此外这2种炎性因子水平较治疗前及对照组治疗后的水平均有降低,提示喜炎平注射液可能通过上调TAS2R39表达发挥抗炎效应。
综上所述,喜炎平注射液能改善ARDS患者的氧合功能,其机制可能是通过激活TAS2R途径来抑制炎症反应,故本研究结果可为喜炎平注射液辅助治疗ARDS的临床应用提供依据。但本研究尚存不足,如样本量偏少,未纳入重度ARDS患者,只检测了全血标本TAS2R39 mRNA表达,故后续还需扩大样本进一步深入研究。
