阿糖胞苷对人急性髓系白血病细胞活力、凋亡的作用及机制*
2022-01-21彭煜晖梁欣明付文莉喻艳琴段娟娟吴昌学张启芳
彭煜晖,梁欣明,付文莉,喻艳琴,段娟娟,吴昌学*,张启芳*
(贵州医科大学 地方病与少数民族疾病教育部重点实验室 & 贵州省医学分子生物学重点实验室,贵州 贵阳 550004)
急性髓系白血病(acute myeloid leukemia,AML)是一种由髓系造血祖细胞异常增殖和分化引起的高度异质性的恶性克隆性疾病,可继发于肿瘤相关疾病的化疗、放疗,或者是由其他血液相关疾病转化而来,患者都具有不同分析遗传学的异常,这与AML的发生发展密切相关[1];通过骨髓细胞的异常增殖和分化,浸润到血液、骨髓血和其他组织中,导致造血功能受损和各种并发症[2-3]。对于大多数类型急性白血病,化疗仍是主要的治疗手段。化疗药物大多通过诱导肿瘤细胞凋亡而发挥抗肿瘤的作用[4]。阿糖胞苷(cytarabine,Ara-C)是白血病治疗中最为经典的药物之一,能够诱导人白血病细胞凋亡发挥抗肿瘤作用,至今急性白血病的大部分治疗方案仍以其为基本组成[5-6]。Ara-C进入人体后会转化和Ara-C三磷酸,对DNA合成进行抑制,是一种S期特异性药物[7];并且Ara-C能够诱导HL-60细胞凋亡,还可伴c-Myc、B淋巴细胞瘤-2(B-cell lymphoma-2,BCL-2)基因的下调[8]。c-Myc作为最为普遍的致癌转录因子之一,广泛参与多种癌症的发生发展过程并且在多种肿瘤中异常表达,c-Myc与侵袭性疾病和不良预后有关,其高表达能增强肿瘤细胞增殖、抑制细胞凋亡和分化失调[9-11]。在套细胞淋巴瘤 Jeko-1 细胞株中沉默c-Myc,对细胞的增殖分化活性有明显的抑制[12];更重要的是,几乎所有AML细胞的增殖和存活都依赖于c-Myc[13];抑制c-Myc基因能够阻止白血病的发生和白血病细胞的增殖和存活[14-15]。因此,c-Myc常作为抗白血病治疗的关键分子靶点[16]。由于c-Myc没有酶的活性位点,其抑制剂治疗白血病效果较差、且尚未取得成功[13]。因此,c-Myc靶基因的确定在治疗白血病尤为重要。由于Ara-C在AML中作用机制的尚未阐明,导致耐药和复发成为治疗的难题,本研究探讨Ara-C对AML细胞MV4-11的细胞活力、凋亡和HMGB1/c-Myc表达的影响及作用机制,现将结果汇报如下。
1 材料与方法
1.1 实验材料
1.1.1细胞来源 人AML细胞MV4-11为地方病与少数民族疾病教育部重点实验室所保留。
1.1.2主要试剂与仪器 lscove's DMEM培养基(美国CORNING),澳洲胎牛清(美国Gibco),Ara-C(美国SIGMA-ALDRICH),兔抗单克隆抗体c-Myc、高迁移率族蛋白1(high mobility group box 1,HMGB1)和过氧化物酶(horseradish peroxidase,HRP)标记抗兔的二抗(美国CST),超敏华轩发光试剂盒(enhanced chemiluminescence,ECL)和聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜(美国Millipore),二辛可宁酸(bicinchoninic acid,BCA)蛋白定量试剂盒和蛋白三色Marker(美国Thermo),抗体稀释液、5%脱脂奶粉封闭液、十二烷基苯硫酸钠-聚丙烯酰胺(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)凝胶配置试剂盒(中国碧云天),二甲基亚砜(dimethyl sulfoxide,DMSO;美国Sigma);GeneGnome XRO NPC化学发光成像仪(英国SYNGENE),Varioskan LUX 多通道酶标仪(美国 Thermo Fisher Scientific),Bio-Rad MiniⅡ/Ⅲ垂直电泳仪和Bio-Rad powerpacHC高流电源(美国 Bio-Rad)。
1.2 实验方法
1.2.1细胞培养与细胞活力检测 将人AML细胞MV4-11置于10%胎牛血清和1% Antibiotic-Antimycotic的lscove’s DMEM培养基,5%CO2的37 ℃培养箱中培养;取对数生长MV4-11细胞并调整细胞悬液浓度为1×104个/孔,接种于96孔板中;使用DMSO、0.5、1.0及1.5 μmol/L Ara-C处理(DMSO、0.5、1.0及1.5 μmol/L组),按照细胞计数试剂盒8(cell counting kit-8,CCK8)说明书要求,分别于24、48和72 h检测450 nm波长处的光密度(optical density,OD)值。
1.2.2细胞凋亡实验 分别用DMSO、Ara-C处理人AML细胞MV4-11细胞,Ara-C终浓度为0.5、1.0及1.5 μmol/L,于37 ℃的5%CO2培养箱中孵育48 h,收集细胞;利用Annexin V/PI双染法凋亡试剂盒检测Ara-C对MV4-11细胞凋亡的影响;将样本上流式细胞仪检测,以DMSO组作为空白对照,用FlowJo V10软件(treestar)分析数据。
1.2.3蛋白印迹(Western blot)法检测Caspase 3、c-Myc及HMGB1蛋白表达 取对数生长期人AML细胞MV4-11细胞作为空白组,1.0 μmol/L Ara-C处理对数生长期的人AML细胞MV4-11细胞3、6、12、24及48 h;收集各组细胞,提取总蛋白,蛋白上样20 μg,80 V恒压电泳并转膜至PVDF膜;5%脱脂牛奶室温下封闭1 h,室温分别孵育Caspase3一抗(1∶1 000)、c-Myc一抗(1∶1 000)及HMGB1一抗(1∶1 000)2 h,然后室温孵育抗兔二抗(1∶1 000)1 h,ECL超敏化学发光液检测Caspase 3、c-Myc及HMGB1蛋白的表达,并利用Image J分析图像强度。
1.2.4c-Myc与AML患者预后 利用cBioportal(http://www.cbioportal.org/)在线分析工具下载Acute Myeloid Leukemia(OHSU,Nature 2018)数据;利用R包(survminer)将341个样本分c-Myc高表达组(n=231)和c-Myc低表达组(n=110),分析c-Myc与AML患者生存期的相关性。
1.3 统计学分析

2 结果
2.1 细胞活力
使用DMSO、0.5、1.0及1.5 μmol/L Ara-C处理MV4-11细胞24、48及72 h后,CCK8试剂盒检测Ara-C对细胞活力的影响,结果表明,与DMSO组相比,各组MV4-11细胞不同时间的活力均降低,且具有浓度依赖性(P<0.000 1)。见图1。

注:与DMSO组比较,(1)P<0.000 1。
2.2 细胞凋亡
0.5、1.0及1.5 μmol/L Ara-C处理MV4-11细胞48 h,流式细胞仪检测结果显示,与DMSO组相比,随着Ara-C浓度的增加,凋亡细胞所占的比例明显升高,且具有浓度依赖性(P<0.05),表明Ara-C能诱导MV4-11细胞的凋亡。见图2。
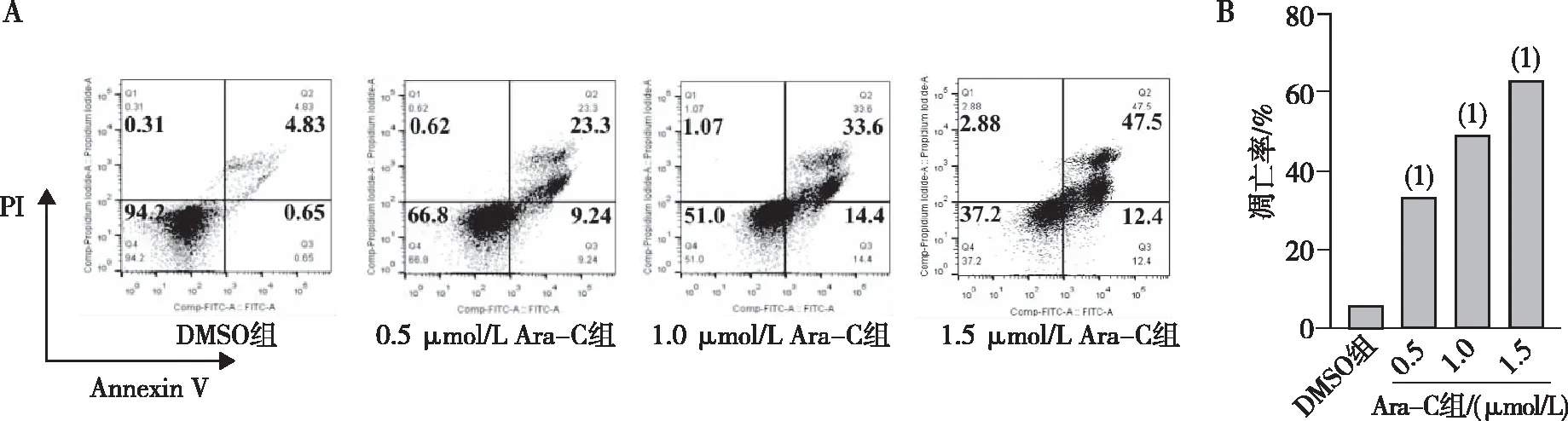
注:A、B分别为流式细胞仪检测结果和细胞凋亡定量结果;(1)与DMSO组相比,P<0.001。
2.3 Caspase 3蛋白表达
1.0 μmol/L Ara-C处理3、6、12、24及48 h后,蛋白印迹检测Caspase 3的蛋白表达水平,结果显示,与DMSO组相比,1.0 μmol/L Ara-C处理后Caspase 3表达水平降低,且具有时间依赖(P<0.05),提示Ara-C处理MV4-11细胞后能够使Caspase3活化,从而促进细胞凋亡。见图3。
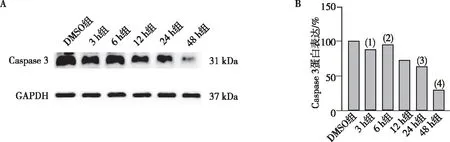
注:A、B分别为检测Caspase 3结果和蛋白定量结果;与DMSO组比较,(1)P<0.01,(2)P<0.05,(3)P<0.001,(4)P<0.000 1。
2.4 c-Myc表达对AML患者生存的影响
使用cBioportal数据库下载Acute Myeloid Leukemia(OHSU,Nature 2018)数据,分析c-Myc对AML患者生存的影响。结果表明,c-Myc高表达与AML患者较差生存期呈正相关(P<0.05)。见图4。
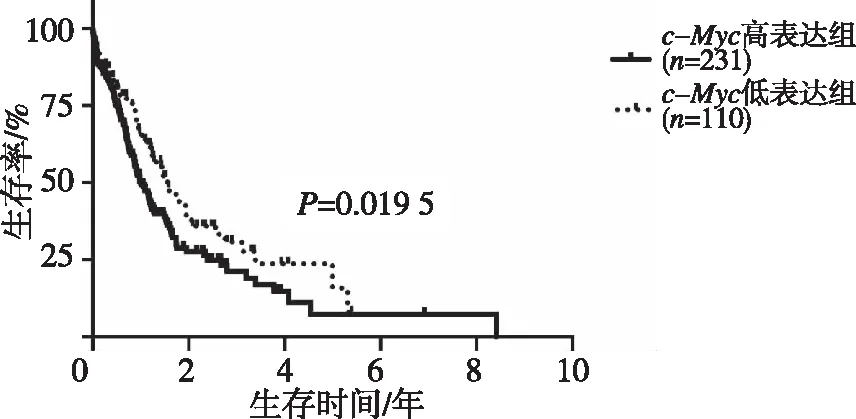
图4 不同c-Myc表达对AML患者生存的影响
2.5 c-Myc和HMGB1蛋白表达
Western blot结果表明,与空白组相比,1 μmol/L Ara-C处理MV4-11细胞3、6、12、24及48 h 后HMGB1和c-Myc的蛋白表达水平均降低,差异均有统计学意义(P<0.05)。见图5。

注:A为HMGB1和c-Myc蛋白表达;B、C分别为c-Myc和HMGB1定量结果;与空白组比较,(1)P<0.01,(2)P<0.001,(3)P<0.000 1,(4)P<0.05。
3 讨论
AML属于血液系统的恶性肿瘤,主要特征为发病快、病情进展迅速、控制难、易复发、预后差及发病率随着年龄的增加而上升[17-18]。因AML发病原因尚不明确,如不及时进行治疗,患者生存期较短[19]。目前,对于AML治疗主要以化疗为主,而Ara-C是AML巩固治疗中使用频率较高的药物[20]。本研究旨在探索Ara-C诱导MV4-11细胞凋亡、抑制细胞活力的分子机制研究。研究结果表明,与DMSO组相比,随着Ara-C浓度的增加,MV4-11细胞的活力被抑制及凋亡数量增加(P<0.05),表明Ara-C能够抑制细胞活力和诱导MV4-11细胞的凋亡,并且具有浓度依赖性;利用cBioportal数据库下载数据进行分析,结果表明c-Myc与AML患者的总生存期呈正相关(P<0.05),即c-Myc高表达与患者的不良预后相关;与DMSO组相比,Ara-C下调了HMGB1/c-Myc的蛋白表达水平(P<0.05),进一步说明Ara-C诱导MV4-11细胞凋亡的分子机制。
Ara-C是一种用于细胞增殖期的嘧啶类抗代谢药物,通过抑制细胞DNA的合成,干扰细胞的增殖,并且能通过Caspase9诱导线粒体介导的细胞凋亡[21]。同样,本研究结果表明Ara-C能够抑制MV4-11细胞的活力及诱导细胞的凋亡(P<0.05),且具有浓度依赖性(P<0.05)。
c-Myc能直接与基因启动子区的E-box结合,调控多种基因的表达,参与细胞周期以及细胞生长、凋亡、分化和代谢等关键进程[22]。已有研究显示,c-Myc过表达可促进原癌基因RAS突变引发胶质瘤生长[23];敲低c-Myc能显著抑制细胞增殖和肿瘤的生长[24];白血病细胞异常生长和增殖与c-Myc的高表达呈正相关,并且患者较差预后[25]。这些研究与本研究结果一致,c-Myc高表达与AML患者的总生存期呈正相关(P<0.05);Ara-C能抑制MV4-11细胞中c-Myc的蛋白表达水平且具有浓度依赖(P<0.05)。本课题组前期研究显示,在去势抵抗性前列腺癌中HMGB1与c-Myc的表达有一定相关性,即HMGB1对c-Myc表达具有正向调控作用[26]。也有研究结果显示,c-Myc磷酸化水平会随着HMGB1的表达变化而变化[27];更重要的是HMGB1在白血病发病机制有着重要的作用,化疗后白血病细胞能释放HMGB1,从而抑制Bcl-2表达和Caspase3活性,最后对白血病细胞坏死性凋亡起着负调节作用[28-29]。在慢性粒细胞白血病中,敲低HMGB1能在G1期阻滞细胞周期,同时通过下调环氧合酶2(cyclooxygenase-2,COX-2)表达来抑制细胞增殖[30];在人高转移肝癌细胞HCCLM3中,沉默HMGB1的表达能够抑制c-Myc和磷酸化c-Myc的表达[27];结直肠癌研究也表明,HMGB1可通过影响糖原合成酶激酶3β(glycogen synthase kinase-3 beta,GSK3β)/c-Myc通路,从而抑制细胞的迁移和侵袭能力[31]。这些研究结果与本研究一致,表明Ara-C能够抑制MV4-11细胞HMGB1和c-Myc蛋白表达水平,从而诱导细胞凋亡和抑制细胞活力。
综上,Ara-C可通过下调HMGB1/c-Myc的表达来抑制人AML细胞活力和诱导细胞凋亡,这为后续的研究工作提供一定的基础,有望在体内实验验证本研究的假设。
