雌性健康和绝经小鼠长骨及颌骨来源骨髓间充质干细胞生物学特性的比较*
2022-01-21胡珊珊张为曹炜胡小华林雪杨晓红
胡珊珊,张为,曹炜**,胡小华,林雪***,杨晓红****
(1.遵义医科大学附属口腔医院 修复科,贵州 遵义 563006; 2.陆军军医大学第一附属医院 口腔科, 重庆 400038; 3.遵义医科大学附属口腔医院 颌面外科, 贵州 遵义 563006)
绝经后骨质疏松症(postmenopausal osteoporosis,POP)是指中老年妇女在雌激素降低、缺乏后的一种以全身骨量减少、骨组织微环境改变所致的骨脆性增加、并发骨折风险上升的全身骨代谢性疾病[1]。一般情况下,绝经后骨组织微环境会发生变化,骨髓间充质干细胞等非造血干细胞发生特定生物学功能障碍,新骨形成不足,引发骨质疏松症[2]。有报道显示,颌骨及长骨不仅在胚胎发育的组织来源和细胞的信号传导机制存在差异,而且在细胞分化和成骨基因等表达方面也有不同[3-4],但膜内成骨的颅颌面骨和软骨内成骨的长骨两者之间存在的具体差异未见深入研究。因此,本研究将绝经后骨质疏松状态与正常健康状态下小鼠长骨来源的骨髓间充质干细胞(bone-marrow-derived mesenchymal stem cells, BMMSCs)和颌骨来源的骨髓间充质干细胞(jaw mandibular bone marrow mesenchymal stem cells,JMMSCs)进行增殖能力、成脂分化以及成软骨分化性能对比,观察两种状态下的骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)生物学特性是否存在差异,为临床颌骨骨缺损治疗及修复提供依据。
1 材料与方法
1.1 实验动物及材料
SPF级雌性健康C57BL/6小鼠,8周龄,体质量(20±2)g,购自重庆腾鑫生物技术有限公司[许可证号 SCXK(京)2019-0010]。α-MEM培养基、胎牛血清(FBS)均购自Gibco公司,胰蛋白酶、磷酸盐缓冲液(PBS)以及青链霉素均购自Hyclone公司,CKK-8检测试剂盒购自碧云天公司,茜素红染液、油红O染液和阿利新蓝染液均购自Solarbio公司。
1.2 实验方法
1.2.1绝经后骨质疏松小鼠动物模型的构建 雌性C57BL/6小鼠(6月龄)36只,麻醉后剃除其背部毛发,用碘伏消毒剃毛部的皮肤,剪开背部皮肤,分层剥离皮下、脂肪及腹腔层,其中18只小鼠找到脏层的双侧卵巢,结扎和剪弃,作为绝经后骨质疏松小鼠模型组(ovariectomies group,OVX组),另外18只小鼠仅剪去卵巢周围组织作为正常对照组(sham-operated group,SHAM组),两组小鼠低钙饲养12周后用于本次实验。
1.2.2BMSCs的分离、纯化与培养 将已成功建模的OVX组及SHAM组小鼠饲养12周后采用颈部脱臼法处死,取其下颌骨和长骨(包括股骨及胫骨),去净黏附于骨的软组织和筋膜,然后用1 mL注射器和α-MEM完全培养基(20%FBS,100 U/mL青链霉素混合液)反复冲洗骨髓腔,制成骨髓单细胞悬液,共4组,分别为OVX-BMMSCs组、SHAM-BMMSCs组、OVX-JMMSCs组以及SHAM-JMMSCs组。长骨组骨髓单细胞悬液直接放入T25 cm2的培养瓶中培养,颌骨组骨髓单细胞悬液则连同剪碎后的下颌骨组织一同放入T25 cm2的培养瓶中培养,培养液均为5 mL,每3 d换1次培养液,待细胞融合生长达85%后用0.25%胰蛋白酶消化传代,本实验所用细胞主要为第3代。
1.3 观察指标
1.3.1骨组织形态学 将已成功建模的OVX组及SHAM组小鼠饲养12周后采用颈部脱臼法处死,取其下颌骨和长骨并去净粘附于骨的软组织和筋膜;4%多聚甲醛室温固定 48 h,然后用 EDTA 脱钙液常温下脱钙3周,每3 d更换1次脱钙液;将脱钙好的标本在流水下冲洗8 h,用酒精行梯度脱水后进行石蜡包埋,以约10 μm切片,HE染色,观察骨凹陷窝、骨小梁排列形态等病理学指标。
1.3.2BMSCs增殖能力(CCK-8法) 将颌骨及长骨来源的BMSCs以6×103个/孔接种于96孔板中,100 μL/孔,每组每天设5个复孔,7 d共接种7个96孔板,每3 d换1次培养液;第1~7天,每天同一时间取出一个板,每个培养孔加入CCK-8液10 μL和完全培养基90μL,37 ℃孵育2 h,用酶标仪490 nm 波长检测吸光度值(OD值),绘制增殖曲线。
1.3.3脂滴含量检测(油红O染色) 将颌骨及长骨组BMSCs以每毫升1×105个接种于24孔板,每3 d换1次液,待细胞长至板底85%~90%时,更换为成脂诱导培养基。14 d后吸弃诱导培养基,加入细胞固定液固定30 min,加入新配制的60%异丙醇作用5 min;弃去60%异丙醇后加入新制备的ORO Stain液,染色15 min,PBS轻轻洗3 min;加入Mayer苏木素染色1 min,PBS反复洗涤3遍;加入ORO Buffer液静置1 min后弃去加入蒸馏水,镜下观察脂滴分布图样并拍照;拍照完毕后进入定量,加入适量的异丙醇溶液于孔中,静置10 min,收集溶解的液体,加入96孔专用板中,使用酶标仪在520 mm处检测溶解的液体的OD值。
1.3.4软骨基质含量检测(阿利新蓝染色) 将颌骨及长骨组BMSCs以每毫升1×105个的剂量接种于24孔板,每3 d换1次液,待细胞长至板底85%~90%时,更换为成软骨诱导培养基,每3d替换1次诱导培养基,21 d后弃去诱导培养基,加入细胞固定液作用30 min,PBS轻轻洗涤2遍,加入阿利新蓝染色液作用30 min;PBS冲洗3 min,Alcian酸化工作液(工作液∶蒸馏水=1∶2,提前5 min配好)处理1 min;PBS冲洗2次,倒置显微镜下观察软骨球形成的样貌并拍照。阿利新蓝染液是一种能附着于软骨细胞的基质蓝色染液,其染色越深代表其软骨基质含量越多。ALP定量分析:去除原培养液,加入适量细胞裂解液(不含蛋白酶抑制剂),置于摇床,冰上裂解30 min;取上清液,测定总蛋白浓度,按照ALP试剂盒说明书测定405 nm处OD值。根据标准品的OD值绘制曲线,计算获得各组ALP定量结果。
1.4 统计学方法

2 结果
2.1 组织形态学观察
小鼠的下颌骨、股骨 HE染色结果显示:与SHAM组相比,OVX组小鼠的骨小梁排列较紊乱,骨吸收明显,出现了较多大小规则不同的骨凹陷窝,见图1。

注:A为OVX组颌骨,B为SHAM组颌骨;C为OVX长骨,D为SHAM长骨。
2.2 BMSCs的分离、纯化与培养
经全骨髓贴壁法培养后,在光学显微镜下观察4组BMSCs的生长情况及细胞形态,可见4组BMSCs 均能贴壁生长,传至第3代的4组BMSCs形态相似,呈三角形或梭形,有参差不齐的细胞突起。见图2。

注:A、B 为OVX-BMMSCs组,C、D为SHAM-BMMSCs组;E、F为OVX-JMMSCs组,G、H为SHAM-JMMSCs组。
2.3 BMSCs增殖能力
CCK-8法检测结果显示,4组BMSCs细胞随着培养时间的延长,细胞的增殖活性呈升高趋势(图3,P=0.034)。从培养第4 天开始,OVX组和SHAM组细胞增殖速度达对数生长期,且JMMSCs的增殖能力明显强于BMMSCs组(OVX-JMMSCs组与OVX-BMMSCs组比较,P<0.05;SHAM-JMMSCs组与SHAM-BMMSCs组比较,P<0.05)。

注:A为OVX组,B为SHAM组。
2.4 脂滴含量
油红O定量分析结果表明:JMMSCs形成的脂滴含量均较少于BMMSCs(P<0.001)。见图4。

注:A 为SHAM-BMMSCs组,B为SHAM-JMMSCs组,C为OVX-BMMSCs组,D为OVX-JMMSCs组,E为4组细胞油红O定量结果;(1)与SHAM组BMMSCs比较,P<0.001;(2)与OVX组BMMSCs比较,P<0.001。
2.5 软骨基质含量
阿利新蓝染色结果显示:4组BMSCs均可见染成蓝色的成软骨基质,呈异染性着色(见图5)。ALP定量显示SHAM组和OVX组的JMMSCs与BMMSCs的软骨基质含量差异无统计学意义(SHAM组JMMSCs与BMMSCs比较,P=0.203;OVX组JMMSCs与BMMSCs比较,P=0.776)。见图5。
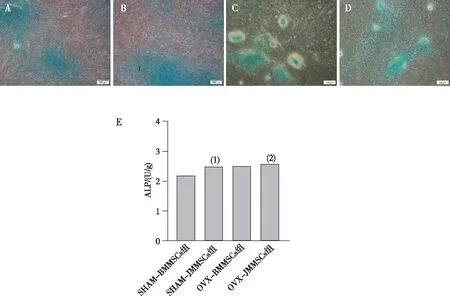
注:A为SHAM-BMMSCs组,B为SHAM-JMMSCs组,C为OVX-BMMSCs组,D为OVX-JMMSCs组,E为4组细胞ALP定量;(1)与SHAM组BMMSCs比较,P=0.203;(2)与OVX组BMMSCs比较,P=0.776。
3 讨论
近年来,中国社会老龄化趋势迅猛,骨质疏松症已经成为危害老年人健康的重大慢性病之一。据统计,中国人群中患绝经后骨质疏松症并发骨折的80岁以上人群数量比在50~59岁人群上升4倍多,这为家庭及社会造成巨大的经济负担[5]。颌骨作为全身骨骼系统改建较为活跃的一部分,同样会受到骨质疏松的影响,发生颌骨骨质疏松的危害在口腔相关疾病中的表现主要在于会促使牙槽骨的快速吸收和加快牙周炎的发展,从而对义齿修复、种植和颌面外科手术等口腔科治疗带来困难[6-7]。现今,对骨质疏松症治疗方式主要为药物治疗,包括雌激素替代疗法、降钙素、选择性雌激素受体调节剂等,但是这些药物主要针对全身性的骨质疏松症,且药物的毒副作用、长期运用的安全性都给临床治疗带来了挑战[8-9]。随着干细胞生物医学的深入研究,针对干细胞的医学治疗正在兴起。
BMSCs作为具有强增殖、自我更新及多向分化潜能的干细胞,能在特定培养条件下向成骨细胞、成纤维细胞、脂肪细胞、软骨细胞、神经细胞等多向分化,在移植物抗宿主免疫、修复组织损伤及基因靶向治疗等方面具有较大应用前景[10-11];尽管均属于全身骨骼的一部分,但是在组织发生方面,颌骨来源于外胚层的神经嵴细胞,长骨来源于中胚层的间叶细胞;在组织成骨方式方面,颌骨的形成以膜内成骨为主,而长骨则以软骨内成骨为主[12-14]。在本研究中,将两种来源的BMSCs分开研究,在同样的培养条件下,发现无论是在健康状态还是绝经后骨质疏松状态下JMMSCs的成脂能力都比BMMSCs弱,分析其原因可能一是两种细胞的骨形成方式不同,可能造成了颌骨对微环境刺激、细胞因子等生物调节的敏感度不同于长骨;二是颌骨受到咀嚼、言语和吞咽所产生的持续机械刺激,从而刺激骨重塑,使颌骨与长骨之间的骨重塑率不同,有研究发现在犬模型中,下颌骨的周转率是胫骨的10倍[15],因此可能造成JMMSCs增殖能力强于BMMSCs。此外,本研究所采用的动物模型为啮齿类动物,其颌骨存在终身生长发育的特点,骨骼肌的不断刺激使得咀嚼系统不断改建与完善,这有利于观察到骨质疏松时骨微环境的变化;而人在出生后,颌骨的生长发育主要有两种方式,即髁突的软骨内成骨和膜内成骨,这使得颌骨向垂直、内外及前后不同方向生长,但在青少年时期则发育完全,最晚发育完全的髁突也在20~25岁就停止了[16]。骨形成与破坏的原因主要在于BMSCs分化功能在成脂与成骨等方向不平衡,使得骨微环境中破骨细胞与成骨细胞产生差异,因此本研究模型对今后研究其他种属的骨改建仍有一定参考意义。
本实验中发现骨质疏松状态下BMSCs的生物学特性发生了改变,但调控其分化的机制却有许多[17-18]。首先在经典的信号通路研究中,BMP/Smads信号通路及OPG/RANK/RANKL信号通路与BMSCs分化有着密不可分的关系[19-21],Hu等[22]更是发现BMP I型受体蛋白也参与了下颌骨骨代谢平衡。此外,一些转录因子也参与了BMSCs分化,其中转录因子Runx2是BMSCs分化的重要决定因子,Lai等[23]发现Runx2和Osterix上调可以加速骨代谢,促进骨折愈合。近年来,有关非编码RNA的研究正在兴起,研究发现这类RNA能通过调控骨相关信号通路对BMSCs分化产生控制[24],本课题组前期研究就发现敲低小鼠颌骨骨髓间充质干细胞中的miR-705表达,可上调成骨相关基因表达,促进BMSCs向成骨分化[25]。
综上所述,无论是健康状态还是绝经后骨质疏松状态下,小鼠颌骨及长骨来源的BMSCs确实存在增殖及成脂分化能力的差异,研究相应内容时应分开进行,这为干细胞应用和骨组织缺损修复提供了重要参考。
